乳腺癌新辅助化疗前后分子生物学指标的变化及其与疗效的相关性
郎 洁,张 超,宋庆文,李 鹏
(北京市隆福医院普外科,北京 100010)
当前,乳腺癌的发病越趋年轻化,发病率也在逐年上升,给女性人群的健康带来严重威胁[1]。乳腺癌的治疗仍以手术为中心,放化疗、内分泌、分子靶向治疗、免疫治疗等治疗并行的模式。新辅助化疗是上世纪70 年代提出的概念,研究表明新辅助化疗可降低肿瘤的大小和分期,以利于后续的手术治疗。不同肿瘤和同一肿瘤的不同子代之间在核型突变上存在一定差异,导致肿瘤细胞在药物治疗敏感性上存在差异。化疗后生存能力较弱的肿瘤细胞被杀死,对化疗不敏感的肿瘤细胞则可继续增殖、导致肿瘤复发或转移[2]。HER-2、ER、PR 和Ki-67 是乳腺癌研究中常用的分子生物学指标。本研究探讨了新辅助化疗前后HER-2、ER、PR 和Ki-67 等分子生物学指标表达的变化情况及其与疗效的相关性。以期为预测乳腺癌新辅助化疗的敏感性,为乳腺癌患者逐步开展个体化治疗提供依据。
1 资料与方法
1.1 一般资料收集2013 年1 月~2018 年6 月我院普外科收治的行新辅助化疗的初治女性乳腺癌患者98例为研究对象。所收集的患者新辅助化疗前均行核心针穿刺活检,明确病理类型与分级。病例纳入标准:①初治女性乳腺癌患者,影像及病理活检确诊为乳腺癌;②年龄20~60 岁;③肿瘤直径>3cm;④一般状况可,心功能LVEF >50%,Karnofsky 体能状态>70%,无化疗及手术禁忌;⑤化疗方案为TEC 方案或ET 方案;⑥病例资料完整。排除标准:①特殊类型乳腺癌;②有远处器官转移者。98 例患者年龄33~58 岁,平均年龄46.8±13.2 岁,其中有2.04%(2/98)具有乳腺癌家族遗传史,71.4%(70/98)入院查体或影像学检查时发现有腋窝淋巴结肿大。98 例患者的肿瘤位置、病理类型、组织学分级、分子分型等资料如表1 所示。
1.2 分子生物学标记物判定新辅助化疗前通过核心针穿刺活检术获得肿瘤组织,化疗后取根治术所获得的肿瘤组织标本。组织标本经免疫组化染色后,由病理科医师读片,选取5 个400 倍视野,ER、PR、Ki-67阳性为细胞核内可见棕黄色染色颗粒,Her-2 阳性为胞浆或胞膜中可见棕黄色染色颗粒。依据阳性细胞数量核和染色强度半定量。无阳性细胞记0 分;可见1%~30%阳性细胞记1 分;31%~70%阳性细胞记2分;71%~100%阳性细胞记3 分。染色浅棕色记1 分;棕黄色记2 分;深棕色记3 分。每张切片将阳性细胞数量核和染色强度两项分数加和:0 分为阴性;1~2 分为“+”;3~4 分为“++”;5~6 分为“+++”。ER、PR“+”及以上以上均记为表达阳性。Her-2“+++”及以上以上均记为表达阳性。Ki-67 阳性细胞数量≥14%记为过表达,Ki-67 阳性细胞数量<14%记为低表达[3]。
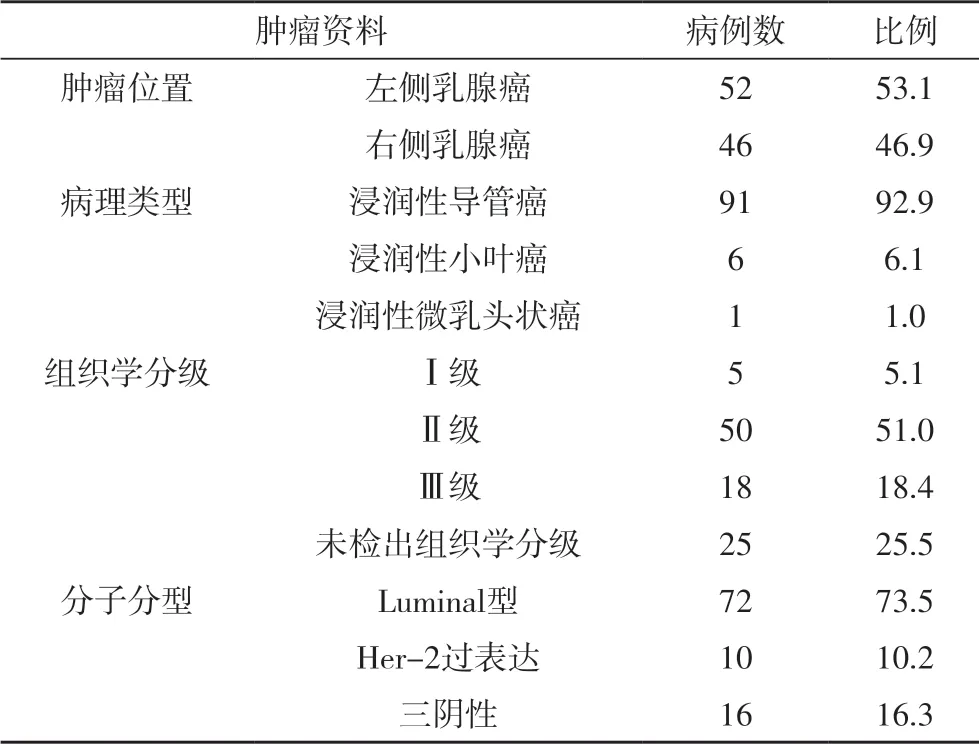
表1 患者肿瘤资料[n(%)]
1.3 化疗疗效评价患者完成4 周期(每21 天为一周期)新辅助化疗后3 周行手术根治。采用Miller-Payne分级系统对新辅助化疗的疗效进行评价,通过手术前后标本配对检查,对治疗后肿瘤细胞减少的比例进行分级。1 级表示肿瘤细胞数量总体上无减少,2 级为肿瘤细胞减少不超过30%,3 级表示为肿瘤细胞减少30%~90%,4 级为肿瘤细胞明显减少超过90%,5 级肿瘤瘤床部位切片未见浸润性癌细胞,但可存在导管原位癌。统计分析时,将Miller-Payne 分级1 级和2 级合并,3 级和4 级合并。
1.4 统计学方法研究数据均采用SPSS 22.0 软件处理,计数资料以n 或%表示,行χ2值检验;计量资料用mean±SD 形式表示。P< 0.05 为差异具有统计学意义。
2 结果
2.1 新辅助化疗疗效98 例乳腺癌患者行4 周期化疗后,有2 例(2.0%)化疗无效,Miller-Payne 分级为1 级;31 例(31.6%)获得Miller-Payne 分级2 级;47 例(48.0%)获得Miller-Payne 分级3 级;18 例(18.4%)获得Miller-Payne 分级4 级;无1 例获得Miller-Payne 分级5 级。
2.2 新辅助化疗前后分子生物学指标的比较新辅助化疗后,HER-2、ER、PR 阳性率的变化不具有统计学意义(P>0.05);Ki-67 的过表达率显著降低,差异具有统计学差异(P< 0.05)(表2)。
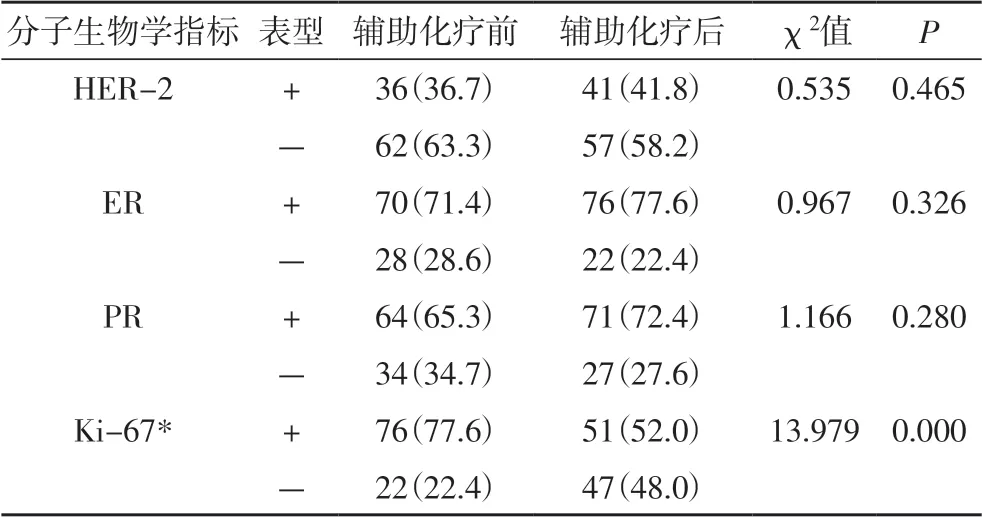
表2 新辅助化疗前后分子生物学指标的比较 [n(%)]
2.3 分子生物学指标的变化与化疗疗效的相关性新辅助化疗后,HER-2、ER、PR、Ki-67 的变化率分别为23.5%(23/98)、12.2%(12/98)、15.3%(15/98)、50.0%(49/98)。其中HER-2、ER、PR 的变化与化疗Miller-Payne 分级不具明显有相关性(P>0.05),化疗前ER、PR阳性的患者化疗后Miller-Payne 分级为3~4 级的比例较高。Ki-67 的变化与化疗Miller-Payne 分级具有明显相关性,化疗前Ki-67 过表达的患者化疗后Miller-Payne 分级为3~4 级的比例更高(P< 0.05)(表3)。
3 讨论
乳腺癌的治疗以手术为主,当手术切除原发灶后,远端转移病灶可能会增殖分化,使肿瘤复发或加重。术前采用新辅助化疗,可缩小肿瘤体积与范围,降低肿瘤分期,有利于后续的手术治疗及减少术后的复发[4,5]。本研究中,新辅助化疗对患者产生了较好的效果,有65例(66.4%)患者在4 周期的化疗后获得了获得Miller-Payne 分级3~4 级。但是仍有少数病例对新辅助化疗敏感性不佳。据Colleoni 等报道,约10%~35%的患者在新辅助化疗中会因药物的选择作用产生耐药性基因突变[6]。耐药后,肿瘤细胞将进一步增殖分化,加速病情恶化,可能导致错失最佳手术时机。肿瘤细胞的突变可影响肿瘤分子生物学指标的表达,本研究探讨了新辅助化疗前后HER-2、ER、PR 和Ki-67 等分子生物学指标表达的变化情况及其与疗效的相关性。
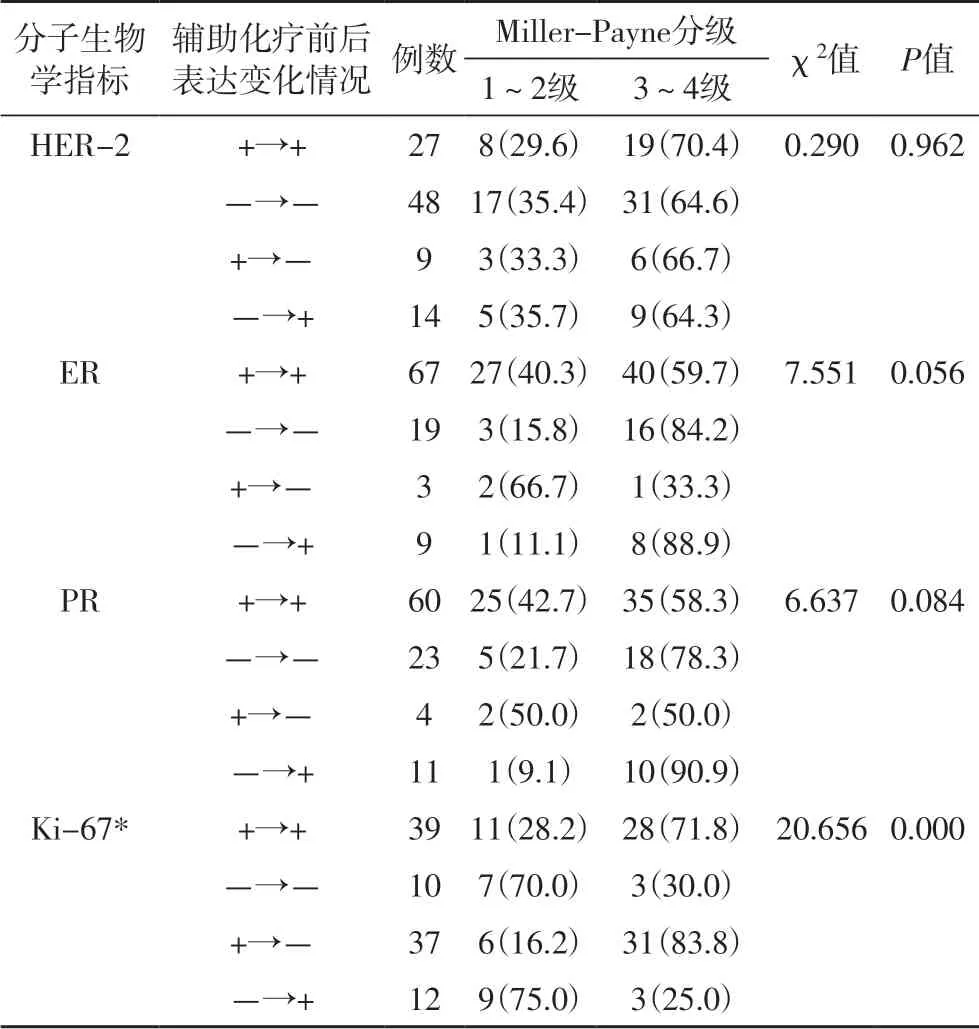
表3 分子生物学指标的变化与化疗疗效的相关性 [n(%)]
ER 和PR 分别为雌激素受体和孕激素受体,为基因调节蛋白,对腺体细胞的增殖分化起着调控作用。在肿瘤细胞中,因细胞的分化和活跃程度不同,ER 和PR的表达也不尽相同。Zambetti 等的研究报道,约50%的乳腺癌患者ER 和PR 表达为阳性[7]。本组病例中,患者新辅助化疗前ER 和PR 阳性率分别为67%和60%,略高于Zambetti 等的研究,这可能与阳性的判断标准和所选病例的不同有关。本研究结果显示,新辅助化疗后,ER 和PR 的阳性率有小幅上升,与化疗前比较差异无统计学意义。另外,化疗前ER、PR 阴性的患者化疗后Miller-Payne 分级为3~4 级的比例较高。提示ER、PR 阴性状态可能对化疗药物获得较高的敏感性,这与Krishnan 等研究的结果相似[8]。其机理可能时因为ER、PR 阴性的肿瘤细胞增殖分化速度更快,在此情况下更易被化疗药物杀死。化疗后ER 和PR 的阳性率增加,可能与化疗杀灭了ER、PR 阴性的肿瘤细胞,筛选出了ER、PR 阳性的肿瘤细胞有关。
Her-2 在人乳腺癌等恶性肿瘤中具有重要作用,能抑制肿瘤细胞凋亡,甚至促进肿瘤生长。多项研究表明,Her-2 的表达状态与化疗疗效不相关[9]。本研究中Her-2 阳性率化疗前后无明显变化,Her-2 的变化与化疗Miller-Payne 分级不具有相关性。Ki-67 是一种增殖细胞核抗原,与细胞的有丝分裂相关,其表达与恶性肿瘤的增殖率有关,分裂相对静止的肿瘤细胞表达少,增殖活跃的肿瘤细胞表达高。本组研究中,Ki-67在新辅助化疗后过表达率显著降低,Ki-67 的变化与化疗Miller-Payne 分级具有明显相关性,化疗前Ki-67 为过表达的患者化疗后Miller-Payne 分级为3~4 级的比例更高。这与理论相符,也与既往的一些研究结果相符[10,11]。化疗药物易于杀灭增殖活跃的肿瘤细胞,筛选出相对静止的肿瘤细胞,而增殖活跃的肿瘤细胞通常Ki-67 高表达,而相对静止的肿瘤细胞Ki-67 表达低,因此新辅助化疗后Ki-67 的阳性率显著降低。该结果提示,Ki-67 可作为化疗敏感性和耐药性的预测指标。
综上所述,乳腺癌新辅助化疗有助于缩小肿瘤体积与范围,降低肿瘤分期。化疗前ER 阴性或PR 阴性或Ki-67 过表达的患者对化疗的敏感性可能更高。Ki-67 可作为化疗敏感性和耐药性的预测指标。

