茶树隐花色素基因CsCRY1和CsCRY2的克隆及表达模式分析
唐千惠, 王佳欣, 孙 康,c, 曾 亮,c, 吴致君,c,①
(西南大学: a. 食品科学学院, b. 食品科学与工程国家级实验教学示范中心, c. 茶叶研究所, 重庆 400715)
茶树〔Camelliasinensis(Linn.) Kuntze〕隶属于山茶科(Theaceae)山茶属(CamelliaLinn.),为多年生常绿木本植物,是中国重要的叶类经济作物。茶叶中富含茶多酚、茶氨酸和咖啡碱等物质,在抗癌、抗衰老、抗炎症和预防心脑血管疾病等方面发挥一定作用[1-2]。茶叶的产量和品质与茶树的生长环境密切相关,光照是其重要的影响条件之一。如:采摘前适当遮光可提高茶叶中茶氨酸等鲜爽类物质含量,降低黄酮等苦涩味物质含量;长日照条件可延长茶芽可采周期;光质的差异化可影响茶叶多酚类和香气组分[3-5]。目前,尽管凭借种植经验可通过改变光照环境调节茶树的生长,但茶树受光调控机制不明确阻碍了园艺措施精细化和育种定向化[6-7]。
植物中存在一系列的光受体,如光敏色素(phytochromes,PHYs)、向光素(phototropins,PHOTs)、隐花色素(cryptochromes,CRYs)和紫外抗性位点8(UV resistance locus 8,UVR8),通过感知光质特征和光的强弱以及改变光周期调节植物对环境的适应性[8-9]。研究表明:茶树在光照环境中的发育和代谢受到光受体的调控[3-4,10]。因此,进一步开展茶树光受体基因研究对于茶园园艺措施改进和茶树品种改良具有重要意义。
隐花色素是一种类似于光裂解酶的蓝光/近紫外光的光受体蛋白[11-12]。植物中的Plant CRY和CRY-DASH类隐花色素属于光裂解酶/隐花色素超级家族(photolyase/cryptochrome superfamily)[13]。有关植物中Plant CRY类隐花色素的研究较多,其生物学功能较为明确[13]。Plant CRY类隐花色素具有N端的光裂解酶同源区域(photolyase homology region,PHR)以及长度和序列多变的C端隐花色素延伸域(cryptochrome C-terminal extension,CCE)2个结构域[11,13]。Plant CRY类隐花色素通过传导蓝光信号调节植物的生长发育和物质代谢,如抑制下胚轴生长[14]、开花[15]、气孔发育[16]、子叶发育[17]和类黄酮合成[18]等。目前,Plant CRY类隐花色素基因已在多种植物中被分离和鉴定,如拟南芥〔Arabidopsisthaliana(Linn.) Heynh.〕[14]、水稻(OryzasativaLinn.)[19]、小麦(TriticumaestivumLinn.)[20]、番茄(SolanumlycopersicumLinn.)[21]、高粱〔Sorghumbicolor(Linn.) Moench〕[22]、莱茵衣藻(Chlamydomonasreinhardtii)[23]、大豆〔Glycinemax(Linn.) Merr.〕[24]和胡杨(PopuluseuphraticaOliv.)[25]等。Liu等[3]和Zheng等[4]利用茶树转录组和代谢组对其受单色光调控的机制进行了研究,结果显示:蓝光促进茶叶中多酚类物质的积累,推测这可能与隐花色素基因介导调控有关。然而,茶树中隐花色素基因尚未被克隆鉴定,其生物学功能还需进一步研究。
本研究通过同源序列比对茶树基因组和转录组数据[26-27],克隆到2个茶树隐花色素基因,对其编码蛋白序列的功能结构域、系统进化关系、二级结构和PHR结构域的三级结构进行了生物信息学分析,对这2个基因启动子的顺式作用元件进行了预测分析,并利用实时荧光定量PCR技术分析了这2个隐花色素基因在不同组织以及不同光照和激素处理下的表达模式,较为系统地阐述了茶树隐花色素结构和功能特征,以期为进一步开展其在光照环境中网络调控作用机制的研究提供帮助。
1 材料和方法
1.1 材料
供试材料为茶树品种‘福鼎大白茶’(‘Fuding Dabaicha’)1年生扦插苗,购自南京雅润茶叶有限公司。
1.2 方法
1.2.1 处理方法 于2020年4月选取长势一致的茶树幼苗种植于花盆(直径16.5 cm,高17.5 cm)中,栽培基质为体积比1∶1的草泥土和蛭石,然后置于RDN-300B-4人工气候光照培养箱(宁波东南仪器有限公司)中,培养条件为温度25 ℃、光照时间16 h·d-1、光照强度180 μmol·m-2·s-1,白光。培养2周后,用于后续实验。
组织表达分析:分别选用茶树幼苗顶部向下数第3枚叶片、嫩茎、花和嫩根。
光照处理:将茶树幼苗分别置于白光、黑暗、蓝光和红光的培养箱中,分别于处理0和4 h采摘顶部向下数第3枚叶片。每个处理3个生物学重复,每个重复3株。实验用光源(白光、红光和蓝光)均为LED灯,光照强度均为180 μmol·m-2·s-1,其他培养条件与前期培养条件一致。
激素处理:将茶树幼苗置于培养箱中,培养条件与前期培养条件一致。设置0.1 mmol·L-1脱落酸(ABA)、1.0 mmol·L-1吲哚乙酸(IAA)、1.0 mmol·L-1赤霉素(GA3)和1.0 mmol·L-1的茉莉酸甲酯(MeJA)4个激素处理,其中,ABA用蒸馏水配制,IAA、GA3和MeJA用体积分数2%乙醇配制。ABA处理以等体积蒸馏水为对照,IAA、GA3和MeJA处理以等体积的体积分数2%乙醇为对照。每个处理3个生物学重复,每个重复3株。每株幼苗叶片正、反面一次性均匀喷洒20 mL处理液,分别于处理0、4、12和24 h采摘顶部向下数第3枚叶片。
所有样品采摘后迅速浸入液氮中,然后置于-80 ℃冰箱保存,备用。
1.2.2 总RNA提取、cDNA合成及基因克隆 按照Quick RNA Isolation Kit试剂盒(北京华越洋生物科技有限公司)操作说明提取叶、茎和花中总RNA,根中总RNA提取采用Trizol提取法。采用GoldenstarTMRT6 cDNA Synthesis Kit试剂盒(北京擎科生物科技有限公司)反转录合成cDNA第1链。使用Primer premier 5.0软件设计CsCRY1和CsCRY2基因的克隆引物,其中,CsCRY1-CF引物序列为5′-ATGTCAGGACGTGGGTGTAGCATAG-3′,CsCRY1-CR引物序列为5′-TTACCCAGTTTGAGAAAGCCGCCTC-3′;CsCRY2-CF引物序列为5′-ATGGGTAGCAATTCAAAAACCATTG-3′,CsCRY2-CR引物序列为5′-TTAACCTCCCACAGCTCCATTTTTG-3′。CsCRY1基因的PCR扩增体系总体积为50 μL,包括金牌Mix(green)(北京擎科生物科技有限公司)45 μL,10 μmol·L-1CsCRY1-CF和CsCRY1-CR引物各2 μL,1 ng·μL-1模板cDNA 1 μL;CsCRY2基因的PCR扩增体系总体积为50 μL,包括金牌Mix(green)45 μL,10 μmol·L-1CsCRY2-CF和CsCRY2-CR引物各2 μL,1 ng·μL-1模板cDNA 1 μL。基因扩增模板cDNA来自光照处理0 h叶片。扩增程序为:98 ℃预变性2 min;98 ℃变性10 s、55 ℃退火30 s、72 ℃延伸20 s,30个循环;72 ℃延伸1 min。用1.2 g·L-1琼脂糖凝胶电泳回收PCR产物。采用pClone007平末端载体连接PCR产物(北京擎科生物科技有限公司),然后转化到大肠杆菌DH5α感受态细胞中,挑取单克隆,培养、鉴定后送至北京擎科生物科技有限公司测序。
1.2.3 生物信息学分析 基于茶树基因组和转录组[26-27],通过拟南芥AtCRY1(登录号AT4G08920)和AtCRY2(登录号AT1G04400)基因碱基序列进行同源序列比对,检索茶树隐花色素基因。BLASTn和BLASTp序列检索在NCBI(https:∥www.ncbi.nlm.nih.gov/)和BioEdit软件中完成。使用DNAMAN 6.0软件进行氨基酸序列比对。采用MEGA 5.1软件中的Neighbor-joining法构建系统进化树。利用SOPMA(https:∥prabi.ibcp.fr/htm/site/web/home)在线软件预测CsCRY1和CsCRY2蛋白的二级结构。利用SWISS-MODEL(https:∥swissmodel.expasy.org/)在线软件预测CsCRY1和CsCRY2蛋白PHR结构域的三级结构。利用PlantCARE(http:∥bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线软件分析CsCRY1和CsCRY2基因上游1 500 bp内启动子顺式作用元件。
1.2.4 基因的表达模式分析 实时荧光定量PCR(qRT-PCR)在CFX96TMReal-Time System(美国Bio-Rad公司)上进行。设计用于CsCRY1基因检测的CsCRY1-JF引物序列为5′-TAGGGCTGAAGTGCCAACGAATGTC-3′,CsCRY1-JR引物序列为5′-TGTGGTGGAGTTGCGTTGCTTTGGA-3′;设计用于CsCRY2基因检测的CsCRY2-JF引物序列为5′-ATCATTGCTGGGAAGCCTGAAACAT-3′,CsCRY2-JR引物序列为5′-GCATCAACCAAAGGGTAACCAGTCC-3′。扩增体系总体积为20.0 μL,包括2×T5 Fast qPCR Mix(SYBR Green Ⅰ)(北京擎科生物科技有限公司)10.0 μL,10 μmol·L-1正向和反向检测引物各0.8 μL,0.05 ng·μL-1模板cDNA 2.0 μL和ddH2O 6.4 μL。扩增反应程序为:95 ℃预变性1 min;95 ℃变性10 s、60 ℃退火5 s、72 ℃延伸5 s,40个循环。
组织表达和光照处理的内参基因采用ACT基因,其CsACT-F引物序列为5′-GAGATTCCGTTGCCCTGAAGTCCTG-3′,CsACT-R引物序列为5′-TCCTTGCTCATACGGTCTGCGATAC-3′;激素处理内参基因采用TBP,其CsTBP-F引物序列为5′-GGCGGATCAAGTGTTGGAAGGGAG-3′,CsTBP-R引物序列为5′-ACGCTTGGGATTGTATTCGGCATTA-3′[28]。采用Pfaffl[29]的方法计算基因的相对表达水平。
2 结果和分析
2.1 茶树CsCRY1和CsCRY2基因的克隆与分析结果
经序列同源比对,在茶树中获得2个隐花色素基因,登录号分别为CSS0033306.1和CSS0018720.1。根据这2个基因序列设计克隆引物,以茶树品种‘福鼎大白茶’cDNA为模板,扩增获得2条长度约2 000 bp的明亮条带(图1)。经切胶回收和连接转化后测序,测序结果与预测结果一致,将2个基因分别命名为CsCRY1和CsCRY2。CsCRY1基因的开放阅读框长度为2 055 bp,编码684个氨基酸;CsCRY2基因的开放阅读框长度为1 944 bp,编码647个氨基酸。CsCRY1和CsCRY2基因碱基序列的相似度较低,一致性为55.30%。与茶树基因组比对,CsCRY1基因序列包含4个外显子和3个内含子,CsCRY2基因序列包含5个外显子和4个内含子。
2.2 茶树CsCRY1和CsCRY2蛋白的生物信息学相关分析结果
2.2.1 功能结构域分析 利用DNAMAN 6.0软件进行序列比对,发现茶树CsCRY1蛋白与拟南芥AtCRY1蛋白(登录号AAB28724)氨基酸序列的一致性为75.97%,CsCRY2蛋白与AtCRY2蛋白(登录号NP_849588)氨基酸序列的一致性为61.54%。CsCRY1和CsCRY2蛋白氨基酸序列的N端最为保守,具有明显的PHR结构域,该结构域与拟南芥对应氨基酸序列的一致性较高(图2-A)。此外,CsCRY1和CsCRY2蛋白氨基酸序列的C端均具有CCE结构域,该结构域与拟南芥对应氨基酸序列的差异较大(图2-A)。
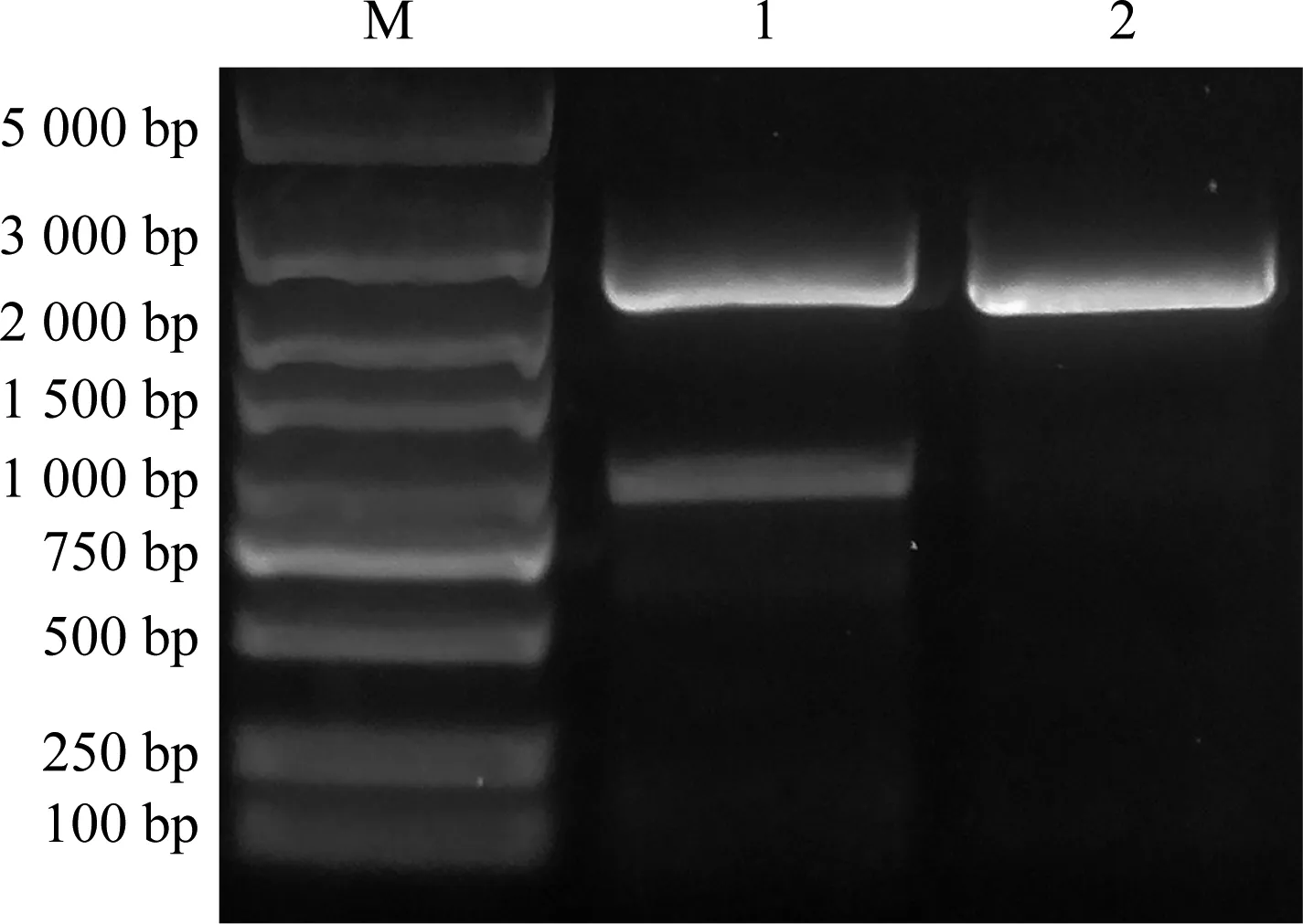
M: DL5000 DNA marker; 1: CsCRY1基因CsCRY1 gene; 2: CsCRY2基因CsCRY2 gene.
截取CCE结构域的氨基酸序列片段重新进行比对,发现CsCRY1和CsCRY2蛋白的氨基酸序列均含有保守的DAS(DQXVP-Acidic-SXAESSS)基序(图2-B)。
上述研究结果表明:茶树CsCRY1和CsCRY2蛋白可能具有与拟南芥中相似的蓝光信号调控机制。
2.2.2 系统进化分析 从NCBI数据库中选取了滇山茶(CamelliareticulataLindl.)、中华猕猴桃(ActinidiachinensisPlanch.)、苹果〔Malusdomestica(Suckow) Borkh.〕、毛果杨(PopulustrichocarpaTorr. et A. Gray ex Hook.)、拟南芥、可可(TheobromacacaoLinn.)、葡萄(VitisviniferaLinn.)、水稻、节节麦(AegilopstauschiiCoss.)和玉米(ZeamaysLinn.)10种植物以及石果衣真菌(Endocarponpusillum)的光裂解酶/隐花色素超级家族成员序列,构建系统进化树。结果(图3)显示:在光裂解酶/隐花色素超级家族中,茶树CsCRY1和CsCRY2蛋白与其他10种植物和石果衣真菌中的家族成员分为6个亚族,分别是Plant PHR2、 CRY-DASH、 (6-4)PHR、 Plant CRY、 CPD class Ⅰ PHR和CPD class Ⅱ PHR。CsCRY1和CsCRY2蛋白被分在了Plant CRY亚族中,说明茶树CsCRY1和CsCRY2蛋白属于Plant CRY类隐花色素。Plant CRY亚族包括Plant CRY1和Plant CRY2 2个分支,CsCRY1和CsCRY2蛋白分别分布于这2个分支。在进化树分支距离上,茶树CsCRY1和CsCRY2蛋白与滇山茶和中华猕猴桃较近,与单子叶植物较远。

色块颜色越深表示相似度越高The darker the color blocks, the higher the similarity.
2.2.3 二级和三级结构分析 利用SOPMA在线软件对茶树CsCRY1和CsCRY2蛋白氨基酸序列的二级结构进行预测,结果(图4)显示:CsCRY1蛋白中无规则卷曲(random coil)(43.13%)和α螺旋(α-helix)(41.96%)所占比例较高,β折叠(β-sheet)(9.21%)和β转角(β-turn)(5.70%)所占比例较低;CsCRY2蛋白中也是无规则卷曲(48.84%)和α螺旋(37.71%)所占比例较高,β折叠(8.96%)和β转角(4.48%)所占比例较低。
以拟南芥AtCRY1的PHR晶体结构1u3d.1.A为参照模型,利用SWISS-MODEL在线软件预测茶树CsCRY1和CsCRY2蛋白PHR结构域的三级结构,结果(图5)显示:茶树CsCRY1和CsCRY2蛋白的PHR结构域与参照模型相似,主要由α螺旋、无规则卷曲和β折叠组成,且在N端具有α螺旋和β折叠结构域,与二级结构预测结果相吻合。
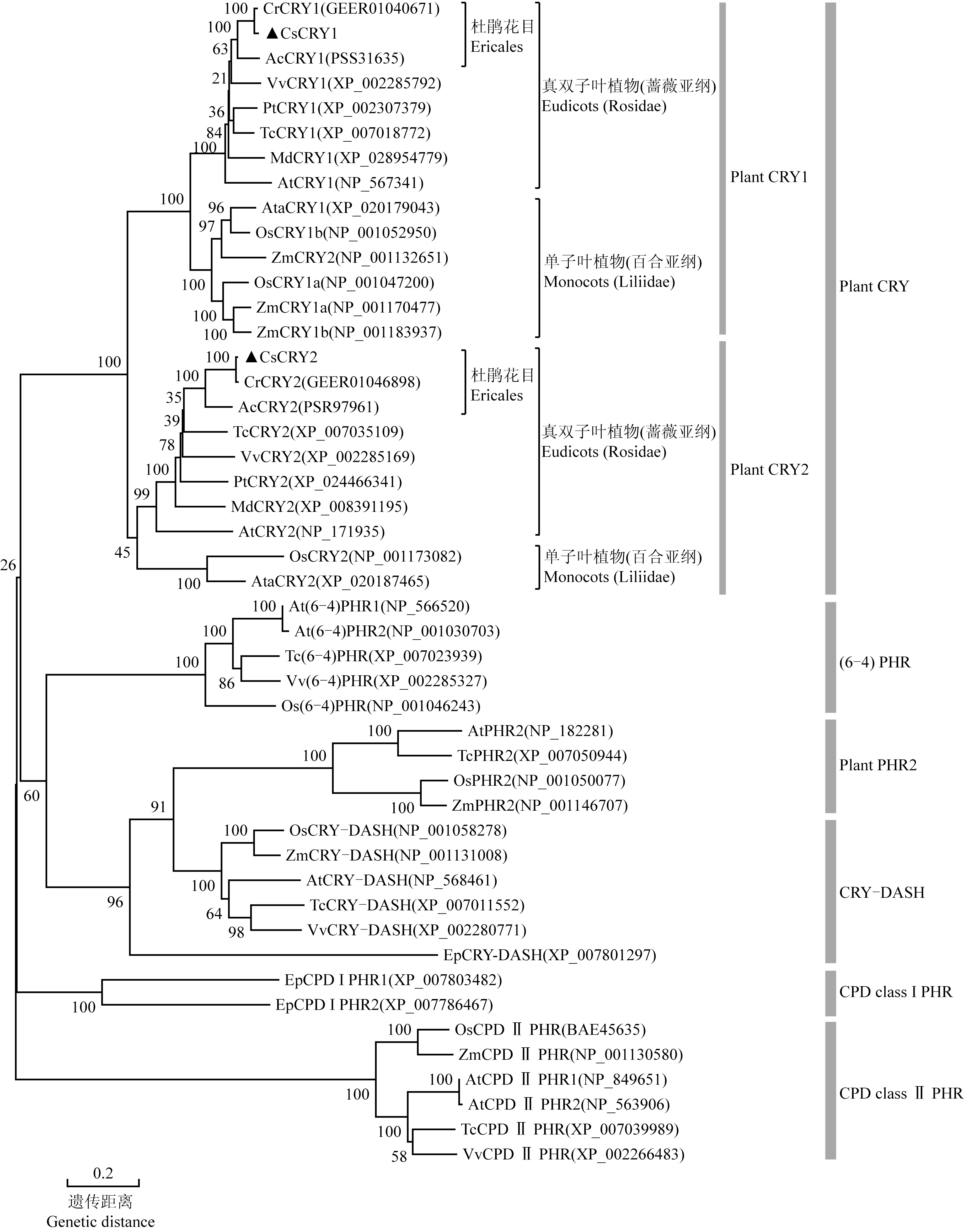
分支上数据代表自展值The datums on the branches represent the bootstrap values. Cr: 滇山茶Camellia reticulata Lindl.; Cs: 茶树Camellia sinensis (Linn.) Kuntze; Ac: 中华猕猴桃Actinidia chinensis Planch.; Vv: 葡萄Vitis vinifera Linn.; Pt: 毛果杨Populus trichocarpa Torr. et A. Gray ex Hook.; Tc: 可可Theobroma cacao Linn.; Md: 苹果Malus domestica (Suckow) Borkh.; At: 拟南芥Arabidopsis thaliana (Linn.) Heynh.; Ata: 节节麦Aegilops tauschii Coss.; Os: 水稻Oryza sativa Linn.; Zm: 玉米Zea mays Linn.; Ep: 石果衣真菌Endocarpon pusillum.
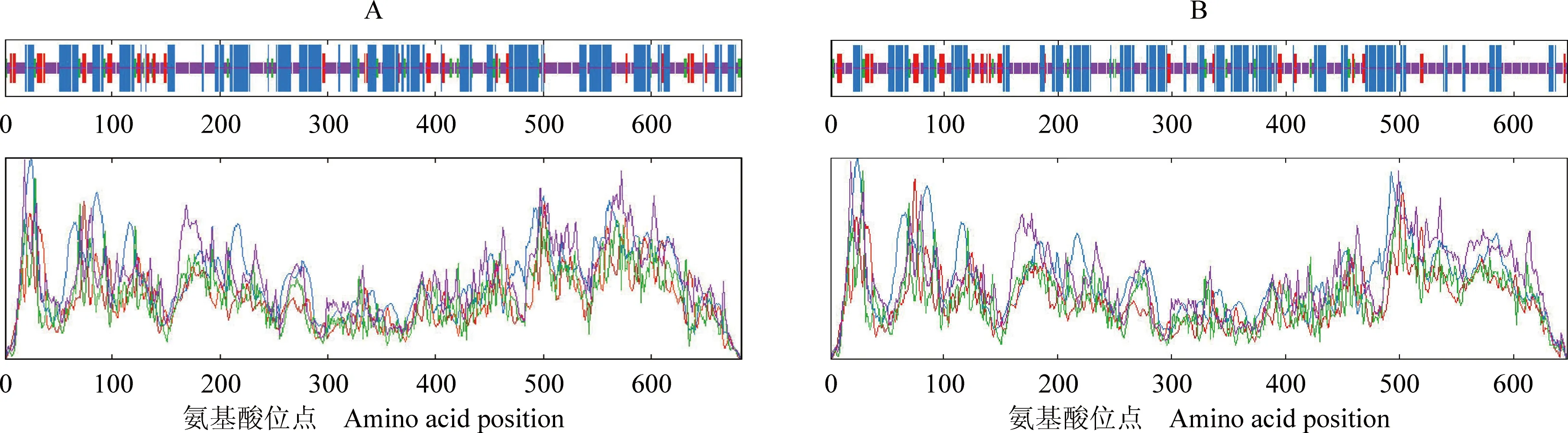
: α螺旋α-helix; : β折叠β-sheet; : β转角β-turn; : 不规则卷曲Random coil.
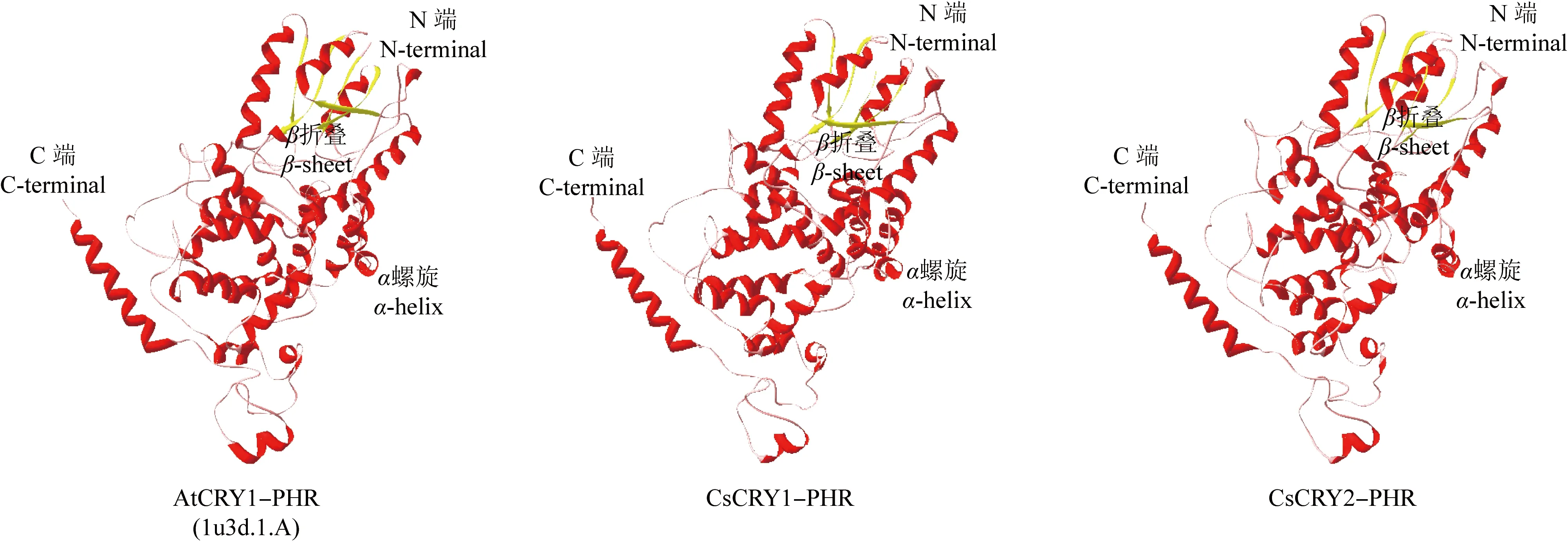
图5 茶树CsCRY1和CsCRY2蛋白PHR结构域的三级结构预测
2.2.4 启动子顺式作用元件预测分析 利用PlantCARE软件对茶树CsCRY1和CsCRY2基因上游1 500 bp内启动子顺式作用元件进行预测分析,结果分别见表1和表2。
由表1可见:茶树CsCRY1基因上游1 500 bp区域中主要含60个核心启动子元件(TATA-box)、28个启动子增强子区域元件(CAAT-box)以及多个参与光响应的调控元件(AT1-motif、G-box、chs-CMA1a、GATA-motif和Box 4)。此外,还包括赤霉素响应元件(P-box)、脱落酸响应元件(ABRE)、低温响应元件(LTR)和厌氧诱导必需顺式作用调控元件(ARE)等。
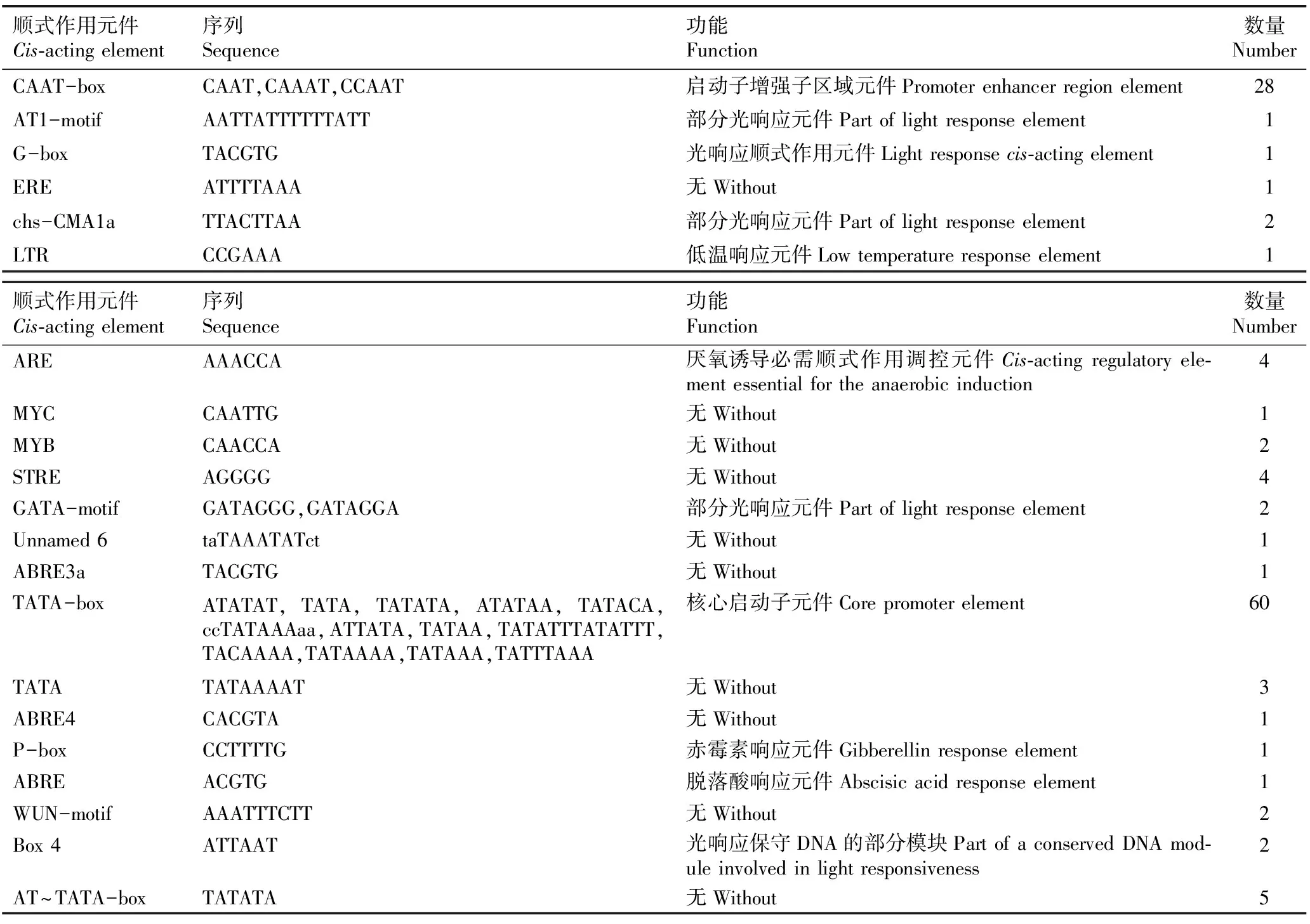
表1 茶树CsCRY1基因启动子的顺式作用元件及其功能预测
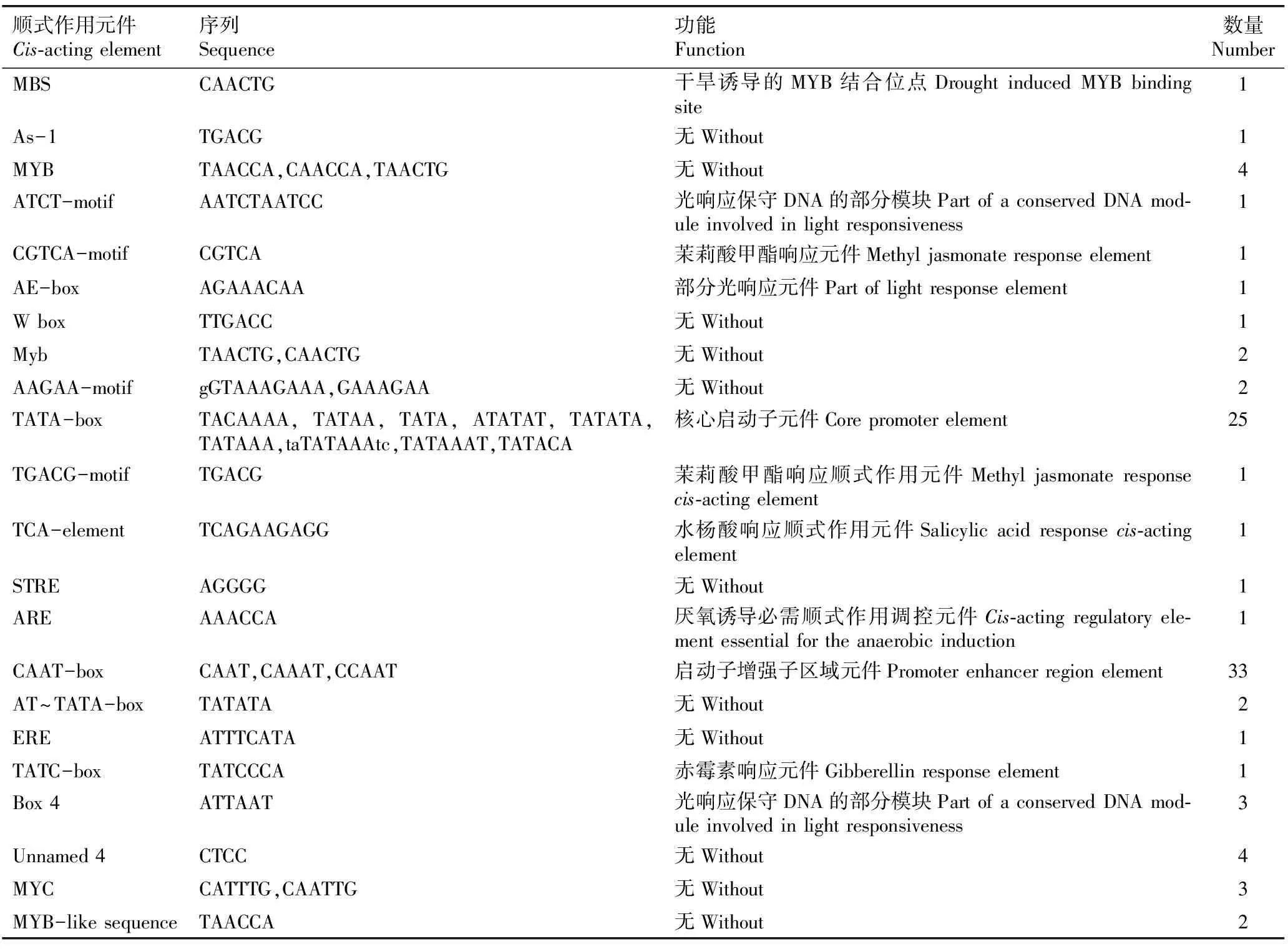
表2 茶树CsCRY2基因启动子的顺式作用元件及其功能预测
由表2可见:在茶树CsCRY2基因上游1 500 bp区域中主要含33个启动子增强子区域元件(CAAT-box)、25个核心启动子元件(TATA-box)以及多个参与光响应的调控元件(ATCT-motif、AE-box和Box 4)。此外,还包括参与茉莉酸甲酯响应的元件(CGTCA-motif和TGACG-motif)、水杨酸响应顺式作用调控元件(TCA-element)、赤霉素响应元件(TATC-box)、干旱诱导的MYB结合位点(MBS)和厌氧诱导必需顺式作用调控元件(ARE)等。
预测结果显示:CsCRY1和CsCRY2基因启动子均含有参与光响应、赤霉素响应和厌氧诱导的调控元件。CsCRY1基因启动子含有特有的参与脱落酸和低温响应元件,而CsCRY2基因启动子含有特有的参与茉莉酸甲酯和水杨酸响应元件以及干旱诱导元件。
2.3 茶树CsCRY1和CsCRY2基因的表达模式
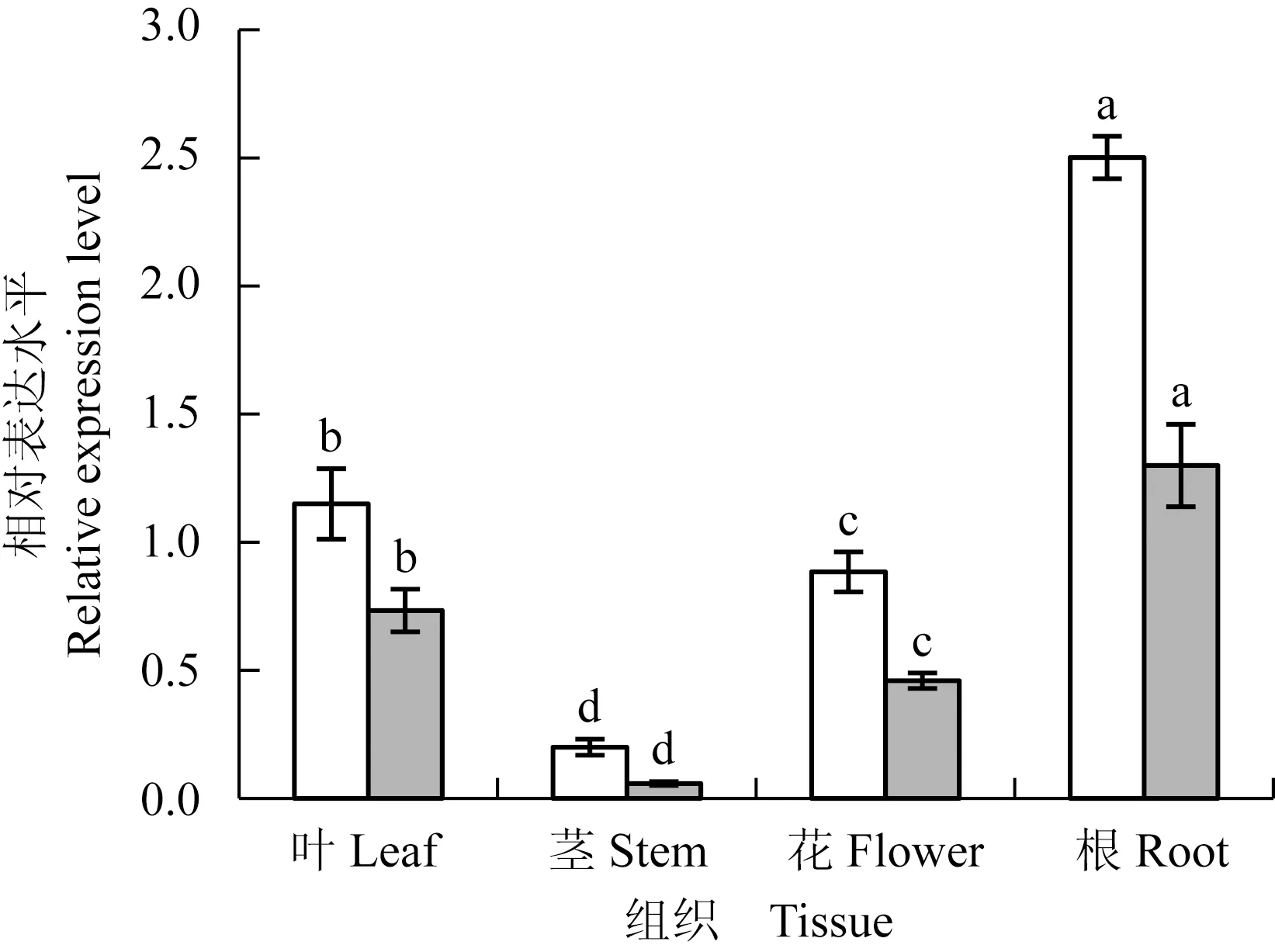
2.3.1 不同组织中的表达模式 结果(图6)显示:茶树根中CsCRY1和CsCRY2基因的相对表达水平均最高,叶中的相对表达水平次之,花中的相对表达水平较低,茎中的相对表达水平最低,且不同组织间的相对表达水平差异显著。
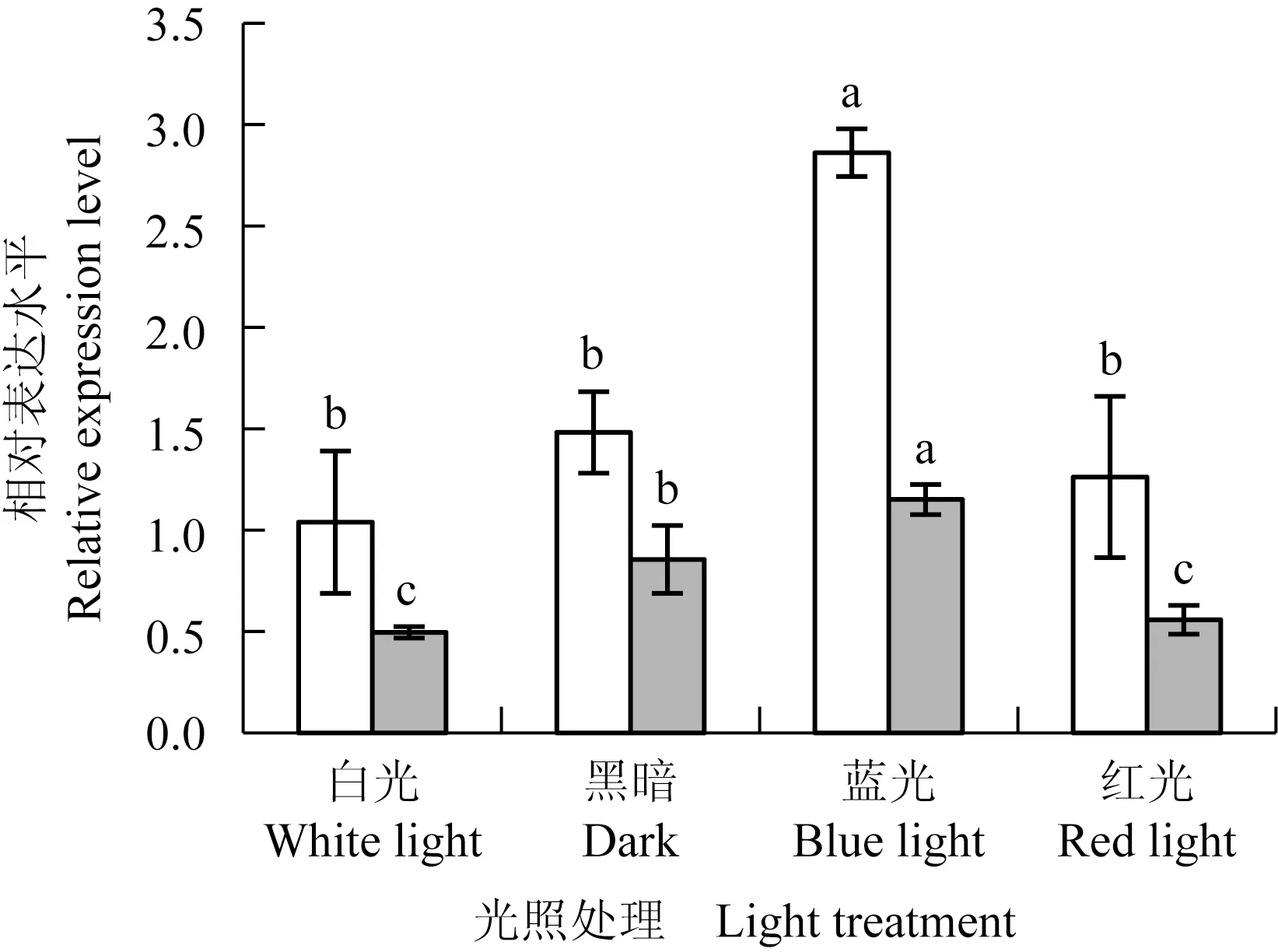
2.3.2 不同光照处理的表达模式 结果(图7)显示:处理4 h,蓝光处理下,茶树CsCRY1和CsCRY2基因的相对表达水平显著升高。白光、黑暗和红光处理下,CsCRY1基因的相对表达水平差异不大;白光和红光处理下,CsCRY2基因的相对表达水平无明显变化,但较黑暗处理有所降低。
2.3.3 不同激素处理的表达模式 结果(表3)显示:不同激素处理茶树CsCRY1和CsCRY2基因的表达模式基本一致。0.1 mmol·L-1ABA处理下,CsCRY1和CsCRY2基因的相对表达水平呈先升高后降低的变化趋势,分别于处理12和4 h达到最高;1.0 mmol·L-1GA3和1.0 mmol·L-1MeJA处理下,2个基因的相对表达水平呈先升高后降低的变化趋势,并于处理12 h达到最高;1.0 mmol·L-1IAA处理下,2个基因的相对表达水呈“升高—降低—升高”的变化趋势,于处理4 h达到最高。
: CsCRY1基因CsCRY1 gene; : CsCRY2基因CsCRY2 gene.
: CsCRY1基因CsCRY1 gene; : CsCRY2基因CsCRY2 gene.
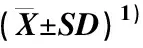
表3 不同激素处理茶树CsCRY1和CsCRY2基因的相对表达水平
3 讨 论
尽管植物缺少感光器官,但光受体的发现证明植物具有感知光信号和适应光环境的能力[30]。植物隐花色素基因最早在拟南芥的hy4突变体中分离获得,即AtCRY1基因[14]。随后从拟南芥中陆续获得AtCRY2和AtCRY3基因[31-32]。AtCRY1和AtCRY2蛋白属于Plant CRY类隐花色素,仅存在于植物中,而AtCRY3蛋白属于CRY-DASH类隐花色素,广泛分布于原核和真核生物中[13]。本研究以茶树品种‘福鼎大白茶’为材料,克隆获得2个隐花色素基因,分别命名为CsCRY1和CsCRY2。序列分析结果显示:茶树CsCRY1和CsCRY2蛋白与拟南芥AtCRY1和AtCRY2蛋白结构相似,其氨基酸序列均在N端有1个光裂解酶同源区域(PHR),在C端有1个隐花色素延伸域(CCE),属于Plant CRY类隐花色素典型结构特征[11,13,33],推测CsCRY1和CsCRY2基因为植物特有的保守基因,可能在响应光信号中发挥重要作用。茶树CsCRY1和CsCRY2蛋白的二级结构及其PHR结构域三级结构的预测结果同样证明其与拟南芥AtCRY1和AtCRY2蛋白相似。
在植物中,保守的低拷贝基因常用作构建物种系统发育分类的有效标记[34]。利用茶树与其他10种植物和真菌构建的光裂解酶/隐花色素超级家族成员构建系统进化树,显示亚族的分支区别明显,且Plant CRY类隐花色素的分支与APG Ⅳ系统中纲、目分类相互对应[35],表明隐花色素基因在植物中具有保守度较高且拷贝较低的特点,可用于开发植物系统发育分类标记。茶树CsCRY1和CsCRY2蛋白在系统进化树中与同目的滇山茶和中华猕猴桃处于同一小分支,这3种植物在植物学分类上同属于真双子叶植物中杜鹃花目(Ericales),其中,滇山茶与茶树最近,二者均隶属于山茶科,而中华猕猴桃隶属于猕猴桃科(Actinidiaceae),其植物学分类和基因组进化树距离与茶树较近[36],表明Plant CRY类隐花色素构建的系统进化树可用作植物属的分类标记。Plant CRY类隐花色素的生物学功能在不同植物中有所分化,是否与系统进化树分支距离有关仍有待考证。如大麦(HordeumvulgareLinn.)HvCRY1a和HvCRY1b基因通过介导表达脱落酸生物合成相关基因来诱导谷物休眠[37];番茄隐花色素介导了番茄红素在其果实中的积累[38];茶树隐花色素表达与光处理中多酚形成相关[4]。
隐花色素对于植物根的发育具有调控作用,如拟南芥AtCRY1基因通过参与生长素的调节,促进初生根的延长以及限制侧根的发育,但AtCRY2基因对根起到抑制作用[18,39]。组织表达结果显示:茶树根中CsCRY1和CsCRY2基因的相对表达水平最高,其后依次为叶、花、茎,推测2个基因可能在茶树根的发育中发挥调控作用。该结果与胡杨PeCRY1基因的组织表达情况相似,PeCRY1基因在根和叶中的表达量最高[25]。此外,有研究表明甘菊〔Chrysanthemumlavandulifolium(Fisch. ex Trautv.) Makino〕根中ClCRY1a/b基因的表达量最低[40],该结果与茶树中得到的结果相反。隐花色素基因的表达与光照条件有关,其在不同植物根中的表达高低不一,推测可能与激素调节或者取样部位有关[25,39]。
茶树CsCRY1和CsCRY2基因的启动子顺式作用元件预测分析显示:在上游1 500 bp区域序列中主要存在多种光响应和激素响应元件,如AT1-motif、Box 4、P-box和TATC-box等元件。蓝光条件下,茶树CsCRY1和CsCRY2基因的相对表达水平显著提高。拟南芥AtCRY1和AtCRY2基因的转录和表达不受光条件的调控,尽管其蛋白通过接受和传导蓝光信号调节光适应生理活动[41]。可见,与拟南芥不同,蓝光可能具有引起茶树CsCRY1和CsCRY2基因转录以及蛋白光信号传导的双重调控作用。外源激素ABA、GA3、IAA和MeJA均能引起CsCRY1和CsCRY2基因相对表达水平的上调。启动子顺式作用元件预测分析表明:ABA响应元件和MeJA响应元件分别为CsCRY1和CsCRY2基因启动子特有元件,然而ABA和MeJA均能诱导CsCRY1和CsCRY2基因的表达。已有研究结果表明:光信号和激素信号均处于植物信号调控网络中,二者具有协同作用[42]。其中,隐花色素在光信号传导中与多种激素共同调控下胚轴生长、根发育和避荫等生物学过程[18,43-44]。在茶树中,同样发现光信号与激素信号互相关联[4]。因此,外源激素可能直接或者间接调控茶树CsCRY1和CsCRY2基因的转录和表达。
综上所述,本研究克隆到茶树CsCRY1和CsCRY2基因,CsCRY1和CsCRY2蛋白具有典型的Plant CRY类隐花色素结构特征;可利用隐花色素高保守度、低拷贝的特点,开发用于构建物种系统发育的分类标记;蓝光介导了CsCRY1和CsCRY2基因的转录表达并可能在蛋白光信号传导上发挥作用;外源激素介导了CsCRY1和CsCRY2基因的转录,激素信号可能与光信号互相关联调节生物学过程。

