心房颤动患者射频导管消融术后体表心电图P 波的特征及临床意义
陈皓楠 陈太波 程康安 程中伟 高鹏 方全
心房颤动是临床上最常见的心律失常,全球发病率及患病率均不断升高,节律控制在心房颤动治疗中占有重要地位[1]。抗心律失常药物转复及维持窦性心律有效率低,存在致心律失常风险及众多非心脏相关不良反应。随着射频导管消融(下称消融)技术及器材的不断革新,治疗的有效性及安全性均不断提高,近年来在临床上广泛运用[1-2]。消融治疗在各类心房颤动患者中均有一定的复发率,准确预测消融结局对于手术适应证的判断、消融策略的制定、术后随访安排能起到重要作用[2]。多种心电分析方法(信号平均心电图、矢量心电图、频域分析等)及心电参数(P 波变异度、矢量振幅、心房晚电位等)被用来预测心房颤动患者消融术后的结局,但因方法复杂、可重复性不确切、预测效果不理想等原因,在临床实践中并未被广泛采用[3]。窦性心律P 波参数变化与心房重构相关,可以反映心房及肺静脉电活动的电生理特性[3]。本研究通过测量心房颤动患者消融术后P 波时间、振幅、矢量振幅,分析心房颤动患者术后P 波参数的分布特征,并探讨P 波参数与消融结局的关系,现报道如下。
1 对象和方法
1.1 对象 前瞻性纳入2018 年10 月至2019 年10月于北京协和医院心内科因心房颤动行消融治疗的患者125 例,其中男73 例,女52 例,年龄56~69岁,中位年龄 63 岁。排除标准:(1)年龄<18 岁;(2)消融前后心电图均为心房颤动心律;(3)超声心动图示左心房内径>60 mm;(4)心电图或临床资料缺失;(5)因各种原因无法完成知情同意者。所有患者均在术前签署知情同意书。
1.2 方法
1.2.1 心电信号获取 所有患者均由多导电生理仪(LEAD,四川锦江电子科技有限公司)记录消融术后体表12 导联心电图(采样率3 970~4 000Hz)。信号采集时经由硬件50 Hz 陷波及0.3~30 Hz 带通滤波。P 波参数通过多导电生理仪软件(四川锦江电子科技有限公司)测量(纸速100 mm/s,增益100 mm/mV)。研究者首先评估心电图采集质量,在无明显干扰及基线漂移的心电记录节段进行测量,研究者独立多次完成,每项参数至少测量3 次取平均值,如P 波起点或终点识别困难、多次测量结果差异较大,则由另一名电生理专科医师复核测量结果,如仍有疑问则双方共同商议后获得最终结果[4-5]。
1.2.2 P 波参数获取及定义 P 波起点与终点通过上一心搏T 波终止至下一心搏QRS 波群开始前的等电位线与心房电活动的交点(正向或负向偏移)确定。PWD:相应导联P 波起点至终点的时长;PWDmax:通过同步测量12 导联心电图中最早出现的P 波起点至最晚出现的P 波终点,获得的最大P 波时间;PWA:从基线至P 波正向切迹峰值或基线至负向切迹谷值的距离,双向P 波则记录正向及负向距离之和;矢量振幅:Ⅱ、V1、aVL 振幅的均方根[4-7]。
1.2.3 消融策略 消融术前所有抗心律失常药物(胺碘酮除外)需停用至少5 个半衰期。所有患者均于术前行经食管超声心动图或CT 左心房造影排除左心房血栓,全身麻醉或镇静后局部麻醉静脉穿刺,经股静脉置入可调弯冠状窦十极电极并行房间隔穿刺,穿刺成功后予肝素抗凝,目标活化凝血时间>300 s。手术在Carto 三维标测系统(V3.2 版本,美国强生公司)指导下进行,采用冷盐水灌注压力消融导管(Thermo Cool,美国强生公司)功率模式消融,消融最高温度为45 ℃,功率30~40 W,冷盐水灌注非消融时流速为2 mL/min,消融时流速为17 mL/min。消融策略为行环左、右肺静脉隔离(pulmonary vein isolation,PVI),如 PVI 后心房颤动未终止,予伊布利特静脉注射(1 mg/10 mL,10 min 注入),仍未终止者行电转复。术者根据术中具体情况决定转复前是否行线性消融[2]。
1.2.4 随访 术后1 年内至少每3 个月随访1 次,具体随访间隔可根据病情由术者调整[2]。通过门诊或电话询问患者症状、合并症及并发症、用药情况。建议所有患者在随访期间或任意时间症状发作时行心电图或24 h 动态心电图评估有无心律失常事件复发。复发定义为自术后3 个月(空白期)出现持续时间>30 s 的房性心动过速、心房扑动或心房颤动[2]。
1.3 统计学处理 采用SPSS25.0 统计软件,符合正态分布的计量资料以表示,组间比较采用t 检验,非正态分布的计量资料以中位数(四分位数间距)表示,组间比较采用Mann-Whitney 检验;计数资料以百分率表示,组间比较采用χ2检验。与复发相关的危险因素分析采用logistic 回归及Cox 回归;有统计学意义的心电参数通过受试者工作特征(receiver operating characteristic,ROC)曲线明确最佳界值及预测能力。采用相关系数评价测量结果的可重复性(r>0.80 提示可重复性良好)。P<0.05 为差异有统计学意义。
2 结果
2.1 患者临床基线资料比较 阵发性房颤患者(阵发性房颤组)75 例,持续性房颤患者(持续性房颤组)50 例,经过 8.5(6.03~11.70)个月随访,心律失常复发27 例(21.6%),其中持续性房颤组 13 例(26.0%),阵发性房颤组14例(18.7%),中位复发时间3(3~6)个月,无失访病例。两组患者临床基线资料比较见表1。
由表1 可见,与阵发性房颤组相比,持续性房颤组氨基末端脑钠肽前体(N terminal pro B type natriuretic peptide,NT-proBNP)水平升高,左心室射血分数下降,左心房前后径增大,左心房慢血流、需要采用电复律及药物复律的比例增多,差异均有统计学意义(均P<0.01)。此外持续性房颤组术后服用胺碘酮维持窦性心律的比例增多(P<0.05)。
2.2 两组患者术后心电参数比较 见表2。
由表2 可见,与阵发性房颤组相比,持续性房颤组术后 PWD-Ⅱ、PWD-V1增宽,PWDmax延长,PWA-V1及矢量振幅增高,差异均有统计学意义(均 P<0.05)。
2.3 复发与非复发患者术后心电参数比较 见表3。
由表3 可见,与非复发者相比,复发者PWD-Ⅱ、PWDmax延长,差异均有统计学意义(均P<0.05),但两者 PWD-Ⅱ、PWD-V1、PWA-V1及矢量振幅比较差异均无统计学意义(均P >0.05)。
2.4 心电参数与预后的关系 单因素logistic 回归分析及Cox 回归分析均表明术后PWD-Ⅱ增宽是术后复发的独立危险因素(均P<0.05)。ROC 曲线分析表明,以PWD-Ⅱ 148 ms 为参考值,PWD>148 ms 判断心房颤动复发的ROC 曲线下面积为0.624(95%CI:0.506~0.742,P<0.05),灵敏度66.7%,特异度58.2%。以PWD-Ⅱ148 ms 为界值建立无心律失常事件生存Kaplan-Meier 曲线,两组间复发率差异有统计学意义(13.6%比30.5%,P<0.05)。见图1、2。
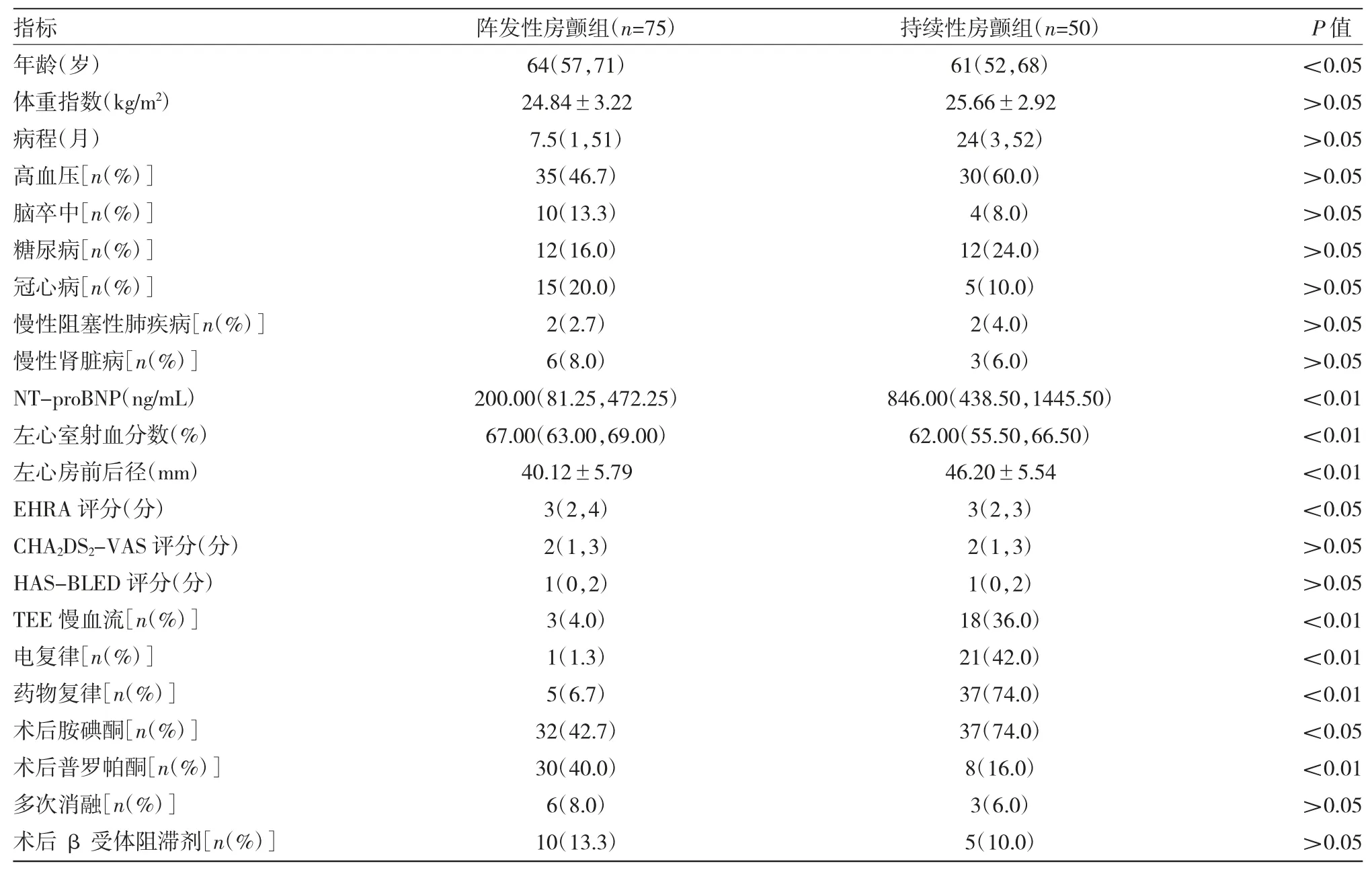
表1 两组患者临床基线资料比较
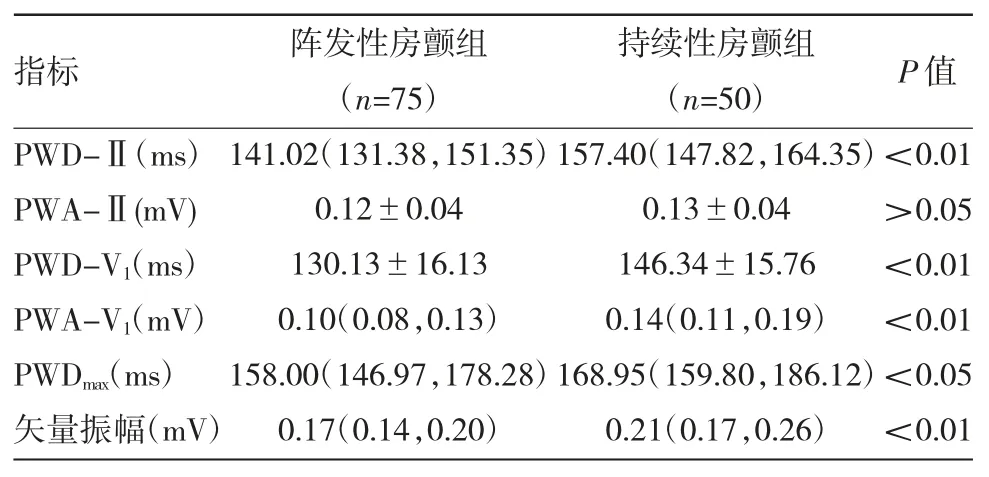
表2 两组患者术后心电参数比较

表3 复发与非复发患者术后心电参数比较

图1 PWD-Ⅱ判断心房颤动复发的ROC 曲线(AUC 为曲线下面积)
3 讨论
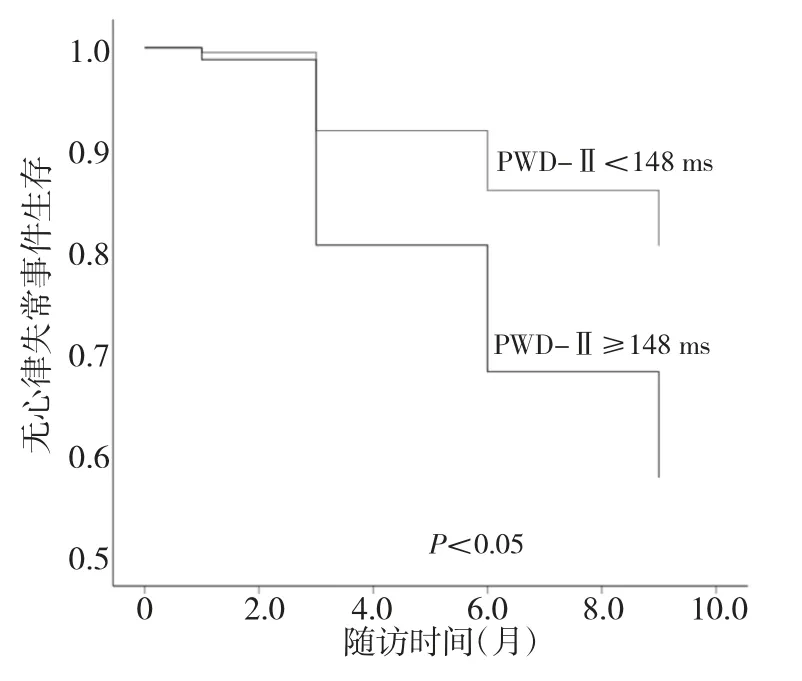
图2 以PWD-Ⅱ 148 ms 为界值绘制的Kaplan-Meier 曲线
多种临床及心电参数被证实可以用来评估心房颤动患者的消融结局[3,8]。体表心电参数为无创指标,在临床实践中容易获取,作为定量指标能够相对精确地指导预后[3]。本项研究通过测量不同类型心房颤动患者消融术后体表心电图P 波时间、振幅及矢量振幅,明确了不同类型及不同预后心房颤动患者体表心电参数的分布特点,预后相关性评价进一步证实PWD-Ⅱ、V1延长可能预示消融失败,并通过ROC 曲线分析确定最佳界值,具有较好的可靠性及实用性。既往研究表明,体表心电图P 波与心房颤动发生机制及严重程度相关,P 波宽度反映电活动在心房内的传导时间,肺静脉肌袖的电活动可能参与组成P 波的终末部分,表现为P 波时间增宽和切迹[3,9]。成功的PVI 阻断左心房与肺静脉之间的电传导,可使P 波时间缩短和切迹消失[9]。PVI 基础上联合线性消融或外科消融可能使P 波宽度进一步缩短[10]。Date 等[9]通过对阵发性房颤患者P 波形态及向量环的分析表明,消融后P 波向量环左向及前向最大振幅明显增加,P 向量环中部向左前偏移,且上述改变的逆转与肺静脉电活动恢复相关。Okumura等[11]对51 例心房颤动患者消融前后P 波信号平均心电图进行分析,结果表明复发者P 波时间显著延长,与心内测量双房传导时间密切相关,术前P 波时间>150 ms 是术后复发的独立预测因子。Fujimoto 等[12]探讨了心房颤动消融术后P 波离散度(定义为12 导联心电图所记录最长P 波时间与最短P波时间的差值)与心房重构的关系,126 例阵发性房颤患者行PVI 及线性消融,结果提示未复发组术后P 波离散度及脑钠肽水平均较术前显著下降,可能提示消融后重构部分可逆。Ogawa 等[13]对27 例阵发性房颤患者行PVI,结果提示无复发者术前基线P波时间短于复发患者,术后P 波时间显著缩短,无复发者P 波离散度显著减小,且P 波缩短程度显著大于复发者。由于单导联P 波振幅可能受不同心房传导方向的影响,因而无法精确反映心房整体电活动的幅度,Nakatani 等[14]将P波矢量振幅定义为Ⅱ、V6、V2的均方根,并证实P 波矢量振幅对持续性房颤患者的消融结局具有预测作用,为术后复发的独立预测因子,且与左心房内径呈负相关。P 波宽度的变异系数(定义为12 导联PWD 标准差与PWD 平均值的商)可反映心房传导的异质性,Nakatani 等[15]研究表明,心房颤动术后复发患者术前、术后P 波宽度变异系数均更高,且P 波宽度变异系数与左心房大小呈正相关,与左心耳血流速度呈负相关。Jadidi 等[4]通过高密度标测确定心房低电压区,结果提示P 波时间>150 ms 对预测是否存在低电压区的灵敏度和特异度可达94.3%和91.7%,P 波时间与左心房低电压区面积大小呈正相关,与术后复发显著相关。纳入8 项研究、1 010 例患者的荟萃分析结果提示术前基线P 波时间超过149.5 ms 对术后复发有较好的预测能力(AUC=0.66;95%CI:0.62~0.70)[16]。本研究结果进一步证实,心房颤动患者消融术后窦性心律的P 波宽度与患者远期是否复发相关,术后PWD 增宽可能提示心房电活动紊乱程度、心房内传导延迟程度以及心房纤维化更重,与心房颤动电重构及结构重构密切相关,术后PWD≥148 ms 可能预示消融失败。
本研究通过心内科心房颤动门诊以及电话的形式完成随访,平均随访时间与既往研究相比较短,少数患者虽有症状反复,但未监测症状发作时的心电图,因此严格按照复发定义的总体复发事件较少,可能无法准确评估患者术后心律失常负荷。此外,本研究总体复发事件较少,且心电参数间、心电参数与超声参数存在共线性,多因素回归分析可靠性有限,这可能会影响多参数联合对复发预测价值的评价。
