基于iTRAQ标记联合IPA生物信息分析探究大黄素镇痛作用的机制
陈 鹏,王 琛,张 杰,吴智兵,吴远华
(1.贵州中医药大学基础医学院,贵州 贵阳 550025;2.广州中医药大学第一临床医学院,广东 广州 510405;3.贵州中医药大学第一附属医院,贵州 贵阳 550001)
神经病理性疼痛是指躯体感觉系统损伤或疾病所引发的疼痛[1]。最新全球范围内流行病学调查研究显示,神经病理性疼痛在普通人群中的患病率高达10%,其可出现在不同性质的临床疾病中,包括糖尿病、脑卒中、带状疱疹、多发性硬化、感染、癌症、腰或颈神经根型神经病变、手术及创伤等[2,3]。神经病理性疼痛的临床表现主要包括自发性疼痛、痛觉过敏及异常性疼痛,且常伴有较为显著的睡眠障碍、抑郁和焦虑等心理障碍,严重影响着患者的日常生活及行为功能,也给社会造成巨大的经济和医疗负担[4]。目前,神经病理性疼痛的治疗主要以抗癫痫、抗焦虑及阿片类药物为主,但药效有限,副作用明显。因此,深入探讨疼痛的发病机制,寻找并开发新的镇痛药物已成为慢性疼痛研究的重要课题。
大黄素(1,3,8-三羟基-6-甲基蒽醌)是天然蒽醌类衍生物,分子式C15H10O5,为中药大黄的主要活性成分。前期本课题组研究发现大黄素能够显著改善慢性压迫性损伤(chronic constriction injury,CCI)模型实验大鼠自发性疼痛,提高痛觉阈值,缓解痛觉过敏,以50 mg·kg-1效果最佳。然而,关于大黄素具体镇痛机制和作用靶点尚不清楚,有待于进一步深入研究。
本研究采用蛋白质组学同位素相对和绝对定量标记技术(isobaric tags for relative and absolute quantitation, iTRAQ)对大黄素干预下不同处理组实验大鼠脊髓组织差异表达蛋白进行鉴定和筛选,并结合创新途径分析(ingenuity pathway analyses,IPA)对筛选差异表达蛋白进行经典通路分析、转录调控分析、疾病与功能分析及相互作用网络分析等,从而明确大黄素镇痛作用的机制。
1 材料与方法
1.1 动物30只SD大鼠,♂,7周龄,体质量(200±20)g,购于广州中医药大学实验动物中心[许可证编号:SCXK(粤)2013-0034],饲养于SPF级动物实验室。本实验所有操作程序符合广州中医药大学附属医院动物使用与伦理委员会审查。
1.2 药物大黄素:购于成都曼思特生物科技有限公司,纯度99.48%,规格1 g/瓶,批号MUST-16110712。
1.3 主要仪器Strata X C18脱盐柱(美国Phenomenex公司);E2695/2998高效液相色谱及XBridge Peptide BEH C18色谱柱(美国Waters公司);Acclaim PepMap®100 C18上样柱,Acclaim PepMap®RSLC C18分析柱,NanoLC 1 000 纳升级高效液相及LTQ Orbitrap Elite 组合式质谱仪(美国Thermo Fisher Scientific公司)。
2 方法
2.1 动物分组与给药将30只大鼠按照随机数字表分为假手术组(Sham, S)、模型组(Model, M)及大黄素组(Emodin, E)。术后1 d开始大黄素组给予大黄素混悬液,每日一次,连续15 d。
2.2 CCI模型制备麻醉,俯卧位固定,暴露坐骨神经,4-0丝线做4道结扎,间隔1~2 mm,压迫程度以神经微塌陷为宜。假手术组仅暴露神经但不结扎。
2.3 药物制备大黄素溶液制备:将0.312 5 g大黄素溶解于50 mL 0.05% CMC-Na中制备成浓度为6.25 g·L-1大黄素混悬液。
2.4 样品制备给药后15 d,将大鼠深度麻醉,取术侧脊髓组织,置于-80 ℃超低温冰箱内备用。
2.5 蛋白提取及浓度测定取脊髓组织样品,加入适量细胞裂解液(8 mol·L-1尿素、2 mmol·L-1EDTA、10 mmol·L-1DTT、1%蛋白酶抑制剂混合液),冰浴超声破胞3次;4 ℃离心10 min后取上清液,加入预冷的TCA,-20 ℃沉淀2 h,4 ℃离心5 min,弃上清后,沉淀加入-20 ℃预冷的丙酮,洗涤3次去TCA,4 ℃离心5 min弃丙酮;加入复溶缓冲液(8 mol·L-1尿素、100 mmol·L-1,pH 8.0)。参照试剂盒采用Bradford 法进行蛋白浓度测定。
2.6 iTRAQ标记分别取50 μg样品调整等体积,加入10 mmol·L-1DTT 37 ℃孵育60 min,再加入55 mmol·L-1IAM室温孵育60 min;稀释后按质量比1 ∶50加入胰蛋白酶,37 ℃孵育过夜,再按质量比1 ∶100加入胰蛋白酶37 ℃孵育4 h。Strata XC18脱盐柱除盐。运用iTRAQ标记试剂盒对各组样品进行标记,标记信息为:假手术组-116、模型组-117及大黄素组-118。
2.7 肽段组分分离采用高pH C18色谱柱经HPLC色谱仪分离样品,流动相A液为2%乙腈(pH 10),流动相B液为98%乙腈(pH 10)。88 min线性梯度洗脱样品,液相流速为0.7 mL·min-1,洗脱期间检测波长214 nm。共收集出的肽段流出组分,真空抽干后合并成12组分进行质谱鉴定。
2.8 肽段质谱鉴定将12个组分溶于20 μL NanoLC A液,进样2 mL,经Acclaim PepMap®100 C18上样注后使用Acclaim PepMap®RSLC C18分析注梯度洗脱,流动相A液为2%乙腈和0.1%甲酸,流动相B液为98%乙腈和0.1%甲酸,液相流速为300 nL·min-1,时间为90 min。洗脱液进入Orbitrap Elite质谱仪进行鉴定。质谱参数具体设置为:一级质谱分辨率为70 000,扫描范围为350~1 500 m/z;二级质谱分辨率为17 500,碰撞归一化能量为30,采集标准为20个峰强度最高。
2.9 IPA分析使用Proteome Discoverer 1.3软件将肽段鉴定的原始图谱文件转换为.mgf文件,通过MASCOT 2.3.0服务器进行数据检索,以FDR<0.01标准,组间差异倍数≥±1.2且P<0.05的蛋白筛选为差异表达蛋白。将筛选的差异表达蛋白上传至IPA生物信息分析平台,进行经典通路分析、转录调控分析、疾病与功能分析及相互作用网络分析。
3 结果
3.1 大黄素对CCI大鼠脊髓组织蛋白表达的影响运用蛋白质组学技术共鉴定出不同处理组脊髓中差异表达蛋白177个,其中MvsS 筛选出表达蛋白102个,上调52个,下调50个;EvsM 筛选出差异表达蛋白109个,上调66个,下调43个,结果见Fig 1。
3.2 差异表达蛋白经典通路分析Fig 2为假手术组、模型组及大黄素组脊髓组织差异表达蛋白在不同经典通路中表达趋势热图,结果显示 EvsM 与 SvsM鉴定出的差异蛋白在不同经典通路中趋势基本一致,说明大黄素能够反向调节CCI模型中异常激活或抑制的通路。为进一步研究大黄素镇痛作用所涉及的信号通路,我们对筛选的差异表达蛋白进行经典通路分析。Fig 3显示了 EvsM 差异表达蛋白所涉及的Top20经典通路,其中预测激活的通路包括肝X受体/维甲酸X受体(liver X receptor/ retinoid X receptor,LXR/RXR)激活及巨噬细胞中一氧化氮和活性氧产生;预测显著抑制的通路包括脊髓背角神经元神经病理性疼痛信号通路、促性腺激素释放激素(gonadotropin releasing hormone,GNRH)信号、突触长时程增强、神经元环腺苷酸反应元件结合蛋白(cAMP response element binding protein, CREB)、突触发生信号通路、阿片信号通路及钙离子信号(z-score>2)。
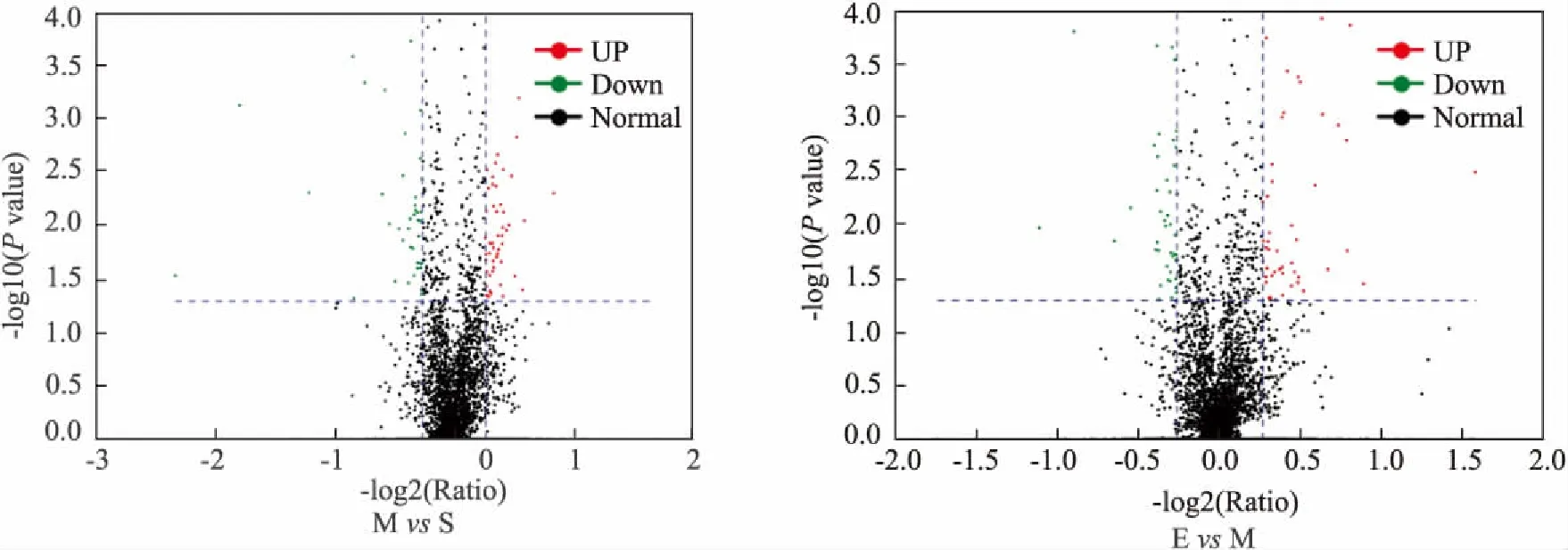
Fig 1 Volcano plot of differently-expressed proteins in spinal cord
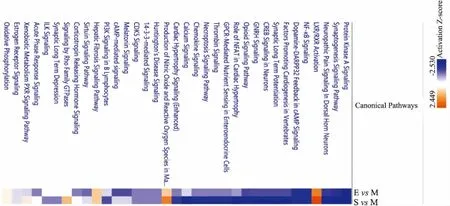
Fig 2 Heat map of classical pathways mediated by differently-expressed proteins
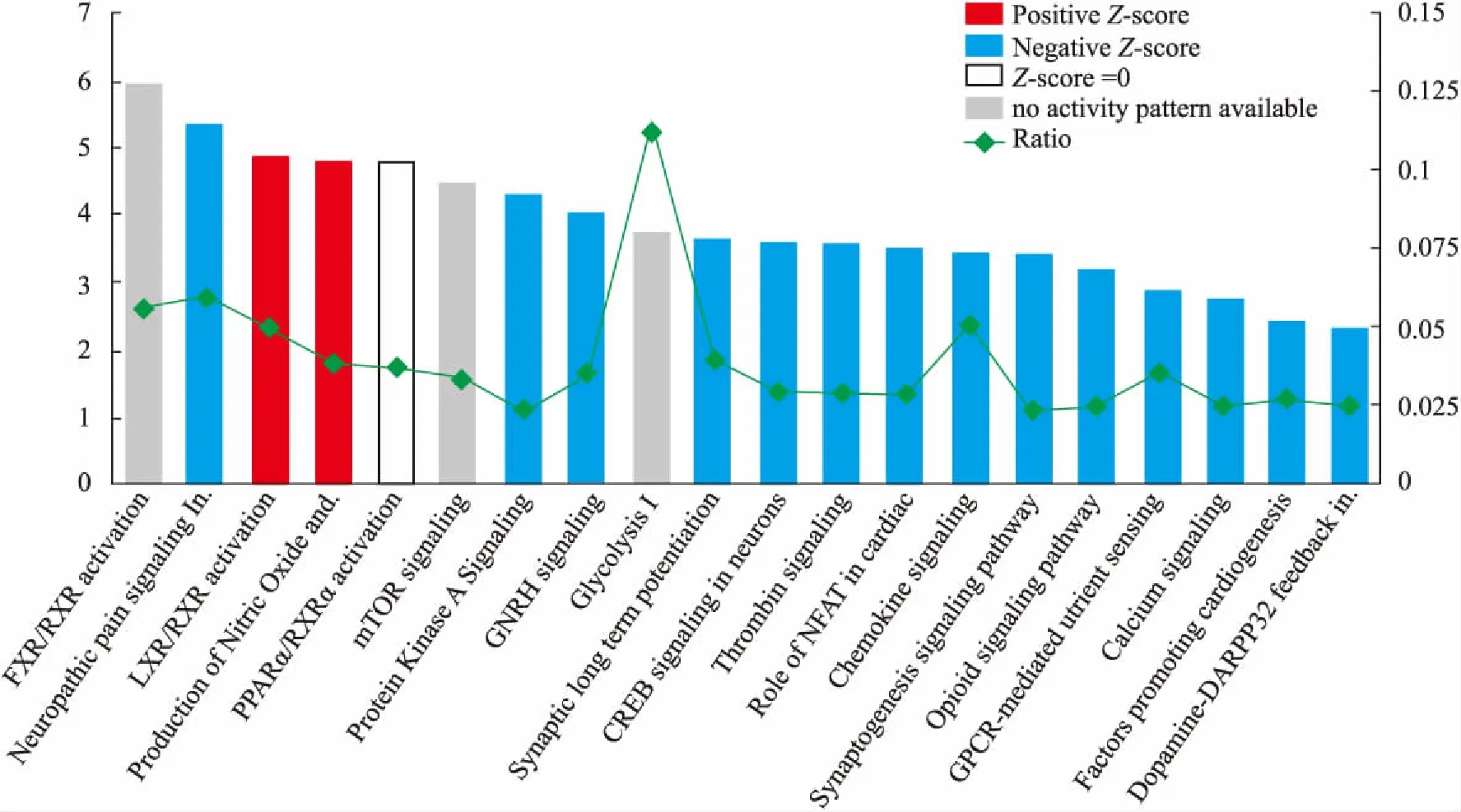
Fig 3 Top20 classical pathways mediated by differently-expressed proteins
Fig 4为详细信号调控通路图,进一步深入分析各经典通路上差异蛋白的表达趋势及分子功能。其中以脊髓背角神经元神经病理性疼痛信号为例,与模型组相比,大黄素组实验大鼠脊髓组织中原肌球蛋白相关激酶B(tropomyosin-related kinase B,TrkB)、磷脂酶C(phospholipase C,PLC)、蛋白激酶C(protein kinase C,PKC)、钙调蛋白激酶Ⅱ(Ca/calmodulin-dependent protein kinases,CaMKⅡ)及蛋白激酶A(protein kinase A,PKA)表达均下调,主要介导突触后膜N-甲基-D天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)及α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid receptor,AMPAR)等相关受体磷酸化及细胞核内CREB信号通路激活。
3.3 差异表达蛋白上游调控因子上游调控因子分析主要预测差异表达蛋白的上游调控因子。如Tab 1所示,经分析共预测出8个上游调控因子,包括TCF7L2、MLXIPL、APP、IFNG、TWIST1、Esrra、RICTOR及HMGA1。如Fig 5所示,上游调控因子与目标分子间存在四种作用关系,分别为一致激活、一致抑制、结果与下游分子状态不一致及无预测效果。例如,APP被预测为强烈激活,该基因存在C3、ALB、SUCLG、S100B、RPS6及GFAP在内的6个一致激活的基因。RICTOR被预测为强烈抑制,该基因抑制导致下游基因PRKCB被抑制。
3.4 差异表达蛋白相互作用网络根据不同疾病与功能,进一步深入分析 EvsM 差异表达蛋白间相互作用关系,并构建IPA蛋白互作网络。如Tab 2所示,将Score >20分评定为可信,共构建出5个确信度较高的蛋白互作网络,分别是心血管疾病、代谢性疾病、机体损伤和异常,癌症、细胞死亡和存活、RNA损伤和修复,细胞间信号与相互作用、药物代谢、神经系统发育和功能,细胞发育、细胞功能和维持、细胞生长和分化,碳水化合物代谢、细胞损伤、小分子生物化学。其中与神经病理性疼痛最为密切相关的是细胞间信号与相互作用、药物代谢、神经系统发育和功能。如Fig 6所示,该网路中包含6个上调蛋白,14个下调蛋白,这些蛋白共同参与了Akt、CREB及Actin等相关分子调节,其中CaMKⅡ、PKA及PP2A等蛋白与其他蛋白联系最为密切。
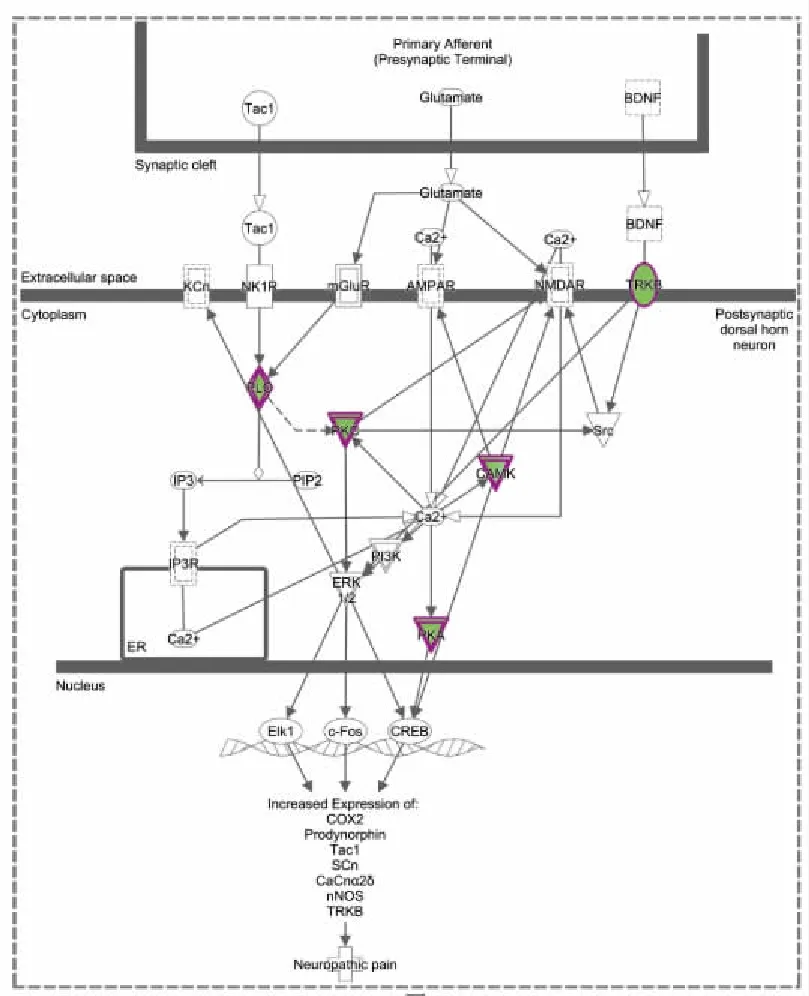
Fig 4 Neuropathic pain signaling in dorsal horn neurons
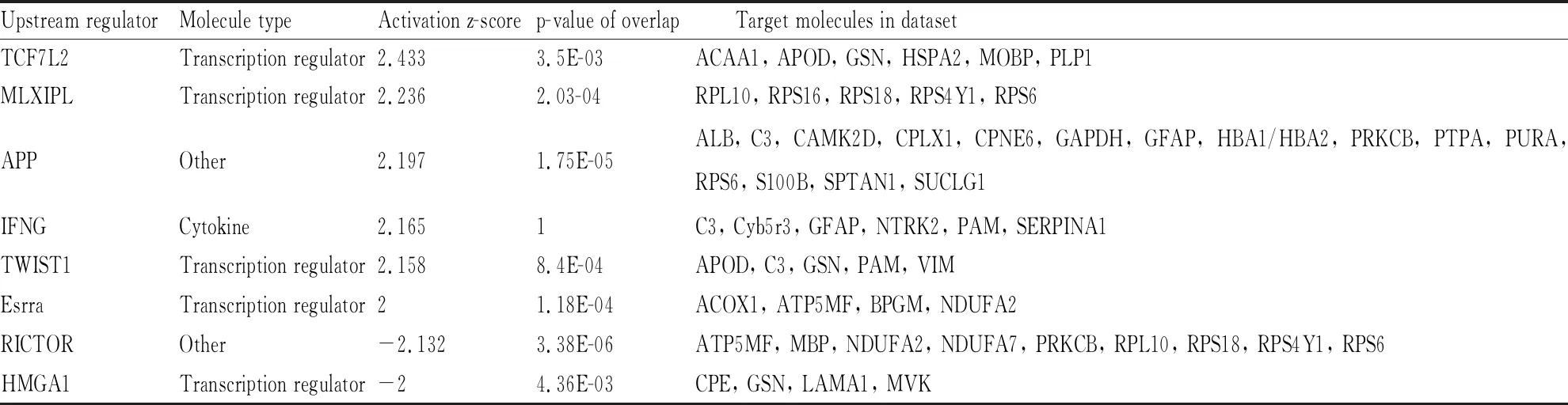
Tab 1 Upstream regulators of differently-expressed proteins in E vs M

Tab 2 Protein interaction network of differently-expressed proteins
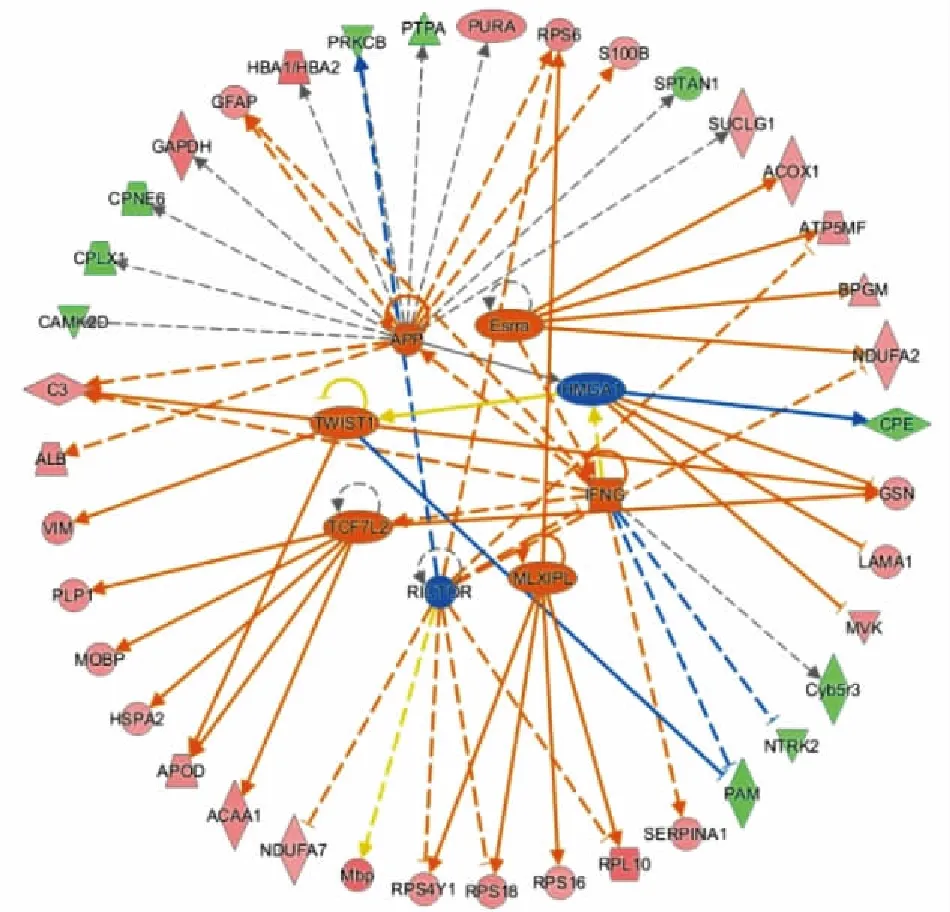
Fig 5 Figure of upstream regulators
4 讨论
神经病理性疼痛发病机制较为复杂,仍缺乏统一认识及广泛有效的临床药物。中医学认为,“不通则痛”是疼痛的主要发病机制,而气滞血瘀是关键致病因素,行气活血、以通治痛是急慢性疼痛治疗的重要原则。大黄味苦,气香而性凉,能入血分,破一切血瘀,具有活血化瘀的功效;同时可推陈致新,通畅气机而安和五脏。故历代医家以大黄为主要药物创立“升降散”、“大黄牡丹汤”、“下瘀汤”及“大黄附子汤”等名方,临床上用于治疗多种类型的急慢性疼痛。大黄素是中药大黄的主要活性成分之一,本课题前期研究发现大黄素在神经病理性疼痛CCI动物模型中具有显著的镇痛作用。脊髓背角是疼痛信息处理和传递的初级整合中枢,脊髓中枢敏化在神经病理性疼痛发病过程中发挥关键作用。因此本研究旨在运用蛋白质组学技术筛选出不同处理组差异表达蛋白并结合IPA生物通路分析,揭示大黄素镇痛作用的脊髓机制。
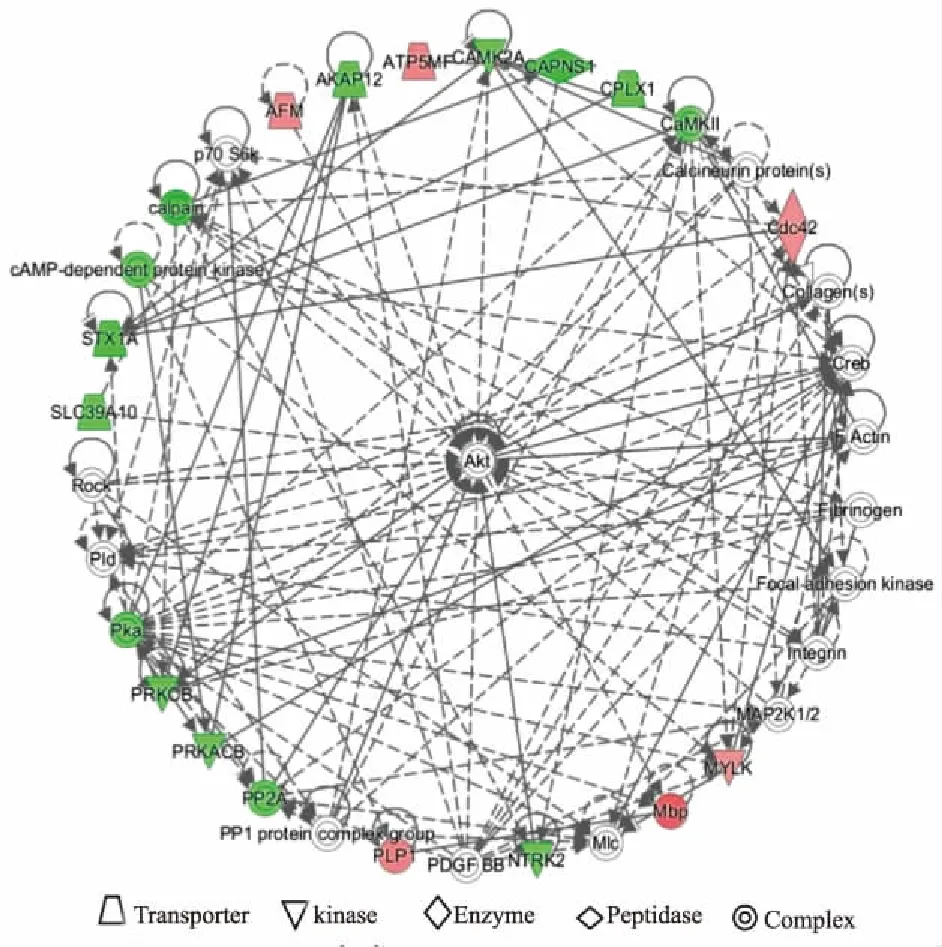
Fig 6 Protein interaction network of differently-expressed proteins
经IPA经典通路分析,大黄素可显著抑制脊髓背角神经元神经病理性疼痛信号通路、PKA信号通路、突触长时程增强通路、神经元CREB信号通路及钙离子信号通路等,从而抑制脊髓中枢敏化及突触异常传递,缓解神经病理性疼痛。进一步深入分析各经典通路上差异蛋白的表达趋势及分子功能,我们推测大黄素可下调PKC、CaMKⅡ及PKA等相关蛋白激酶表达,影响NMDA受体、AMPA受体及CREB核转录因子磷酸化,降低兴奋性突触后电流,抑制疼痛相关基因的表达,进而发挥镇痛作用。此外,经IPA分析发现,大黄素亦可介导LXR/RXR通路激活,抑制核因子-κB(nuclear factor-kappa B,NF-κB)信号通路,从而降低IL-1β等在内的炎症介质表达水平,发挥抗神经病理性疼痛作用[5-7]。
随后,本研究进一步运用IPA上游转录调控分析预测大黄素干预下脊髓组织中差异表达蛋白上游调控因子,其中与大黄素镇痛作用相关的潜在因子主要为TCF7L2及APP。TCF7L2又称为T细胞转录因子4(T cell factor 4,TCF4),是T细胞因子/淋巴细胞增强子结合因子(T cell factor/lymphocyte enhancer factor,TCF/LEF)家族成员,在Wnt信号通路中发挥关键作用[8]。最新研究表明,TCF7L2通过Wnt/β-catenin信号调控少突胶质细胞分化、成熟,促进髓鞘形成和再生[9-11]。本研究亦发现大黄素组脊髓组织中髓鞘碱性蛋白、髓鞘蛋白脂质蛋白及髓鞘相关少突胶质细胞碱性蛋白等髓鞘相关蛋白表达升高。淀粉样前体蛋白(amyloid precursor protein,APP)是神经系统广泛分布的Ⅰ型跨膜蛋白,其由分泌酶剪切后产生的代谢产物可溶性淀粉样前体蛋白α(soluble APP alpha,sAPPα)能够抑制神经元兴奋性,改善突触传递,发挥神经保护作用[12]。研究表明,APP及其代谢产物能够抑制实验小鼠痛觉过敏和炎症性疼痛[13]。
最后,我们进一步分析了EvsM 差异表达蛋白间相互作用关系,并构建了IPA蛋白互作网路,其中与大黄素镇痛作用最为相关的是细胞间信号与相互作用、药物代谢、神经系统发育和功能。在该网路中鉴定出Akt、CREB及粘着斑激酶(focal adhesion kinase,FAK)等关键基因。Akt又称为蛋白激酶B(protein kinase B,PKB),是一种丝氨酸/苏氨酸激酶,其激活后可进一步磷酸化下游靶蛋白如NF-κB, 从而调控多种细胞活动和生物功能,并参与神经病理性疼痛发生[14-15]。CREB作为调节转录的核因子,广泛表达于神经元中,其可被PKA、CaMKⅡ等多种蛋白激酶激活,调节神经元兴奋性和突触可塑性[16]。FAK是一种非受体型蛋白酪氨酸激酶,其与整合素配体结合后磷酸化激活,参与神经系统发育及突触可塑性[17]。研究表明,FAK可通过抑制细胞膜钙ATP酶影响细胞内钙离子稳态,介导伤害性反应[18]。
本研究运用蛋白质组学技术联合IPA生物信息分析揭示了大黄素可能通过抑制脊髓背角神经元神经病理性疼痛、突触长时程增强、神经元CREB、突触发生信号及钙离子信号等发挥镇痛作用。同时预测发现TCF7L2及APP是大黄素干预下差异表达蛋白可能的上游调控分子。最后,我们发现大黄素通过干预CaMKⅡ、PKA及PP2A等差异蛋白表达,调节“细胞间信号与相互作用、药物代谢、神经系统发育和功能”互作网路,发挥抗神经病理性疼痛作用。

