分子动力学模拟分析巴利昔冻干保护剂的活性保护机制
俞小娟,于传飞,房森彪,王兰
·论著·
分子动力学模拟分析巴利昔冻干保护剂的活性保护机制
俞小娟,于传飞,房森彪,王兰
102629 北京,中国食品药品检定研究院卫生部生物技术产品检定及标准化重点实验室/国家药品监督管理局生物制品质量研究与评价重点实验室(俞小娟、于传飞、王兰);100191 北京大学药学院天然药物与仿生药物国家重点实验室(俞小娟);410083 长沙,中南大学计算机学院(房森彪)
研究巴利昔单抗制剂中冻干保护剂蔗糖、甘氨酸、甘露醇的作用机制。
使用 Gromacs5.0.5 工具包,在 300K 的体系条件下,运用计算机模拟的方法,搭建模型,分别模拟分析了天然状态、干燥状态和添加复合保护剂的状态下的巴利昔-Fab分子结构,从结构生物学的角度比较并分析冻干保护剂对巴利昔制剂的保护机制。
干燥状态时,巴利昔分子的活性结构会有明显塌陷,无规则卷曲数目明显增多,分子间氢键数目减少,表面静电性质也会因此有所变化,而在蔗糖、甘氨酸和甘露醇复合保护剂存在的情况下,以上情况能明显得到改善,从而抑制巴利昔由于干燥失水而导致的结构塌缩和变性失活。
蔗糖、甘氨酸和甘露醇复合保护剂的使用能很好地保护巴利昔冻干制剂的活性。
巴利昔单克隆抗体; 活性结构; 保护机制; 分子动力学; 保护剂
巴利昔是以 CD25 为靶点的单克隆抗体药物,可以彻底抑制细胞免疫反应中由 IL-2 介导的关键信号通路,从而达到抗免疫排斥的作用。因此被广泛用于预防器官移植后的排斥反应[1-5],商品化的巴利昔单抗(舒莱)是白色冻干块状物,在制剂的生产和冻干过程中,为了保护蛋白分子的活性,加入了蔗糖、甘氨酸、甘露醇等辅料,作为冻干保护剂。
蔗糖是蛋白质的非特异性稳定剂,化学性质稳定,多呈无定型结构,可在蛋白质表面形成单分子层,对阻止单抗制剂在冻干处理过程中蛋白质二级结构的改变及货架期内蛋白质的伸展和聚集起显著的保护作用[6]。甘氨酸在冻干的过程中可通过抑制蛋白质制剂中磷酸缓冲盐结晶所致 pH 值的改变而阻止药物的变性,阻止因蛋白质结构塌陷而引起的药物的破坏[7]。1% 或更低浓度的甘露醇可通过无定型结构的形成阻止蛋白质药物的聚集[8]。
随着生物技术的迅速发展,越来越多的蛋白质药物被开发出来,冻干制剂有着稳定、便于运输、储存等优点,在生物制品的冻干工艺中,为特定的蛋白质类药物设计冻干保护剂和冻干方法是一项关键的工作。常用的冻干保护剂包括多羟基化合物、糖、氨基酸、聚合物以及吐温等,联合使用不同类型的保护剂可获得稳定性更佳的冻干制品[9]。
目前,冻干保护剂的开发主要是基于传统经验的重复试错。近年来,对于冻干保护剂及其保护机制的研究越来越深入,特别是随着计算机技术的发展,在已知蛋白质结构的基础上,通过数学建模的方式,对冻干过程中物料的真实状态进行模拟解析,可以为冻干技术的完善与提高提供理论依据[10]。针对不同的生物制剂,开发更加优越的冻干保护剂,提高蛋白质药物冻干制品的质量,是目前亟需解决的问题,也是现今生物技术药物研究的重点方向。
本文运用计算机建模的方法,模拟了干燥状态下蔗糖、甘氨酸和甘露醇与巴利昔单抗的相互作用的方式及其活性结构变化,从不同角度分析了蔗糖、甘氨酸和甘露醇复合保护剂对巴利昔单抗的活性保护效果及保护机制,从而为开发更具科学性和逻辑性的冻干工艺提供新的方法以及理论指导。
1 材料与方法
1.1 材料
巴利昔-Fab 的结构信息来自 PDB(Protein Data Bank)数据库http://www. rcsb.org/;蔗糖、甘氨酸和甘露醇的分子结构由Gaussview 5.0 构建;小分子结构优化软件使用 Gaussian 09 软件包;小分子对接软件使用Autodock;分子动力学软件使用 Gromacs 5.0.5。
1.2 方法
1.2.1 获取巴利昔、甘氨酸、甘露醇和蔗糖的三维结构 巴利昔蛋白上的抗体结合区域,又称 Fab 区域(抗原结合片段,每个 IgG 单抗分子含有2 个 Fab)。分子的天然原始结构(图 1A)来自蛋白质晶体数据库(Protein Data Bank,ID:3IU3)[11],通过添加氯离子来平衡巴利昔-Fab 分子所带的净电荷(+5e)。蔗糖、甘氨酸和甘露醇的分子结构通过 Gaussview 5.0 构建并使用 Gaussian 09 软件包[12-13],采用 B3LYP/6-311++G**方法进行结构优化至收敛,优化后的分子结构如图 1B、C、D所示。
1.2.2 建模及分子动力学模拟 使用 Gromacs 5.0.5 工具包在恒温恒容(NVT)的条件下模拟了蔗糖、甘氨酸和甘露醇与巴利昔-Fab 分子在真空环境中的相互作用。分别构建三种模拟体系,即:天然状态巴利昔-Fab 分子(Control);干燥状态下巴利昔-Fab 分子(Dry);干燥状态下巴利昔-Fab分子+保护剂(蔗糖、甘氨酸、甘露醇)(Protectant)。另外,在冻干工艺中,巴利昔制剂最终的水分含量约为 1%。因此,为了研究的准确性,同样向模拟体系中添加了相应含量的水分子。Protectant 体系中含有 1 个巴利昔-Fab 蛋白分子,16 个水分子,以及 535 个甘氨酸、535 个蔗糖和 535 个甘露醇分子。
巴利昔-Fab 采用 Amber99sb-ildn 力场[14],保护剂分子采用 Amber 通用分子力场,水分子模型选择 TIP3P 模型。分子间 Lennard-Jones 与范德华相互作用的截断半径选择 1.4 nm。静电相互作用修正采用 Particle Mesh Ewald 方法。
首先,将巴利昔-Fab 分子初始结构置于 10 nm × 10 nm × 10 nm 的周期性盒子中。然后,在巴利昔-Fab 分子周围随机定量添加保护剂分子和水分子,并采用最速下降法进行 1000 步结构优化,再以 LINear Con- straint Solver(LINCS)[15]方法限制住所有化学键的键长,利用 Maxwell 分布设置体系各原子的初始速度。所有体系都在 300K 条件下进行模拟,并采用 Velocity-rescale 方法控制体系温度,耦合常数选为 0.1。系统压力采用 Berendsen 方法维持在 1 个大气压左右。之后,再将准备好的体系分别进行 5 ns NVT 限制性预平衡,使体系中保护剂分子和水分子在巴利昔-Fab 周围均匀分布。最后,将处理好的体系模型在 NVT 系统下进行 100 ns 常规分子动力学模拟。对照组以同样方法模拟,取模拟的最后 10 ns 轨迹进行数据分析。
相对自由能表征的是巴利昔-Fab 分子在不同体系下的热稳定性,该自由能由 Boltzman function 计算,公式如下:() = –× ln(()) +其中()表示巴利昔-Fab 分子不同构象出现的概率,为常数。
2 结果
2.1 复合冻干保护剂对巴利昔-Fab 分子结构稳定性的影响
均方根偏差(RMSD)反映的是特定的构象与初始结构的偏离程度[16],值越小表明该特定构象与初始结构越接近。图 2A 为两个体系中巴利昔-Fab 的均方根偏差随时间变化的均值。从图 2A 中可看出,添加了复合保护剂的巴利昔-Fab 分子(Protectant)的 RMSD 值相较于干燥状态的巴利昔-Fab 分子(Dry)(0.40 nm)有了显著降低,这表明在冻干状态下蔗糖、甘氨酸和甘露醇可有效地增强巴利昔-Fab 分子活性结构的稳定性,使其更接近天然状态。
图 1 巴利昔-Fab(A)、甘氨酸(B)、甘露醇(C)和蔗糖(D)的初始三维结构
Figure 1 Natural 3D structure of basiliximab-Fab (A), glycine (B), mannitol (C) and sucrose (D)
图 2 各体系中巴利昔-Fab 分子的 RMSD(A)与 Rg 值(B)
Figure 2 Root-mean-square deviation (A) and gyration-radius (B) of basiliximab-Fab in different systems
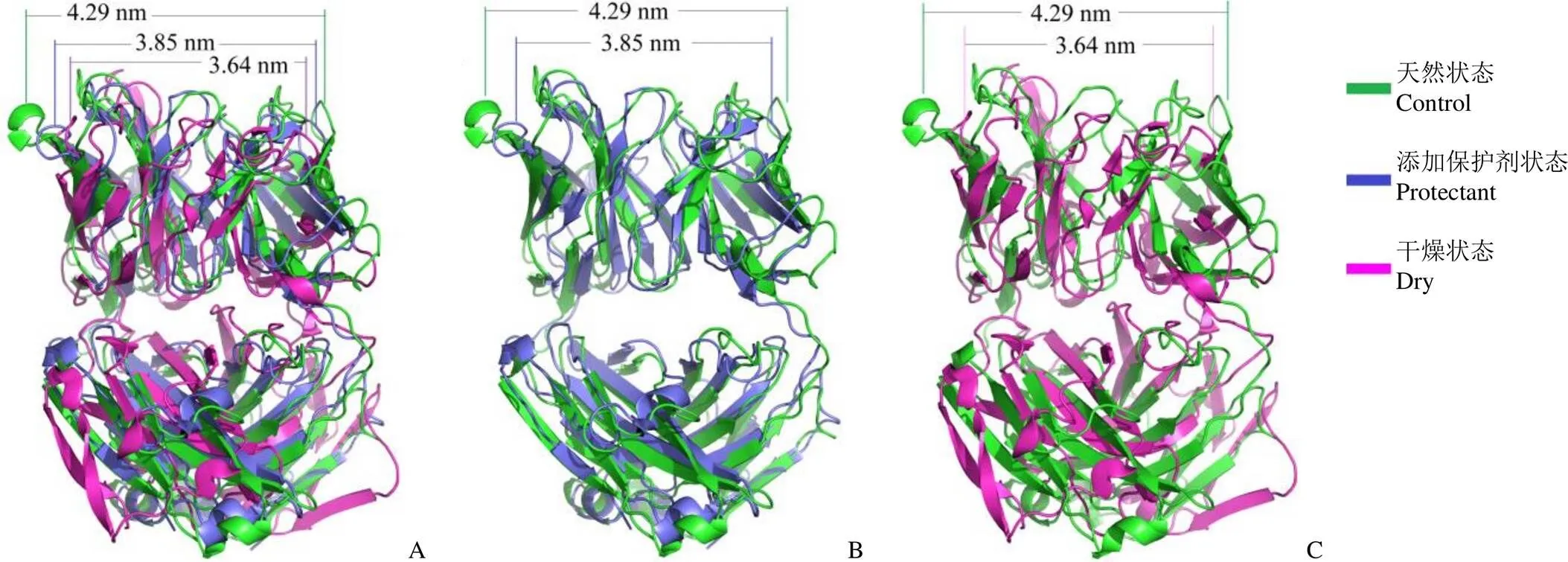
图 3 巴利昔-Fab 分子在天然、添加复合保护剂和干燥三种体系中在相对自由能最低点的构象(A:三种体系中巴利昔-Fab 分子双链直径比较;B:添加复合保护剂状态的巴利昔-Fab 分子双链直径与天然状态的比较;C:干燥状态的巴利昔-Fab分子双链直径与天然状态的比较)
Figure 3 Compare of the conformation of basiliximab-Fab in natural state, with protectant and dry state in relative free energies minimal point (A: Comparison of double chain diameter value of basiliximab-Fab in three different system; B: Comparison of double chain diameter value of basiliximab-Fab in protectant and control system; C: Comparison of double chain diameter value of basiliximab-Fab in dry and control system)
回旋半径(Rg)的定义为蛋白质结构中每个粒子与体系质心距离的几何平均值,其值反映了粒子结合的紧密程度,即粒子结合越紧密,Rg 值越小。图 2B 为各个体系中巴利昔-Fab 分子的Rg随时间变化的均值。从图 2B 可知,对照组(Control)中巴利昔-Fab分子的 Rg 是 3.28 nm,不添加保护剂组的巴利昔-Fab分子 Rg 是 2.82 nm,添加复合保护剂体系下巴利昔-Fab分子的 Rg 值是 3.09 nm。可见,相比于对照组的天然初始结构,巴利昔-Fab 分子在干燥状态下,回旋半径降低较多,这表明蛋白分子的内部结构由于水分的流失发生了塌陷和内陷,导致粒子结合更紧密,分子发生形变,但是,当添加复合保护剂时,回旋半径的降低得到了改善,分子形变得到了抑制。
图 3 为不同体系中巴利昔-Fab 分子在相对自由能最低点的构象,其中,天然状态下巴利昔-Fab 分子双链的直径为 4.29 nm,干燥状态下为 3.64 nm,添加复合保护剂状态下为 3.85 nm,表明,复合冻干剂的添加,能有效抑制巴利昔-Fab 分子构象的改变。
2.2 不同体系中巴利昔-Fab 分子的自由能
体系内分子间相互作用的自由能反映的是分子间相互作用力的强弱,即热稳定性,能量越低,体系越稳定,巴利昔-Fab 分子与水分子、保护剂分子之间相互作用,通过比较各个体系内分子间的相互作用的自由能,可评价各个体系的稳定性。由图 4 可知,天然状态体系的自由能最低,添加复合保护剂的巴利昔-Fab 分子体系次之,干燥巴利昔-Fab 分子体系的自由能最高。在天然状态中,蛋白质、水分子、复合保护剂三者之间均存在相互作用,且保护剂具有亲水性,水分子与保护剂之间存在较强的相互作用,降低了保护剂与抗体蛋白之间的相互作用,整个体系自由能最低,体系最为稳定;干燥状态下,在添加了复合保护剂的体系中,保护剂可与蛋白质分子相互作用,蛋白质结构相对较为稳定;而仅有巴利昔-Fab 分子的体系在干燥状态下,自由能急剧增加,状态最不稳定。
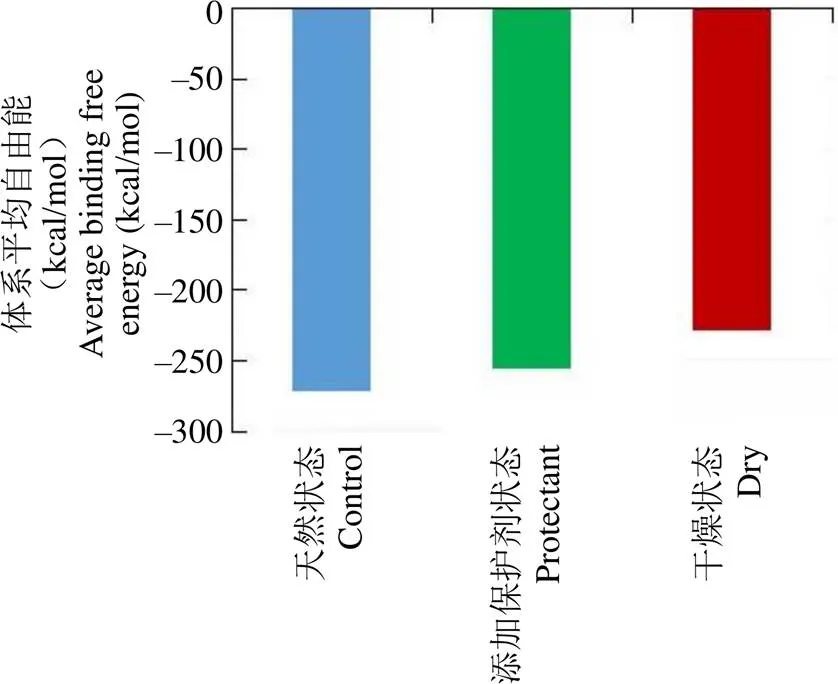
图 4 不同模拟体系下的自由能
Figure 4 Average interaction energy in different model system
2.3 复合冻干保护剂对巴利昔-Fab 分子表面亲/疏水性质的影响
亲/疏水表面积指的是蛋白质的亲水和疏水残基的溶剂可及表面积,其值越大则残基在环境中的暴露面积越大。图 5 为巴利昔-Fab 分子的可及平均亲/疏水表面积。可以看出,与天然态相比,干燥状态下的巴利昔-Fab 分子的疏水表面积显著增加,同时,亲水表面积显著减小,最终导致亲/疏水面发生反转,可见,干燥之后的巴利昔-Fab 分子的结构发生了巨大的形变;在添加了复合保护剂之后,显著减缓了巴利昔-Fab 分子的疏水表面积的增加,亲水表面积的降低也有改善。由此可以推测,保护剂可以有效抑制巴利昔-Fab 分子疏水残基的外翻和亲水残基的内卷,因此,保护剂可通过影响巴利昔-Fab 分子表面亲/疏水表面积来影响分子结构的改变。
2.4 复合冻干保护剂对巴利昔-Fab 分子二级结构的影响
α-螺旋(α-helix)、β-折叠(β-sheet)和无规则卷曲(Loop)是蛋白质主要的二级结构构象,其中无规则卷曲柔性最大,状态最不稳定。图 6 展示了不同体系中巴利昔-Fab 分子二级结构的变化情况,从图 6 可知,天然状态的巴利昔-Fab 分子含有的无规则卷曲结构数目最少,添加复合保护剂的次之,干燥状态下巴利昔-Fab 分子所含无规则卷曲结构的数目最多。由此可见,当在干燥环境中时,巴利昔-Fab 分子的二级结构会由α-螺旋和 β-折叠大量转变成无规则卷曲,使得蛋白质的活性结构发生较大的改变,由于α-螺旋有助于提高蛋白质的热稳定性,随着巴利昔-Fab 分子的α-螺旋的解旋,无规则卷曲的增加,导致蛋白分子的热稳定性降低,巴利昔的活性受到影响。而在添加了复合保护剂时,从一定程度上抑制了巴利昔-Fab 分子二级结构向无规则卷曲的转变,从而起到活性保护的作用。
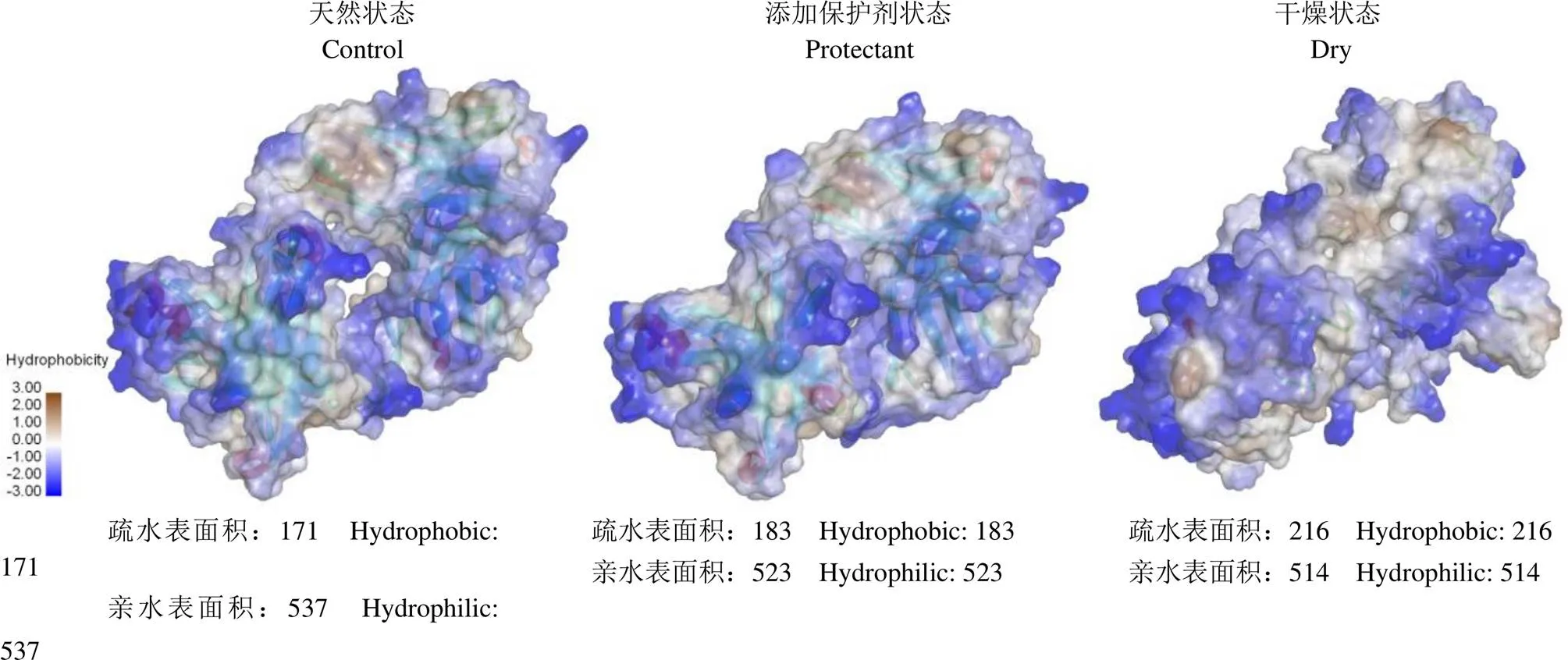
图 5 巴利昔-Fab 分子的亲/疏水表面积
Figure 5 Variation of the hydrophobic/hydrophilic surface of basiliximab-Fab
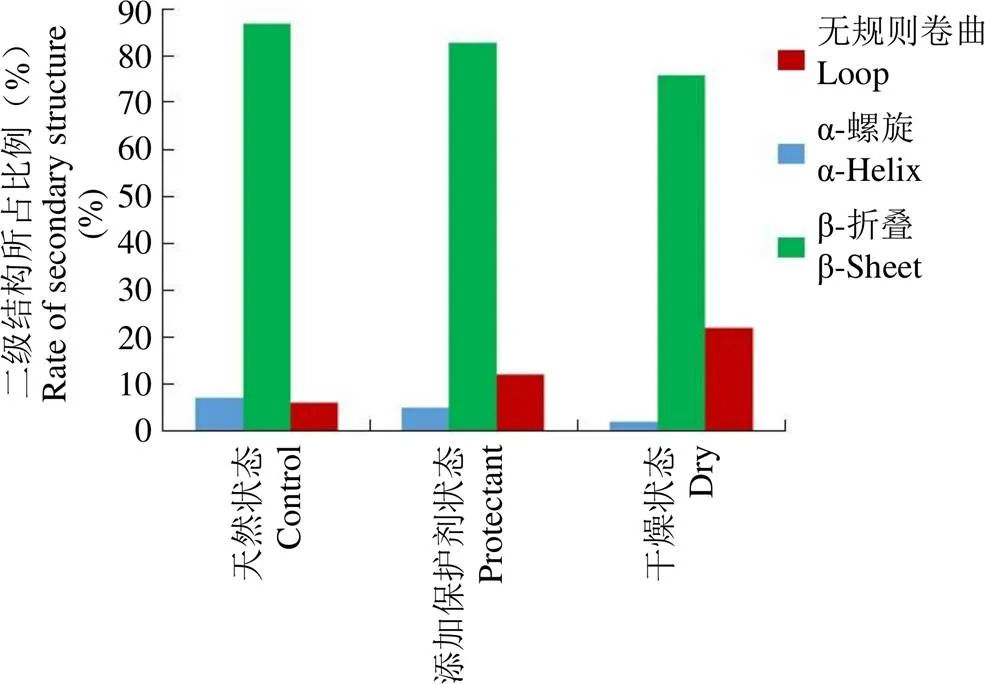
图 6 不同体系巴利昔-Fab 分子的二级结构分析
Figure 6 Secondary structure analysis of basiliximab-Fab
2.5 复合冻干保护剂与巴利昔-Fab 分子相互作用分析
由以上结论可知,蔗糖、甘氨酸和甘露醇组成的复合保护剂可有效地维持巴利昔-Fab 在冻干状态下的活性结构稳定性。保护剂对蛋白质类药物的保护作用主要是通过分子间相互作用实现的,主要推动力是静电相互作用,同时氢键也起一定的作用,糖和蛋白质之间形成的氢键,可抑制蛋白质在冷冻干燥过程中的构象改变[17]。为了探究氢键对该保护作用的影响,我们统计了截断半径 0.35 nm 范围内巴利昔-Fab 分子在三种体系时分子间形成的氢键数目以及可及表面积(图 7)。结果表明,干燥状态下的巴利昔-Fab 分子间氢键数目最少,为 168 个,天然状态下的巴利昔-Fab分子间氢键数目最多,为 263 个,添加复合保护剂状态下氢键数目为 210 个。由此可见,保护剂的添加,可有效增加氢键的形成,从而增加巴利昔-Fab 分子的稳定性。另外,统计了三种状态下巴利昔-Fab 分子的溶剂可及表面积,结果表明,和天然状态相比较,干燥状态的巴利昔-Fab由于分子内部塌陷导致表面溶剂可及表面积变化明显,当添加保护剂时,塌陷得到改善,表面的溶剂可及表面积接近天然状态。综上说明蔗糖、甘氨酸和甘露醇更容易占有巴利昔-Fab 分子的表面为蛋白质提供更接近水溶剂的氢键环境,从而保护蛋白质结构。
3 讨论
本文利用分子动力学方法模拟研究了巴利昔单抗的复合保护剂蔗糖、甘氨酸和甘露醇与蛋白质之间的相互作用关系,并与不添加保护剂的体系相比,可以看出,复合保护剂对巴利昔抗体蛋白有较好的保护作用。结果表明,巴利昔抗体蛋白分子因其具有极高柔性在干燥状态下会发生较大的形变导致分子变性失活,蔗糖、甘氨酸和甘露醇组成的复合保护剂可以通过氢键作用为干燥状态下的巴利昔单抗分子提供类似于水溶液中的氢键环境,改善蛋白分子表面的疏水性质,阻止无规则卷曲结构的形成,从而保护其蛋白质的天然构象不被破坏。分子模拟的方法与实验筛选相比,不仅快速、直观,节约时间和研究成本,而且能从理论上阐释其活性保护的规律,为阐明保护剂的保护效果和作用机制提供基础。随着大数据和计算机技术的不断发展,计算机模拟的方法在冻干制剂保护剂开发中的应用会越来越广泛。

图 7 巴利昔-Fab 分子与保护剂的氢键统计和包裹巴利昔-Fab 分子的保护剂的溶剂可及表面积
Figure 7 Interaction beween basiliximab-Fab and protectant and solvent accessible surface area of protectants locating near the basiliximab-Fab
[1] Otto G, Thies J, Kabelitz D, et al. Anti-CD25 monoclonal antibody prevents early rejection in liver transplantation--a pilot study. Transplant Proc, 1991, 23(1 Pt 2):1387-1389.
[2] Otto G, Thies J, Kraus T, et al. Monoclonal anti-CD25 for acute rejection after liver transplantation. Lancet, 1991, 338(8760):195.
[3] Perrella A, Arenga G, Pisaniello D, et al. Elevated CD4+/CD25+ T-cell frequency and function during hepatitis C virus recurrence after liver transplantation. Transplant Proc, 2009, 41(5):1761-1766.
[4] Shi LB, Zhang HW, Cui YY. Implication of different expression of IL-2 mRNA and IL-10 mRNA in CD4(+)CD25(+)T cell induced immune tolerance of liver transplantation in rat. Chin Crit Care Med, 2008, 20(5):257-260. (in Chinese)
史留斌, 张弘炜, 崔一尧. 白细胞介素-2和10 mRNA表达差异在CD4+CD25+T细胞诱导大鼠肝移植免疫耐受中的意义. 中国危重病急救医学, 2008, 20(5):257-260.
[5] Yoshizawa A, Ito A, Li Y, et al. The roles of CD25+CD4+ regulatory T cells in operational tolerance after living donor liver transplantation. Transplant Proc, 2005, 37(1):37-39.
[6] Wang W. Lyophilization and development of solid protein pharmaceuticals. Int J Pharm, 2000, 203(1-2):1-60.
[7] Souillac PO, Costantino HR, Middaugh CR, et al. Investigation of protein/carbohydrate interactions in the dried state. 1. Calorimetric studies. J Pharm Sci, 2002, 91(1):206-216.
[8] Wu SL, Leung D, Tretyakov L, et al. The formation and mechanism of multimerization in a freeze-dried peptide. Int J Pharm, 2000, 200(1): 1-16.
[9] Sun DP, Hu YQ. Stabilizing excipients in the freeze-dried protein formulations and their protective mechanisms. Prog Pharm Sci, 2003, 27(4):201-205. (in Chinese)
孙东坡, 胡一桥. 蛋白质冷冻干燥制品中的保护剂及其保护机制. 药学进展, 2003, 27(4):201-205.
[10] Pan Q, Li DX, Guo BS, et al. Active structure protection of monoclonal antibody fusion protein etanercept. Chem J Chin Univ, 2016, 37(2):274-280. (in Chinese)
潘琦, 李代禧, 郭柏松, 等. 单克隆抗体依那西普融合蛋白的活性结构保护. 高等学校化学学报, 2016, 37(2):274-280.
[11] Du J, Yang H, Zhang D, et al. Structural basis for the blockage of IL-2 signaling by therapeutic antibody basiliximab. J Immunol, 2010, 184(3):1361-1368.
[12] Latif NAA, Batran RZ, Mohamed SF, et al. Synthesis, molecular docking and dynamics simulation studies of new 7-oxycoumarin derivatives as potential antioxidant agents. Mini Rev Med Chem, 2018, 18(18):1572-1587.
[13] Javidan A, Taghizadeh MJ, Hosseini SA, et al. Docking, molecular dynamics simulation and synthesis of new fenobam analogues as mGlu5 receptor antagonists. Comb Chem High Throughput Screen, 2016, 19(9):764-770.
[14] Berhanu WM, Hansmann UH. Side-chain hydrophobicity and the stability of Aβ16-22 aggregates. Protein Sci, 2012, 21(12):1837-1848.
[15] Hess B. P-LINCS: a parallel linear constraint solver for molecular simulation. J Chem Theory Comput, 2008, 4(1):116-122.
[16] Yang C, Lu DN, Zhang ML, et al. Molecular dynamics simulation of impact of disulfide bridge on conformational stability of insulin. CIESC J, 2010, 61(4):929-934. (in Chinese)
杨程, 卢滇楠, 张敏莲, 等. 分子动力学模拟二硫键对胰岛素构象稳定性的影响. 化工学报, 2010, 61(4):929-934.
[17] Qin HM, Zong MH, Liang SZ. Molecular mechanism of the protective effect of sugar on protein drugs during freeze drying. Acad J Guangdong Coll Pharm, 2001, 17(4):305-307. (in Chinese)
秦华明, 宗敏华, 梁世中. 糖在蛋白质药物冷冻干燥过程中保护作用的分子机制. 广东药学院学报, 2001, 17(4):305-307.
Simulation analysis on the bioactive structural protection of lyoprotectantsin basiliximabby moleculardynamics
YU Xiao-juan, YU Chuan-fei, FANG Sen-biao, WANG Lan
To study the mechanism of sucrose, glycine and mannitol as lyoprotectants in production of basiliximab.
Under condition of 300K system, Gromacs 5.0.5 toolkit was used. The main methods include computer simulation and model building, which were used to simulate three states of basiliximab molecule: natural state, dry state, state adding sucrose, glycine and mannitol as a composite protective agent. Then, the mechanism was analyzed on the basis of comparison of structures.
The results showed that in the dry state, the active structure of basiliximab molecule was obviously collapsed, the region of loop structure was obviously increased, the number of hydrogen bonds was decreased, and the surface electrostatic property was also changed. In the presence of sucrose, glycine and mannitol as a composite protective agent, the above conditions was significantly improved, thus the structural collapse and denaturing inactivation were inhibited by drying and water loss of basiliximab.
Sucrose, glycine and mannitol combined as a composite protective agent can protect the activity of basiliximab lyophilized preparation.
Basiliximab; Bioactive structure; Protective mechanism; Molecular dynamics; Composite protective agent
WANG Lan, Email: wanglan@nifdc.org.cn
国家自然科学基金(21702007);中国食品药品检定研究院中青年发展研究基金(2019B1)
王兰,Email:wanglan@nifdc.org.cn
10.3969/j.issn.1673-713X.2020.06.002
Author Affiliations: Division of Monlclonal Antibodies, Institute for Biological Product Control, National Institutes for Food and Drug Control, Beijing 102629, China (YU Xiao-juan, YU Chuan-fei, WANG Lan); State Key Laboratory of Natural and Biomimetic Drugs, School of Pharmacy, Peking University, Beijing 100191, China (YU Xiao-juan); School of Computer Science, Zhongnan University, Changsha 410083, China (FANG Sen-biao)
2020-09-27

