支架材料在组织工程技术修复半月板损伤中的应用进展
李浩,杨振,高仓健,付力伟,刘舒云,郭全义
·综述·
支架材料在组织工程技术修复半月板损伤中的应用进展
李浩,杨振,高仓健,付力伟,刘舒云,郭全义
100853 北京,中国人民解放军总医院第一医学中心骨科研究所/骨科再生医学北京市重点实验室/全军骨科战创伤重点实验室(李浩、杨振、高仓健、付力伟、刘舒云、郭全义);300071 天津,南开大学医学院(李浩、杨振、高仓健、付力伟)
半月板是位于股骨远端和胫骨平台之间两个半圆形、楔形的纤维软骨组织,主要功能在于分配负荷和保护关节软骨[1]。在组织学上,半月板(图 1)可以划分为两个截然不同的区域:外侧(红-红区),含有血管和神经,包含细长的纤维母细胞样细胞和大量的 I 型胶原蛋白;内侧(白-白区),缺乏血管和神经,包含的主要是纤维软骨样细胞和II 型胶原蛋白,一旦损伤,修复能力极为有限[2-3]。半月板主要通过圆周排列的胶原纤维来分配负荷[4]。在半月板撕裂的情况下,这种功能相应的受到破坏,后期往往会导致骨性关节炎的发生[4-5]。目前,通过半月板部分切除术去除不稳定的、受损的撕裂部分仍然是手术治疗半月板撕裂的金标准,并且占美国膝关节镜手术的一半[6]。然而,部分或全部半月板切除术都与膝关节骨性关节炎的发展有关,并不能实质性地改善患者的预后和治疗效果[7]。
随着对半月板在膝关节生物力学中的重要作用的认识不断深入,利用组织工程技术进行半月板的修复再生为半月板损伤患者的治疗带来了新的希望。组织工程主要包含三个要素:支架、细胞和生长因子[8]。开发半月板再生支架的关键挑战之一在于其复杂的区域依赖性生物力学特征。这就要求支架材料必须具有适当的机械性能,在发挥缓冲作用的同时能够保持适合的关节面全接触力学支撑,以避免不均匀的力学冲击导致的关节软骨退化以及随后产生的骨性关节炎[9],同时承接的适宜力学刺激对于纤维软骨再生也有促进作用。此外,支架材料还需要具有优良的生物学特性,能够充分促进细胞的浸润、增殖和分化,进一步增强支架的整合性,以利于形态与功能兼备的半月板组织再生。随着天然聚合物、合成聚合物和脱细胞材料为主的生物材料和材料复合策略以及新型材料的迅速发展,共价交联、静电纺丝和 3D 打印等支架制备方法的不断创新,进一步为新的干预手段帮助患者恢复关节运动功能和实现半月板组织再生创造了条件。本文就近年来所研究的生物材料的类型和特性以及不同支架制备方法作一综述,并对支架的功能化策略进行展望,意在为应用组织工程技术治疗半月板损伤提供理论和研究依据。
1 半月板组织工程支架材料的性能要求
从合成支架的固有缺陷可以明显看出,目前的支架设计面临着无法充分满足半月板的复杂区域依赖性力学特性、成分构成和功能仿生的问题,为了解决这个问题,许多研究者聚焦于生物材料的角度,试图通过对材料的仿生设计,进一步开发一种取向性好,能够充分促进细胞增殖、分化的支架。理想情况下,用于半月板修复和再生的组织工程支架需要同时满足以下标准:①生物相容性好,体内生物反应温和,无免疫原性反应,降解速率和宿主组织再生协调,适宜于驻留细胞分泌细胞外基质(extracellular matrix,ECM);②具有相对低摩擦的表面,同时具有亲水性、亲细胞性,促进细胞的黏附增殖和浸润;③生物力学好,能够承受高的循环载荷,超过或匹配天然半月板组织的抗压、抗拉强度;④便于制备,同时抵抗长期蠕变的变形;⑤具备适宜的孔隙率和相互连接的通道,便于细胞渗透填充和新陈代谢,营养物质和代谢废物的有效转移;⑥具有良好的生物活性和药物投递性能,能够很好地保持药物并缓释,加速细胞组分的再生和ECM 的合成。满足以上条件的复合支架最终才能够充分仿生半月板微环境和微结构,实现成功再生的目的。
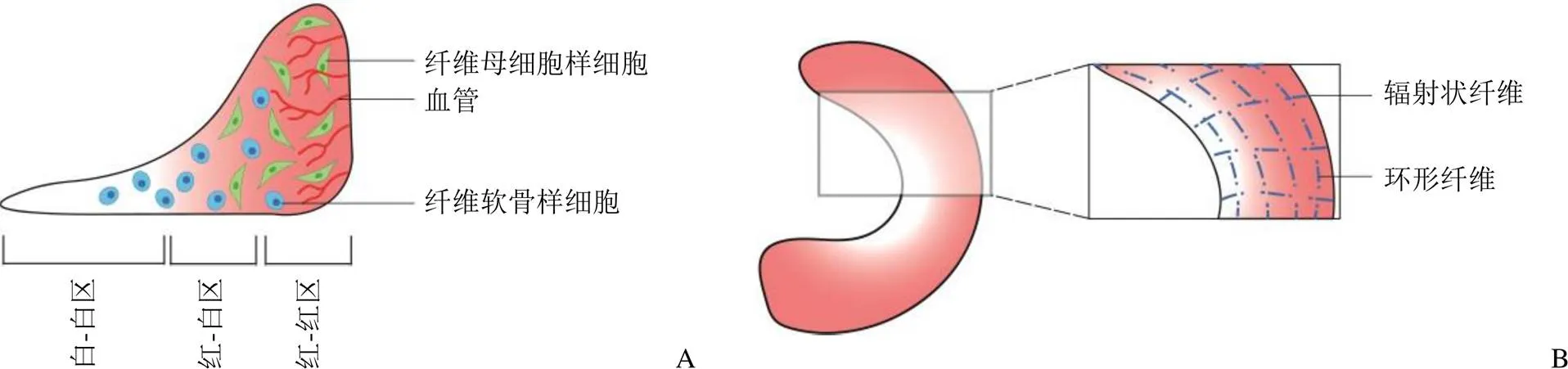
图 1 半月板结构特征(A:横截面观;B:俯视面观)
2 半月板组织工程支架材料的分类
生物材料在半月板修复和再生中起着重要的作用,基于生物材料制备的支架需要提供适宜的微环境来维持细胞的功能。这些支架必须具备合适的特性,例如力学强度、拓扑结构和降解特性,同时具有生物活性,能够促进细胞的迁移、增殖和分化。支架材料可分为脱细胞材料、天然聚合物和合成聚合物,目前主要应用的生物材料特点见表 1。
2.1 天然聚合物
天然聚合物例如多糖类和蛋白类具有优异的生物相容性、易于制备性和生物活性,应用于半月板支架中有着很大潜力。天然聚合物材料主要包括胶原、明胶、丝素蛋白、透明质酸、海藻酸盐和壳聚糖等。丝素蛋白是目前应用于半月板组织工程中的热门材料之一。丝素蛋白是一种天然蛋白质纤维,而桑蚕蚕茧来源的丝素蛋白目前应用的最为广泛[10]。丝素蛋白具有独特的机械强度、弹性、合适的生物相容性、低免疫原性和生物降解性[11-12]。值得关注的是,在半月板组织工程领域中丝素蛋白已被应用于 3D 打印技术并取得了一定进展。例如,Bandyopadhyay 和 Mandal[13]利用 3D 打印技术设计制备了基于丝素蛋白的仿生三层半月板支架,显示出理想的膨胀率、降解性和机械强度。将猪半月板纤维软骨细胞接种于该支架后,发现有大量的 ECM 组分分泌,同时细胞生长状况良好,细胞形态也得到了维持。考虑到天然聚合物材料广泛存在力学强度弱、形态维持困难的问题,需要利用不同方法进行交联以确保材料在生理条件下的稳定性。交联方法主要包括共价交联和非共价交联,两种途径各自有着不同的特点:前者可以增加材料的机械强度和稳定性,而后者适用于材料的注射使用[14]。例如海藻酸盐可以很容易地进行化学和物理修饰,以改进机械性能、降解性、凝胶特性和细胞亲和性等[15]。Kim 等[16]利用超纯化的海藻酸盐作为注射凝胶,通过 CaCl2溶液进行交联并用于兔半月板圆柱状缺损处的修复,展现出良好成纤维软骨修复性能。对天然聚合物材料的改性可以赋予其独特的理化性质。例如,甲基丙烯酰酯明胶(gelatin methacryloyl,GelMA)是明胶的一种衍生物,由于引入的甲基丙烯酰取代基的光聚合作用,在光引发剂的辅助和光照条件下,明胶链被赋予了光交联的性质,最终制备的 GelMA 材料因其理想的生物相容性和可控的机械性能受到研究者们的广泛关注[17-18]。Bahcecioglu 等[19]发现利用 GelMA 凝胶和 GelMA-海藻酸盐凝胶培养纤维软骨细胞后均显著提高 II 型胶原的表达,并分别在 I 型胶原和蛋白聚糖合成方面起到了明显的促进作用。这提示对于组织成分异质性的半月板来说,设计基于不同生物活性材料的取向性支架的重要意义。
2.2 合成聚合物
相较于天然材料,合成聚合物具有易于成型、供应方便、机械性能佳等一系列的优势,然而也存在着细胞亲和性差和生物活性低等缺陷,往往不能很好地与邻近的宿主组织相整合[3]。目前最常用于半月板组织工程的合成聚合物以脂肪族聚酯类为主,如聚己内酯(PCL)、聚乳酸-羟基乙酸共聚物(PLGA)和聚乳酸(PLA)等,其他的常见聚合物还包括聚乙二醇(PEG)、聚氨酯(PU)和聚环氧乙烷(PEO)等。
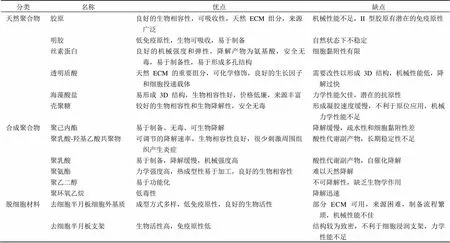
表 1 组织工程半月板支架材料的优缺点比较分析
PCL 是一种生物降解性的聚酯材料,由于其低熔点(56 ~ 61 ℃)、降解缓慢、良好细胞相容性和高度共混相容性,目前已广泛应用于组织工程骨、软骨、肌腱、皮肤等领域[20-21]。为了克服 PCL 的疏水性和细胞附着性差的缺陷,材料的表面修饰对于提升其生物学应用非常关键[22]。Gopinathan 等[23]将半乳糖整合入 PCL 纳米纤维支架内,显著地提升了支架亲水性并能够很好地维持半月板细胞的活性。将半月板细胞种植于该支架上,结果显示半乳糖的引入可有效地提升半月板细胞的黏附和增殖。Zhou 等[24]探究了氢氧化钠溶液不同的浸泡时间对 PCL 材料表面亲水性改性和细胞黏附性的影响,结果显示随着浸泡时间的延长,PCL 支架表面更加粗糙,在提升亲水性的同时改善了间充质干细胞和纤维软骨细胞的黏附、活性和增殖特性。
PLGA 是由不同比例的乙醇酸和乳酸单体组成的线性共聚物[25]。作为一种良好的药物负载材料,PLGA 在组织工程支架方面极具应用前景[26]。PLGA 具有许多吸引人的特性,包括生物降解性、简单灵活的制备方式、药物载体潜力、表面功能化修饰以及有针对性的靶向输送能力等[27]。PLGA 可以在水溶液中被水解,其中具有酯键的聚合物主链被随机水解,最终产物为生物惰性的乙醇酸和乳酸并通过常见的代谢途径从体内清除[28]。Gu 等[29]利用软骨源性形态发生蛋白 2 和转化生长因子 β1 对 PLGA 支架上接种的成肌细胞进行 14 d 的预培养,植入半月板缺损部位后产生了明显的组织修复效果。在载药应用方面,Tarafder 等[30]将转化生长因子 β3 和结缔组织生长因子分别加载于 PLGA 微球内并应用于半月板纵向损伤模型当中,结果显示一周内快速释放的结缔组织生长因子成功地将滑膜间充质干细胞招募至切口部位,并形成完整的纤维基质,而缓慢释放长达36 d 的转化生长因子 β3,成功地促进了纤维软骨基质的形成和与周围组织的良好整合。
PEO 具有生物相容性好、无毒性和降解迅速的特性,可以作为一种替代性的水溶性支架材料应用于组织工程领域来增加孔隙率并促进细胞浸润[31]。例如,Qu 等[32]设计了 PEO 电纺丝纤维负载具有基质降解作用的胶原酶,结果显示当含有胶原酶释放组分的复合支架体外植入半月板组织切口中后,PEO 迅速降解伴随着酶的释放并在切口边缘发挥局部消化作用,成功增加了组织孔隙度以利于细胞迁移和黏附。总的来说,疏水的合成聚合物缺乏接合基序去介导细胞行为,不过其疏水特性也降低了造成免疫原性反应的风险。此外,合成聚合物材料的功能还可以通过添加生物活性或细胞亲和的基序(如 RGD)来实现[33]。
2.3 组织来源的脱细胞材料
ECM 是一种天然的三维支架,具有特定的生化组分并且对于目标组织具有高度的结构相似性和低免疫原性,ECM 材料包含蛋白多糖、糖胺多糖和多种生长因子,对于组织细胞的迁移、增殖和分化均具有一定的调节能力。脱细胞技术的迅速发展使得 ECM 类材料已广泛应用于组织工程领域[34]。在半月板组织工程领域,诸多体内外实验均验证了脱细胞材料作为支架的良好性能。最近,Ruprecht 等[35]证明了利用猪半月板组织制备的 ECM 支架具有高度的细胞亲和性并能促使细胞浸润入支架,提示其具有一定的原位细胞招募作用。为了克服单纯 ECM 支架机械强度不足的缺陷,Yuan 等[36]设计了脱矿松质骨和脱细胞半月板细胞外基质的复合支架,在拉伸和压缩性能上均明显提升的同时,兔半月板软骨细胞在复合支架上生长较好,也有较多的 GAG 和胶原的分泌,动物实验对比发现相较于单纯的脱细胞外基质支架,复合支架的修复效果更好。Gao 等[37]将不同比例的脱细胞半月板细胞外基质和 PCL 混合,利用静电纺丝技术制备了一种复合纤维支架,实验按照不同浓度细胞半月板细胞外基质混入和纤维走行是否取向而分组,结果显示取向纤维在力学强度表现更好的同时,20% 脱细胞半月板细胞外基质的混入产生了最佳的细胞黏附和增殖表现。尽管组织来源的脱细胞材料具有诸多优势,但如何优化其制备流程和丰富其组织来源值得研究者们继续探究。
2.4 复合支架
复合支架指的是支架材料由多种理化性质不同的聚合物材料结合而成,其主要优势在于能够满足单一材料不能够实现的理想的综合特性[38]。多种材料的结合相较于单个材料,可以构建同时提高生物学和力学特性的复合材料。由多种合成和天然的聚合物材料所制备的复合支架已被用于半月板组织工程领域当中并展现出潜在的应用价值。
聚合物材料与仿细胞外基质材料是半月板组织工程领域中最常见的复合材料体系。Cengiz 等[39]利用 3D 打印技术将丝素蛋白和 PCL 制备成为复合支架,在 PCL 提供骨架以满足力学要求的同时,丝素蛋白的引入增加了支架的孔隙率同时减低了压缩应力,接种半月板细胞并植入裸鼠皮下后发现这种复合支架的组织浸润效果更好,同时免疫反应较轻。从提升支架的机械性能角度出发,Gao 等[40]用静电纺丝 PCL 纤维增强支架的机械性能,通过脱细胞半月板细胞外基质提供宜于细胞浸润、黏附和生长的良好微环境,设计制备了一种具有 5 层结构的 PCL-脱细胞半月板细胞外基质-PCL 复合支架,其良好的半月板修复效果验证了支架兼顾力学仿生和成分仿生的重要性。此外,生物材料还可以作为细胞或因子的优良载体,通过生物活性分子的引入和可控释放有助于新生细胞的迁移和支架的整合。例如,Qu 等[41]制备了旨在提升半月板组织修复的三组分纳米纤维支架,支架由 PEO、透明质酸和 PCL 纤维混纺而成,其中 PCL 作为类似于 ECM 纤维的纳米结构为支架提供足够的机械强度;PEO 纤维内含的胶原酶和透明质酸纤维内含的血小板衍生生长因子 AB 作为生物活性成分。以上三种纳米纤维同时静电纺丝的方法提供了一个序贯的治疗组分释放过程,为了实现修复组织周围细胞募集的目的,迅速降解的 PEO 释放出胶原酶以减少组织界面的 ECM 致密程度和强度,接下来降解的透明质酸纤维释放的血小板衍生生长因子 AB 利于招募内源性细胞富集于损伤部位。该支架与半月板外植体植入裸鼠皮下后显示支架整合程度达 77%,免疫组化分析也显示,支架组的 I 型和 II 型胶原大量沉积于组织界面附近,提示该支架具有良好的细胞募集和提升支架整合性的作用。综上所述,复合支架可以充分结合发挥不同聚合物材料的特性,满足力学要求的同时利于细胞黏附和生长,从而为半月板再生修复提供良好的基础。
3 半月板支架制备方法进展
仅仅关注聚合物材料种类选择,对于目标组织的机械和形态匹配方面可能是不够的。除去材料本身的类型和特性之外,制备技术可以影响生物材料的孔隙结构、降解特性、机械强度、细胞浸润性等一系列属性[42]。重要的是,支架的优良理化功能特性和可重复性在损伤治疗方面必不可少[43],应当根据实际需要和生物材料的特性灵活选择构建支架的制备方法和技术。表 2 展示了一些传统的和新发展的支架制备方法。

表 2 组织工程半月板支架制备方法
传统的半月板支架材料制作方式包括溶剂浇铸/颗粒浸出、模具塑型、冷冻干燥和静电纺丝技术等[5]。每种技术各有其特点也有其劣势。例如静电纺丝的优势在于不仅可以制造微米级别的纤维,还能制造直径在纳米级别的纤维[44]。静电纺丝纳米纤维具有不同于其他材料的独特特性,高的表面体积比、连通的孔隙结构以及表面功能化的潜力使得纳米纤维具有模拟 ECM 的可行性[45]。静电纺丝的缺点则包括孔隙尺寸过小,纤维致密,导致支架过薄而无法满足临床应用需要等[46]。
对于支架构建来说,模拟组织本身的取向纤维排列结构对于细胞迁移、生长和组织再生意义重大。Chen等[47]利用基于立体光刻的 3D 打印技术,制备了负载骨髓间充质干细胞外泌体的脱细胞软骨细胞外基质/GelMA 组织工程支架,该支架具有径向的取向孔道以利于周围组织软骨细胞的迁移,为组织工程半月板支架制备提供了新的思路。针对传统的静电纺丝共混方式载药而导致的药物突然释放的风险,有研究者开发出同轴静电纺丝技术,通过同时喷射出两种不同组分的纺丝液而形成的核-壳结构,可以保护脆弱的生长因子等蛋白质[48-49]。Baek 等[50]利用聚乙二醇溶剂和同轴静电纺丝技术制备了一种由聚乙二醇改性的聚乳酸为外壳、包裹血小板衍生生长因子 BB 的牛血清白蛋白溶液为内核的纳米纤维支架,该支架具有理想的机械性能、细胞亲和性和良好的生长因子缓释特性。
针对传统半月板支架加工方法所存在的诸如难以控制支架孔径、几何结构和孔隙连通性以及细胞和生物活性因子的空间分布不精确等问题。目前迅速发展的 3D 生物打印技术可以混合打印聚合物和水凝胶材料制备支架,温和性的水凝胶可以有效封装细胞并维持其活性[51-52]。例如,Sun等[53]利用明胶/纤维蛋白原/透明质酸/甘油复合凝胶作为细胞载体,采用 3D 生物打印技术制作了可供移植的仿生半月板结构,应用于山羊半月板移植模型,证实有较好的修复效果。在天然纤维软骨中,原位的细胞不仅能通过来自细胞外基质的拓扑变化感知机械传导,而且还可以通过机械刺激(如间质流动)感知周边的物理微环境。有研究人员利用微流控技术模拟细胞外基质的机械刺激和微观拓扑结构探究其对干细胞的影响。例如,Zhong 等[54]制备了结合纳米拓扑结构和流动刺激的仿生微流控装置,结果表明,垂直于纳米纤维排列的流动方向有利于间充质干细胞的纤维软骨分化。总之,发展新的支架制备方法和发掘现有技术潜力对于提升半月板损伤修复效果至关重要。
4 组织工程半月板支架的功能化进展
不同的制备方法开发的组织工程支架一直力求从结构、成分和功能方面来模仿天然组织以达到更好的修复效果。得益于其本身复杂的异质性结构作支撑,半月板发挥着维持关节稳定和稳态的重要功能,同时这种结构也造成了修复过程的困难性。关节腔内的力学环境严酷性、组织致密性、细胞的高度分化类型和缺乏血供等特质导致周围细胞完成迁移、增殖和分化的整个修复再生过程极度受限且漫长。
支架的功能化改进首先需要满足生物力学要求。半月板作为膝关节内发挥传导并缓冲关节应力的重要组织结构,其组织生化成分、基因表达水平和机械强度也受到力学环境的影响[55]。因此,为有效实现损伤后的再生修复,组织工程半月板支架材料需要克服关节内的力学冲击并对生物力学刺激做出适应性反应。例如,多项研究表明半月板细胞具有灵敏的机械刺激反应性,在不同的生物力学刺激下可表现出代谢活动改变或促炎/抗炎反应等生物学效应[56-57]。近年来,有学者尝试应用生物力学刺激促使半月板支架纤维软骨化并产生了一定的研究成果。例如,Zhang 等[58]利用定制动态拉伸-拉伸负荷加载系统对负载骨髓间充质干细胞的 PCL 支架进行持续力学刺激,在转化生长因子 β3 和结缔组织生长因子复合培养 2 周后加载最大为 10% 压缩形变的生物力学刺激,制备出的细胞支架复合物移植入兔半月板缺损部位后不仅满足了细胞和 ECM 组分的重建需求,同时也很好地提供了生物力学支撑并恢复了膝关节的运动功能。此外,Polito 等[59]的结果表明,施加于原生半月板细胞的持续压力,会以破坏胶原纤维的正常组织为代价,触发细胞外基质的重塑和细胞表型的早期成熟。也有数据表明,动态压缩载荷应变从 10% 增加到 20% 会导致半月板外植体的分解代谢活性和炎症反应增加[55]。这提示我们在未来研究设计中应用生物反应器作用于细胞-支架复合物的生物力学负荷强度和作用时间的参数设定仍有待进一步探索。
在生物学活性方面,研究者们一直以来试图通过补充各种生长因子,诸如转化生长因子 β、胰岛素样生长因子、血小板衍生生长因子、成纤维细胞生长因子、骨形态发生蛋白来促进再生过程[60]。负载生物活性分子的功能化支架是目前广泛研究的一个领域。Lee 等[61]构建了去细胞半月板支架为基础的功能化支架用于半月板修复实验,通过与肝素的亲和作用将血小板衍生生长因子固定于支架之上来实现损伤组织内源性细胞的募集,并提供半月板再生良好的特异性微环境,结果显示,在原位组织和支架之间间隙填充良好,生物力学特性也得到了提升。另一方面,具有诸多特性的纳米材料与聚合物的复合材料可以克服传统聚合物的局限性,是更加理想的选择之一[62]。例如,碳纳米管、石墨烯以及氧化石墨烯颗粒具有不同寻常的机械强度和高表面积/体积比,能够赋予材料一定的生物学活性[42]。Gopinathan 等[63]探究了碳纳米管混合 PCL 后的治疗效果,结果发现制备的纳米纤维增强了人半月板细胞的增殖特性。其他的无机材料同样具有独特的生物学特性并在体内实验中展现出一定的修复效果。Zhang 等[64]发现高纯度镁制成的缝针材料可以有效促进滑膜间充质干细胞的黏附和迁移,并促进纤维软骨分化。总之,为了达到支架的功能化以促进半月板再生的目的,对于生物材料的生物力学和生物化学刺激被广泛研究并应用,越来越多的具备多种特性的生物材料被证明具有组织工程领域的应用潜力,对于材料的综合利用和创新探究正方兴未艾。
5 结论与展望
半月板损伤的修复再生是骨科工作者一直以来试图解决的基础研究难题和临床关注热点。随着对半月板的解剖、结构和生理研究的不断深入,基于生物材料的组织工程支架再生策略展现出极具应用潜力的前景。鉴于单一材料制备的支架往往不能满足半月板再生修复复杂要求的现实,多种材料的复合支架,创新性的制备方法、生物力学刺激以及包括生物活性分子、纳米材料和无机材料的功能化改造,在基础研究中证明能更好地满足半月板支架机械性能和生物学性能要求,是未来研究的大方向之一。然而目前的支架距离临床转化还存在着一定距离,再生半月板组织的质量、支架与周围组织的整合、降解速度与组织再生速度的匹配乃至于组织异质性的重建都是棘手的问题。新兴材料的发现和先进支架制备技术的进步,将有助于组织工程半月板支架达到结构、成分、功能均成功仿生的目标,有望提高临床治疗半月板损伤的疗效。
[1] Fox AJ, Wanivenhaus F, Burge AJ, et al. The human meniscus: a review of anatomy, function, injury, and advances in treatment. Clin Anat, 2015, 28(2):269-287.
[2] Bilgen B, Jayasuriya CT, Owens BD. Current concepts in meniscus tissue engineering and repair. Adv Healthc Mater, 2018, 7(11): e1701407.
[3] Makris EA, Hadidi P, Athanasiou KA. The knee meniscus: structure–function, pathophysiology, current repair techniques, and prospects for regeneration. Biomaterials, 2011, 32(30):7411-7431.
[4] Kwon H, Brown WE, Lee CA, et al. Surgical and tissue engineering strategies for articular cartilage and meniscus repair. Nat Rev Rheumatol, 2019, 15(9):550-570.
[5] Feng ZY, Fan YF, Guo JS, et al. Research progress of scaffold materials for tissue engineered meniscus. Chin J Reparative Reconstr Surg, 2019, 33(8):1019-1028. (in Chinese)
冯子嫣, 樊逸菲, 郭玖思, 等. 组织工程半月板支架材料的研究进展. 中国修复重建外科杂志, 2019, 33(8):1019-1028.
[6] Kim S, Bosque J, Meehan JP, et al. Increase in outpatient knee arthroscopy in the United States: a comparison of national surveys of ambulatory surgery, 1996 and 2006. J Bone Joint Surg Am, 2011, 93(11):994-1000.
[7] Papalia R, Del Buono A, Osti L, et al. Meniscectomy as a risk factor for knee osteoarthritis: a systematic review. Br Med Bull, 2011, 99(1):89-106.
[8] Pereira H, Frias AM, Oliveira JM, et al. Tissue engineering and regenerative medicine strategies in meniscus lesions. Arthroscopy, 2011, 27(12):1706-1719.
[9] Murphy CA, Costa JB, Silva-Correia J, et al. Biopolymers and polymers in the search of alternative treatments for meniscal regeneration: state of the art and future trends. Appl Mater Today, 2018, 12:51-71.
[10] Kashirina A, Yao Y, Liu Y, et al. Biopolymers as bone substitutes: a review. Biomater Sci, 2019, 7(10):3961-3983.
[11] Guziewicz N, Best A, Perez-Ramirez B, et al. Lyophilized silk fibroin hydrogels for the sustained local delivery of therapeutic monoclonal antibodies. Biomaterials, 2011, 32(10):2642-2650.
[12] Altman GH, Diaz F, Jakuba C, et al. Silk-based biomaterials. Biomaterials, 2003, 24(3):401-416.
[13] Bandyopadhyay A, Mandal BB. A three-dimensional printed silk-based biomimetic tri-layered meniscus for potential patient- specific implantation. Biofabrication, 2019, 12(1):015003.
[14] Diba M, Camargo WA, Brindisi M, et al. Composite colloidal gels made of bisphosphonate-functionalized gelatin and bioactive glass particles for regeneration of osteoporotic bone defects. Adv Funct Mater, 2017, 27(45):1703438.
[15] Lee KY, Mooney DJ. Alginate: properties and biomedical applications. Prog Polym Sci, 2012, 37(1):106-126.
[16] Kim WY, Onodera T, Kondo E, et al. Effects of ultra-purified alginate gel implantation on meniscal defects in rabbits. Am J Sports Med, 2019, 47(3):640-650.
[17] Van Den Bulcke AI, Bogdanov B, De Rooze N, et al. Structural and rheological properties of methacrylamide modified gelatin hydrogels. Biomacromolecules, 2000, 1(1):31-38.
[18] Zhou J, Tian Z, Tian QY, et al. Properties of gelatin methacrylate/ decellularized meniscus extracellular matrix composite hydrogel with different crosslinking densities. Chin J Tissue Eng Res, 2020, 24(16):2493-2499. (in Chinese)
周建, 田壮, 田沁玉, 等. 不同交联密度甲基丙烯酰酯明胶/脱细胞半月板细胞外基质复合水凝胶的性能. 中国组织工程研究, 2020, 24(16):2493-2499.
[19] Bahcecioglu G, Bilgen B, Hasirci N, et al. Anatomical meniscus construct with zone specific biochemical composition and structural organization. Biomaterials, 2019, 218:119361.
[20] Abedalwafa M, Wang F, Wang L, et al. Biodegradable poly-epsilon- caprolactone (PCL) for tissue engineering applications: a review. Rev Adv Mater Sci, 2013, 34(2):123-140.
[21] Teng CP, Mya KY, Win KY, et al.Star-shaped polyhedral oligomeric silsesquioxane-polycaprolactone-polyurethane as biomaterials for tissue engineering application. NPG Asia Mater, 2014, 6(11):e142.
[22] Mondal D, Griffith M, Venkatraman SS. Polycaprolactone-based biomaterials for tissue engineering and drug delivery: current scenario and challenges. Int J Polym Mater Polym Biomat, 2016, 65(5):255- 265.
[23] Gopinathan J, Mano S, Elakkiya V, et al. Biomolecule incorporated poly-ε-caprolactone nanofibrous scaffolds for enhanced human meniscal cell attachment and proliferation. RSC Adv, 2015, 5(90):73552-73561.
[24] Zhou ZX, Chen YR, Zhang JY, et al. Facile strategy on hydrophilic modification of poly (ε-caprolactone) scaffolds for assisting tissue-engineered meniscus constructs in vitro. Front Pharmacol, 2020, 11:471.
[25] Gentile P, Chiono V, Carmagnola I, et al. An overview of poly (lactic-co-glycolic) acid (PLGA)-based biomaterials for bone tissue engineering. Int J Mol Sci, 2014, 15(3):3640-3659.
[26] Mir M, Ahmed N, Rehman AU. Recent applications of PLGA based nanostructures in drug delivery. Colloid Surf B Biointerfaces, 2017, 159:217-231.
[27] Danhier F, Ansorena E, Silva JM, et al. PLGA-based nanoparticles: an overview of biomedical applications. J Control Release, 2012, 161(2): 505-522.
[28] Lü JM, Wang X, Marin-Muller C, et al. Current advances in research and clinical applications of PLGA-based nanotechnology. Expert Rev Mol Diagn, 2009, 9(4):325-341.
[29] Gu Y, Zhu W, Hao Y, et al. Repair of meniscal defect using an induced myoblast-loaded polyglycolic acid mesh in a canine model. Exp Ther Med, 2012, 3(2):293-298.
[30] Tarafder S, Gulko J, Sim KH, et al. Engineered healing of avascular meniscus tears by stem cell recruitment. Sci Rep, 2018, 8(1):1-9.
[31] Baker BM, Gee AO, Metter RB, et al. The potential to improve cell infiltration in composite fiber-aligned electrospun scaffolds by the selective removal of sacrificial fibers. Biomaterials, 2008, 29(15): 2348-2358.
[32] Qu F, Lin JM, Esterhai JL, et al. Biomaterial-mediated delivery of degradative enzymes to improve meniscus integration and repair. Acta Biomater, 2013, 9(5):6393-6402.
[33] Papageorgiou P, Vallmajo-Martin Q, Kisielow M, et al. Expanded skeletal stem and progenitor cells promote and participate in induced bone regeneration at subcritical BMP-2 dose. Biomaterials, 2019, 217:119278.
[34] da Silva Morais A, Vieira S, Zhao X, et al. Advanced biomaterials and processing methods for liver regeneration: state-of-the-art and future trends. Adv Healthc Mater, 2020, 9(5):e1901435.
[35] Ruprecht JC, Waanders TD, Rowland CR, et al. Meniscus-derived matrix scaffolds promote the integrative repair of meniscal defects. Sci Rep, 2019, 9(1):8719.
[36] Yuan Z, Liu S, Hao C, et al. AMECM/DCB scaffold prompts successful total meniscus reconstruction in a rabbit total meniscectomy model. Biomaterials, 2016, 111:13-26.
[37] Gao S, Guo W, Chen M, et al. Fabrication and characterization of electrospun nanofibers composed of decellularized meniscus extracellular matrix and polycaprolactone for meniscus tissue engineering. J Mater Chem B, 2017, 5(12):2273-2285.
[38] Pillai MM, Gopinathan J, Selvakumar R, et al. Human knee meniscus regeneration strategies: a review on recent advances. Curr Osteoporos Rep, 2018, 16(3):224-235.
[39] Cengiz IF, Maia FR, da Silva Morais A, et al. Entrapped in cage (EiC) scaffolds of 3D-printed polycaprolactone and porous silk fibroin for meniscus tissue engineering. Biofabrication, 2020, 12(2):025028.
[40] Gao S, Chen M, Wang P, et al. An electrospun fiber reinforced scaffold promotes total meniscus regeneration in rabbit meniscectomy model. Acta Biomater, 2018, 73:127-140.
[41] Qu F, Holloway JL, Esterhai JL, et al. Programmed biomolecule delivery to enable and direct cell migration for connective tissue repair. Nat Commun, 2017, 8(1):1780.
[42] Koons GL, Diba M, Mikos AG. Materials design for bone-tissue engineering. Nat Rev Mater, 2020, 5:584-603.
[43] Dutta RC, Dey M, Dutta AK, et al. Competent processing techniques for scaffolds in tissue engineering. Biotechnol Adv, 2017, 35(2):240-250.
[44] Shih YV, Chen CN, Tsai SW, et al. Growth of mesenchymal stem cells on electrospun type I collagen nanofibers. Stem Cells, 2006, 24(11): 2391-2397.
[45] Zamani M, Prabhakaran MP, Ramakrishna S. Advances in drug delivery via electrospun and electrosprayed nanomaterials. Int J Nanomed, 2013, 8:2997-3017.
[46] Goh YF, Shakir I, Hussain R. Electrospun fibers for tissue engineering, drug delivery, and wound dressing. J Mater Sci, 2013, 48(8):3027- 3054.
[47] Chen P, Zheng L, Wang Y, et al. Desktop-stereolithography 3D printing of a radially oriented extracellular matrix/mesenchymal stem cell exosome bioink for osteochondral defect regeneration. Theranostics, 2019, 9(9):2439-2459.
[48] Yu H, Chen X, Cai J, et al. Dual controlled release nanomicelle-in-nanofiber system for long-term antibacterial medical dressings. J Biomater Sci Polym Ed, 2019, 30(1):64-76.
[49] Adeli-Sardou M, Yaghoobi MM, Torkzadeh-Mahani M, et al. Controlled release of lawsone from polycaprolactone/gelatin electrospun nano fibers for skin tissue regeneration. Int J Biol Macromol, 2019, 124:478-491.
[50] Baek J, Lee E, Lotz MK, et al. Bioactive proteins delivery through core-shell nanofibers for meniscal tissue regeneration. Nanomedicine, 2020, 23:102090.
[51] Wu Q, Qi JH. New research progress on scaffolds of cartilage tissue engineering. Chin Med Biotechnol, 2017, 12(2):184-188. (in Chinese)
吴琪, 亓建洪. 软骨组织工程中支架材料研究的新进展. 中国医药生物技术, 2017, 12(2):184-188.
[52] Ferris CJ, Gilmore KG, Wallace GG, et al. Biofabrication: an overview of the approaches used for printing of living cells. Appl Microbiol Biotechnol, 2013, 97(10):4243-4258.
[53] Sun Y, You Y, Jiang W, et al. Generating ready-to-implant anisotropic menisci by 3D-bioprinting protein-releasing cell-laden hydrogel- polymer composite scaffold. Appl Mater Today, 2020, 18:100469.
[54] Zhong W, Zhang W, Wang S, et al. Regulation of fibrochondrogenesis of mesenchymal stem cells in an integrated microfluidic platform embedded with biomimetic nanofibrous scaffolds. PloS One, 2013, 8(4):e61283.
[55] Chen M, Guo W, Gao S, et al. Biomechanical stimulus based strategies for meniscus tissue engineering and regeneration. Tissue Eng Part B Rev, 2018, 24(5):392-402.
[56] Ferretti M, Srinivasan A, Deschner J, et al. Anti-inflammatory effects of continuous passive motion on meniscal fibrocartilage. J Orthop Res, 2005, 23(5):1165-1171.
[57] McNulty AL, Guilak F. Mechanobiology of the meniscus. J Biomech, 2015, 48(8):1469-1478.
[58] Zhang ZZ, Chen YR, Wang SJ, et al. Orchestrated biomechanical, structural, and biochemical stimuli for engineering anisotropic meniscus. Sci Transl Med, 2019, 11(487):eaao0750.
[59] Polito U, Peretti GM, Di Giancamillo M, et al. Meniscus matrix remodeling in response to compressive forces in dogs. Cells, 2020, 9(2):265.
[60] Chen M, Guo W, Gao S, et al. Biochemical stimulus-based strategies for meniscus tissue engineering and regeneration. Biomed Res Int, 2018, 2018:8472309.
[61] Lee KI, Olmer M, Baek J, et al. Platelet-derived growth factor-coated decellularized meniscus scaffold for integrative healing of meniscus tears. Acta Biomater, 2018, 76:126-134.
[62] Joshi M, Bhattacharyya A. Nanotechnology - a new route to high-performance functional textiles. Text Prog, 2011, 43(3):155-233.
[63] Gopinathan J, Pillai MM, Sahanand KS, et al. Synergistic effect of electrical conductivity and biomolecules on human meniscal cell attachment, growth, and proliferation in poly-ε-caprolactone nanocomposite scaffolds. Biomed Mater, 2017, 12(6):065001.
[64] Zhang ZZ, Zhou YF, Li WP, et al. Local administration of magnesium promotes meniscal healing through homing of endogenous stem cells: a proof-of-concept study. Am J Sports Med, 2019, 47(4):954-967.
10.3969/j.issn.1673-713X.2020.06.011
国家自然科学基金面上项目(81972070)
郭全义,Email:doctorguo_301@163.com
2020-06-24

