Von Hippel-Lindau综合征相关肾癌的治疗(附2例报告)
刘海涛,官毅,祝恒成,宋华杰
武汉大学人民医院,湖北武汉430060
Von Hippel-Lindau(VHL)基因为抑癌基因,位于常染色体3p25-26,VHL基因突变可导致VHL综合征。VHL综合征是一种罕见的可影响多个器官系统的常染色体显性遗传病,临床表现复杂,可累及中枢神经系统、视网膜、腹部多脏器等发生多种良性和恶性肿瘤,其中肾细胞癌为VHL并发症中恶性程度最高的疾病。VHL综合征相关肾癌常为多灶性且多双侧发病,具有局部复发率高的特点[1]。VHL综合征相关肾癌的最佳治疗方案是手术治疗,原则是在保证肾功能的前提下,完整、完全的切除肿瘤[2]。但因其有术后较高的复发率的特点,患者可能面临再次手术的可能,这就要求临床中应以最少的手术次数达到最大的治疗效果。本研究结合2例VHL综合征相关肾癌患者的治疗过程,总结VHL综合征相关肾癌的有效治疗方法。
1 资料分析
患者1,男性,54岁,因体检发现双肾囊肿1月入院。既往体健,入院查体未见明显异常。入院后完善血常规、尿常规、大便常规、肝肾功能、电解质、凝血功能等检查均无异常。CT尿路造影(CTU)提示双肾多发强化灶,考虑肿瘤性病变、双肾囊性病变、胰腺多发囊性灶(图1)。中枢神经系统MRI未见明显异常,眼底检查未见明显异常。结合患者家族史,诊断为VHL综合征、双侧肾癌。2018年2月6日行腹腔镜下左肾根治性切除术(radical nephrectomy,RN),术后病理提示透明细胞癌。2018年3月27日行腹腔镜下右肾部分切除术(nephron sparing surgery,NSS),术后病理提示透明细胞癌。术后15个月复查CTU提示右肾下极占位,肿瘤性病变可能(图2)。2019年6月28日行射频消融术(radio frequency ablation,RFA)治疗,术后1个月超声造影提示射频消融区无血供。RFA后一年复查CT提示右肾无新发肿瘤,右肾下极占位较前缩小,增强扫描无明显强化。目前患者仍存活。

注:黑色箭头处为肾肿瘤,白色箭头处为胰腺囊肿。
患者2,男性,28岁,与患者1为父子关系,因发现右肾占位1天入院,既往体健。入院查体未见明显异常,入院后完善血常规、尿常规、大便常规、肝肾功能、电解质、凝血功能等检查均无异常。CTU提示右肾多发囊实性占位、双肾多发囊肿、胰腺多发囊肿、肝囊肿(图3)。中枢神经系统MRI检查未见明显异常,眼底检查未见明显异常。结合患者家族史,诊断为VHL综合征、右侧肾癌。2018年2月8日行腹腔镜下右肾NSS,术后病理提示右肾透明细胞癌。术后10个月复查CTU提示右肾术后改变,未见肿块及异常强化灶、双肾多发囊肿、胰腺多发囊肿、肝囊肿(图4)。目前患者病情稳定,术后2年复查未见肿瘤复发。

注:黑色箭头处为右肾肿瘤,白色箭头为胰腺囊肿。
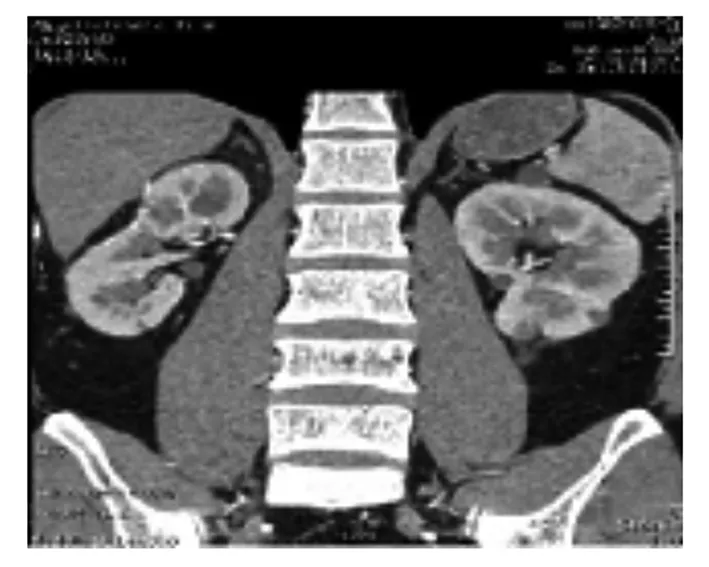
图4 患者2术后10个月CTU检查图像
2 讨论
VHL综合征的诊断包括临床诊断和基因诊断,基因检测是金标准,临床诊断标准包括:(1)没有已知VHL综合征遗传病家族史的患者中需具有以下两个或两个以上的特征性病变:①两个或两个以上的视网膜,脊椎或脑血管母细胞瘤或单一血管母细胞瘤及相关的内脏病变(例如多发肾或胰腺囊肿);②肾细胞癌;③肾上腺或肾上腺外嗜铬细胞瘤;④不常见的病变,如内淋巴囊肿瘤、附睾或阔韧带乳头状囊腺瘤、胰腺的神经内分泌肿瘤。(2)具有VHL综合征阳性家族史的患者中存在一个或一个以上的下列疾病表现:①视网膜血管瘤;②脊髓或小脑血管母细胞瘤;③肾上腺或肾上腺外嗜铬细胞瘤;④肾细胞癌;⑤多发性肾和胰腺囊肿。本研究患者未行基因检测明确是否存在VHL基因的突变,但根据临床诊断标准,具有家族史,同时患有多发肾肿瘤、肾囊肿、胰腺囊肿,可明确VHL综合征的诊断。VHL综合征相关肾癌常为双肾多发,具有发展缓慢、预后较好的特点,但其术后有较高的复发率。基于以上这些特点,VHL综合征相关肾癌处理原则与普通的多发肾癌也有所不同。
目前VHL综合征相关肾癌的最佳选择是手术治疗,原则是在保证肾功能的前提下,完整、完全的切除肿瘤。但因其有术后较高的复发率的特点,患者可能面临再次手术的可能,这就要求临床中应以最少的手术次数达到最大的治疗效果,所以手术时机的选择尤为重要。SCHUHMACHER等[1]对102例肾肿瘤体积<4 cm的VHL综合征患者平均随访52.2个月,未见肿瘤转移的发生。JILG等[2]报道,以4 cm作为手术标准,可将患者的二次手术时间平均推迟27.8个月。故当肿瘤体积较小时,临床上可采取等待观察、物理消融等治疗方案。
VHL综合征相关双肾癌的手术方案包括双侧RN、双侧NSS、一侧RN和一侧NSS,首选NSS。手术是选择一期还是分期进行,目前尚未建立相关标准。LOWRANEE等[3]认为,分期手术方案对肾功能打击较小,因此推荐对双侧肾癌实施分期手术。JACOBS等[4]的研究中,将18例行同期手术与5例行分期手术的双侧肾癌病例进行对比,得出双侧肾癌患者行同期双侧肿瘤的切除是安全可行的,且能获得与分期手术同等的预后。我们认为,双侧NSS宜分期手术,因为此类患者短期内出现肿瘤发展和转移风险较小;一侧RN、另一侧NSS和双侧RN手术,如患者全身情况允许、术者技术熟练的前提下,可选择经腹途径行一期手术。
VHL综合征相关双肾癌分期手术的顺序同样存在争议。需进行双侧NSS治疗的患者,我们认为应先易后难,因选择此种手术方案的患者大多肿瘤较小,肿瘤转移风险较小,在保证患者安全的前提下再行难度较大一侧手术,无法行NSS时可选择RN,并不影响患者预后。需进行一侧RN、另一侧NSS治疗的患者,因考虑到选择RN侧大部分为肿瘤较大、出现转移风险高,而选择NSS侧肿瘤多为分期较早,且VHL综合征相关肾癌具有发展缓慢的特点,故我们建议可先行RN、后行NSS。正是基于以上考虑,本研究中患者1因年龄偏大,我们最终选择先行左侧RN,待患者身体情况恢复后再行右侧NSS。
VHL综合征相关肾癌有术后有较高的复发率的特点。本研究中,患者1在术后15个月时复查发现右肾肿瘤复发,我们选择行B超引导下RFA。RFA在多种肿瘤的运用中已相当普及,在肾癌中主要用于小肾癌、不愿或不能耐受手术的患者。目前有研究[5]认为,RFA与常规外科手术相比,局部复发率更高。虽然如此,对VHL综合征相关肾癌术后复发,特别是解剖性孤立肾患者来说,再次手术风险高,且难以保留足够的肾单位维持患者正常生活,所以消融治疗不失为一种积极、有效的治疗选择。STEINBACH等[6]的研究发现,有23%并发肾癌的VHL综合征患者最终发展成为终末期肾病,需依赖长期透析或肾移植。GOLDFARB等[7]的研究中,将32例行肾移植的VHL综合征患者与普通肾移植患者进行对比,认为免疫抑制剂的应用并不会诱发或加快其它部位的VHL相关肿瘤生长。
随着小分子靶向药物的问世,靶向药物联合减瘤手术对于晚期肾癌的治疗价值凸显。肾癌的靶向药物多种多样,按照靶点数量可分为多靶点药物和单靶点药物。多靶点药物有酪氨酸激酶抑制剂,包括舒尼替尼、索拉非尼、帕唑帕尼、阿西替尼等,这些药物既有抗血管生成的作用,又有直接抑制肿瘤细胞增殖的作用。单靶点药物主要包括贝伐珠单抗、替西罗莫司和依维莫司。贝伐珠单抗主要作用于血管内皮生长因子,而替西罗莫司和依维莫司是mTOR抑制剂。靶向治疗在肾癌中的治疗方案有术前的新辅助治疗和术后的辅助治疗。舒尼替尼、索拉非尼已成为局部进展和远处转移等晚期肾癌的一线治疗,而阿西替尼和依维莫司被推荐为二线治疗。因为肾肿瘤生长速度缓慢,手术延迟对肿瘤学结局产生的负面影响较小,术前的靶向治疗能在较短的治疗周期内取得缩小肿瘤的效果,针对体积较大的VHL综合征相关肾癌,不管是拟行RN或NSS,通过术前新辅助治疗,可以降低肿瘤分期,减少手术难度。大部分已发表的研究[8]均推荐术前新靶向治疗持续时间为60~90 d,术前停药2~3个药物半衰期。靶向药物的应用并不会增加手术的难度和围手术期并发症的发生率,值得注意的是,以程序性死亡受体-1(PD-1)单抗为代表的免疫治疗时代的来临,给肾癌新辅助和辅助治疗带来了新的理念和信号。近年来,肾癌患者应用PD1/PD-L1抑制剂,观察到了25%左右的客观反应率,而且在有客观反应的患者中即使停用PD-1抑制剂,疗效仍能维持下去。已有的几项Ⅱ期临床研究结果表明,血管生成抑制剂联合PD-1治疗晚期肾癌,客观反应率在50%左右,疾病稳定率为33%~55%,结果较好。
综上所述,VHL综合征相关肾癌的外科手术仍是主要治疗方式。NSS通常作为首选术式,同时行双侧手术可能会增加患者发生术后短期肾功能下降和增加术后并发症的风险。在保证完整切除肿瘤、最大限度保留患者肾功能的基础上,双侧分期行NSS后短期肾功能保护效果较好。对于两侧肾癌拟一侧行RN、另一侧行NSS的患者,我们推荐可根据病情行一期或分期手术。对于术前难度大患者可选择新辅助靶向治疗,术后肿瘤复发、肿瘤局部进展或远处转移可选择物理消融疗术、靶向治疗,必要时联合免疫治疗。

