20#碳钢在和Cl-混合溶液中的点蚀行为研究
周天宇,于宇新,赵 博,郭 静
(中国特种设备检测研究院,北京 100029)
0 前言

1 试验方法
1.1 材料制备
试验材料为某公司生产的20#碳钢,试样使用电火花线切割进行加工。其化学成分采用SPECTRO MAXx直读光谱仪实测如表1所示,20#碳钢的化学成分参考标准NB/T 47008—2010《承压设备用碳素钢和合金钢锻件》。
试验材料金相组织采用AXIO Imager A2m金相显微镜观察,如图1所示。金相组织主要由铁素体和珠光体组成,并含有少量的碳化物。根据既往研究,该类碳钢组织常规状态下主要以均匀腐蚀行为为主,但在部分碱性溶液中可能存在钝化行为[14-15]。
1.2 电化学试验

表1 本试验用钢的化学成分 %
图1 20#碳钢金相组织
电化学试验采用0.5 mol/L NaHCO3+0.002 mol/L NaCl溶液对20#碳钢进行点蚀行为研究。电化学试样表面用机械加工打磨光滑,试样用焊锡与铜导线连接,并用环氧树脂封装成电化学测试试样,测试时使用饱和甘汞电极作为参比电极,铂片为辅助电极。
20#碳钢在0.5 mol/L NaHCO3+0.002 mol/L NaCl溶液中得到极化曲线如图2所示,破钝电位为908 mV,维钝电位区间为-148~908 mV。
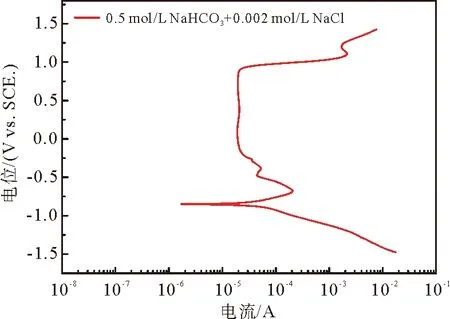
图2 在溶液体系中20#碳钢的极化曲线
电化学试验采取如下两种试验方法测试。
a) 方法一:测试试样在0.5 mol/L NaHCO3+0.002 mol/L NaCl溶液中阴极加载至500 mV(v.s SCE,SCE为饱和甘汞电极的简称,以下均用SCE代替),保持维钝加载状态1 h,再进行动电位极化,设置扫描至电流密度达到1 mA/cm2时分别保持2 min,5 min,10 min,30 min,1 h,4 h,8 h,24 h。
b) 方法二:测试试样在0.5 mol/L NaHCO3+0.002 mol/L NaCl溶液中阴极加载至500 mV(v.s SCE),保持维钝加载状态1 h,然后加载至958 mV(破钝电位上50 mV),分别加载20 min,1 h,4 h,8 h,24 h,48 h,72 h。
1.3 宏微观形貌观察
上述两种方法试验后的电化学试样,取样后洗去腐蚀产物,并对其进行宏微观形貌观察,分析腐蚀形貌及腐蚀机理。宏观观察仪器为Stemi-2000C体式显微镜,微观观察仪器为HIROX KH-8700数字视频显微镜。
2 试验结果
2.1 微观形貌观察结果
2.1.1方法一试验结果
20#碳钢试样通过方法一进行试验,在溶液体系中从维钝状态加载至破钝亚稳态的微观形貌见图3。
通过微观形貌可知方法一试验随着反应时间进行,在30 min后试样表面出现轻微蚀坑。反应始终以点腐蚀趋势进行,在第24 h时,可见最大蚀坑直径约为50 μm。
2.1.2方法二试验结果
通过上述极化曲线确定电化学加载方法为钝化+破钝电位控制试验。20#碳钢在0.5 mol/L NaHCO3+0.002 mol/L NaCl溶液中的形貌见图4所示。图4中(a)~(g)分别为钝化+破钝电位控制加载不同时长的试样微观形貌,图4(h)为钝化+破钝电位控制加载72 h试样宏观形貌。

图3 方法一试验的试样微观形貌

图4 方法二试验试样的形貌图片
通过微观形貌观察可知方法二试样在20 min时即出现腐蚀反应,并且随着反应时间加重。同样反应始终以点腐蚀趋势进行,在第24 h时,可见最大蚀坑直径约为200 μm。反应进行至72 h时,试样出现直径约2 mm的大型点蚀坑,并伴随部分10~100 μm的小型点蚀坑。大型点蚀坑已成为完全的点蚀破坏,小型点蚀坑表面尚能观察到明显的亚稳态蚀坑破坏形态,说明大型蚀坑从小型蚀坑发展而来。
2.2 三维形貌观察结果
对上述钝化+电位控制24 h和72 h试样利用KH-8700数字式显微设备进行三维体式测量,以观察具有代表性的蚀坑形貌。20#碳钢试样在0.5 mol/L NaHCO3+0.002 mol/L NaCl溶液中保持24 h、72 h的蚀坑三维微观形貌如图5、图6所示。

图5 在溶液体系中保持24 h的三维微观形貌

图6 在溶液体系中保持72 h的三维微观形貌
根据标准GB/T 18590—2001《金属和合金的腐蚀点蚀评定方法》测量点蚀坑尺寸,20#碳钢试样在0.5 mol/L NaHCO3+0.002 mol/L NaCl溶液中保持24 h、72 h具有代表性的蚀坑,平均深度分别约为12.47 μm、19.23 μm。可知随着破钝电位加载时间的增加,试样表面的点蚀坑深度逐渐增加。所有点蚀坑均为开放型的蚀坑[16],结合同样的介质,可以认为腐蚀反应机理相同,均为阳极溶解+膜破裂机制造成20#碳钢的点蚀行为,蚀坑按同一形状匀速生长形成。
3 结果讨论

b) 20#碳钢在0.5 mol/L NaHCO3+0.002 mol/L NaCl溶液中进行的钝化+电流控制的试验,处于钝化亚稳态的试样,随时间的增加,点蚀坑的尺寸、深度和数量均不断增加,说明Cl-对20#碳钢表面的钝化膜具有破坏作用。腐蚀反应机理可以用阳极溶解+膜破裂机制来解释。
c) 处于钝态的金属仍有一定的反应能力,即钝化膜的溶解和修复(再钝化)处于动平衡状态。当介质中含有氯离子时,平衡就会受到破坏,溶解占据优势。氯离子有选择性的优先吸附在钝化膜上,把氧原子排挤掉,然后和钝化膜中的阳离子结合成可溶性氯化物[21],造成钝化膜的局部孔洞,在局部钝化膜破坏的同时其余部分的钝化膜保持完好,这使得点蚀的条件得以实现和加强,结果在新露出的基底金属的特定点上生成小蚀坑。小蚀坑内金属表面处于活化态,电位较负;小蚀坑周围完好的钝化膜处于钝化态,电位较正,形成大阴极小阳极的电偶腐蚀,加速阳极溶解,使蚀坑不断增大[22]。同时由于蚀坑内的腐蚀产物在孔口沉积形成闭塞电池,在“自催化酸化作用”下蚀坑不断变深。
4 结论


