氧化苦参碱通过NF-κB信号通路减轻缺氧复氧大鼠心肌细胞损伤
刘婷婷,刘丽,林文果,黄大岗
心肌缺血再灌注损伤是临床上常见的引起心血管系统疾病的重要原因[1]。目前的研究认为,氧化应激、心肌细胞过度凋亡等可能是缺血再灌注损伤发生的机制[2]。缺氧复氧条件下,心肌细胞中积累大量的氧自由基,这些氧自由基可以引起细胞氧化损伤进而诱导细胞凋亡的发生。氧化苦参碱(OMT)具有广泛的药理作用,其主要来源于山豆根、苦参、苦豆子等植物,有明显的抗氧化、抗病毒、杀菌、神经功能保护、抗肿瘤等作用[3]。研究报道表明,氧化苦参碱具有保护心肌损伤的作用[4]。氧化苦参碱治疗后的心肌缺血再灌注大鼠抗氧化酶SOD活性明显升高[5]。氧化苦参碱还可以改善心肌缺血再灌注大鼠心肌脂质过氧化[6]。NF-κB是一个在缺血再灌注损伤中过度激活的信号通路,抑制其激活可以减轻缺血再灌注损伤[7]。研究发现,氧化苦参碱可降低外界有害刺激诱导的正常细胞中NF-κB的激活水平[8]。现阶段对于氧化苦参碱对体外缺氧复氧心肌细胞损伤的影响还不清楚。本研究首先分离培养大鼠心肌细胞,构建缺氧复氧心肌细胞损伤模型,探讨氧化苦参碱对缺氧复氧心肌细胞氧化损伤和细胞凋亡的影响,为氧化苦参碱治疗缺血再灌注心肌损伤的临床应用提供参考。
1 材料与方法
1.1 实验材料 出生3 d以内的大鼠购自郑州大学实验动物中心;剪切的含半胱氨酸的天冬氨酸蛋白水解酶3(C-Caspase-3)抗体购自美国Abcam;乳酸脱氢酶(LDH)含量测定试剂盒购自北京普利莱基因技术有限公司;核因子-κBp65(NF-κBp65)抗体购自武汉艾美捷科技有限公司;丙二醛(MDA)含量测定试剂盒购自青岛捷世康生物科技有限公司;超氧化物歧化酶 (SOD)活性测定试剂盒购自碧云天生物技术研究所;过氧化氢酶(catalase,CAT)活性测定试剂盒购自上海百蕊生物科技有限公司。
1.2 大鼠心肌细胞分离培养 大鼠心肌细胞分离培养方法参照文献[9],取出生3 d以内的大鼠,经过75%的酒精浸泡消毒以后,放在无菌操作台中,开胸,将心包膜剥离,取出心室组织,以在4 ℃环境中预冷后的PBS将组织反复洗涤,剪碎后添加10倍体积的胰蛋白酶(浓度为0.1%),放在37 ℃条件下孵育消化10 min,混合均匀以后,放在室温中静止2 min,将上清溶液弃掉,然后继续添加0.1%的胰蛋白酶消化液,放在37 ℃条件下孵育消化10 min,收集上清溶液,1000 g离心10 min,把上清溶液弃掉,添加10%胎牛血清的DMEM细胞培养液,种植到细胞培养瓶内,培养30 min以后,将细胞上清溶液转移到新的细胞培养板中继续培养。
1.3 缺氧复氧模型构建及处理 缺氧复氧模型构建方法参照文献[10],更换不含血清的细胞培养液,放在37 ℃、95% N2、5%CO2的培养箱中缺氧培养4 h,然后放在37 ℃、95%空气、5%CO2的培养箱中复氧培养16 h,即为缺氧复氧模型。大鼠心肌细胞分成正常对照组(Normal组)、缺氧复氧组(H/R组)、OMT-L组、OMT-M组、OMT-H组。OMT-L组、OMT-M组、OMT-H组细胞分别在缺氧复氧处理前30 min加入氧化苦参碱,氧化苦参碱终浓度为15、30、60 μmol/L。Normal组细胞按照常规条件培养。H/R组在缺氧复氧处理前30 min加入0 μmol/L的氧化苦参碱,给予缺氧复氧处理。Normal组正常培养,不用氧化苦参碱和缺氧复氧处理。
1.4 噻唑蓝(MTT)测定细胞活力 按照Normal、H/R、OMT-L、OMT-M、OMT-H组分组方法将细胞接种到96孔板,复氧处理以后,将细胞培养板取出,然后在每个孔中添加10 μl的MTT溶液,放在37 ℃继续孵育反应4 h。将孔中的液体弃掉,加入150 μl的二甲基亚砜(DMSO)溶液,反应10 min后,用酶标仪测定每个孔的光密度值(OD值),以不含细胞的孔调零。OD值代表细胞增殖活力。
1.5 LDH、MDA、SOD、CAT水平检测 收集Normal、H/R、OMT-L、OMT-M、OMT-H组细胞培养液上清和细胞,分别用试剂盒检测上清中LDH水平以及细胞中MDA、SOD、CAT水平,步骤完全按照LDH水平测定试剂盒、MDA含量测定试剂盒、SOD活性检测试剂盒、CAT活性检测试剂盒说明书进行。
1.6 流式细胞术测定凋亡 收集Normal、H/R、OMT-L、OMT-M、OMT-H组细胞,将细胞悬浮在冰预冷以后的PBS缓冲液中,1000 g离心10 min。在细胞中添加结合缓冲液400 μl,充分混合以后,添加10 μl的碘化丙啶(PI)和5 μl的膜联蛋白 V-FITC(Annexin V-FITC)工作液,放在避光条件下结合20 min。用流式细胞仪检测心肌细胞凋亡变化。
1.7 Western blot检测C-Caspase-3、NFκBp65蛋白表达 收集Normal、H/R、OMT-L、OMT-M、OMT-H组细胞,在细胞中添加磷酸缓冲盐溶液(PBS)缓冲液洗涤3次,然后加入放射免疫沉淀法(RIPA)裂解试剂,吹打混合以后,在4 ℃条件下以12 000 g离心10 min,吸取上清溶液,用二喹啉甲酸(BCA)方法测定蛋白浓度。制备10%的分离胶,在每个孔中添加40 μg的蛋白样品,蛋白在添加到上样孔之前需要与等体积的Loading Buffer混合煮沸5 min。聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳采用100 V恒压,肉眼观察蓝色的染料进入到距离玻璃板的底部边缘约1 cm时终止电泳。取出凝胶,将聚偏二氟乙烯(PVDF)膜裁剪成合适大小,在冰上以200 mA的恒流转膜1 h。取出PVDF膜,放在用TBST配制的5%牛血清白蛋白封闭液中,在摇床上水平晃动孵育1 h。PVDF膜置于用封闭液配制的一抗反应液中,在4 ℃条件下孵育过夜。最后将PVDF膜放在用封闭液按照1:4000稀释的HRP标记的二抗溶液中,在37 ℃孵育1 h。电化学发光(ECL)显色试剂盒显色以后,分析条带的OD值,把甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,分析目的蛋白的表达水平。C-Caspase-3、NF-κBp65一抗按照1:800、1:600稀释。
1.8 NF-κB激活剂对氧化苦参碱影响心肌细胞损伤功能检测 取大鼠心肌细胞,在缺氧复氧前30 min同时添加1 mg/L的NF-κB激活剂脂多糖(LPS)和30 μmol/L的氧化苦参碱,记为OMTM+LPS组。以OMT-M组作为对照,用MTT方法测定细胞增殖(参照1.4),试剂盒测定LDH、MDA、SOD、CAT水平(参照1.5),流式细胞术检测细胞凋亡(参照1.6),Western blot检测细胞中C-Caspase-3、NF-κBp65蛋白表达(参照1.7)。
1.9 统计学分析 数据均用软件SPSS 21.0统计分析,实验数据按照均数±标准差(±s)表示,两组数据间的比较用t检验,多组差异比较用单因素方差,P<0.05为差异有统计学意义。
2 结果
2.1 氧化苦参碱减轻缺氧复氧大鼠心肌细胞损伤 H/R组大鼠心肌细胞活力降低,LDH水平和MDA水平升高,SOD和CAT活性下降,与Normal组比较,差异具有统计学意义(P<0.05);OMT-L、OMT-M、OMT-H组大鼠心肌细胞活力依次升高,LDH水平和MDA水平依次降低,SOD和CAT活性依次升高,与H/R组比较,差异具有统计学意义(P<0.05),氧化苦参碱提高缺氧复氧大鼠心肌细胞活力,减轻大鼠心肌细胞氧化损伤(图1,表1)。
2.2 氧化苦参碱减少缺氧复氧大鼠心肌细胞凋亡H/R组大鼠心肌细胞凋亡率和C-Caspase-3蛋白表达水平升高,与Normal组比较,差异具有统计学意义(P<0.05);OMT-L、OMT-M、OMT-H组大鼠心肌细胞凋亡率和C-Caspase-3蛋白水平依次降低,与H/R组比较,差异具有统计学意义(P<0.05)。氧化苦参碱减少缺氧复氧大鼠心肌细胞凋亡(图1,表2)。
2.3 氧化苦参碱减少缺氧复氧大鼠心肌细胞中NF-κBp65蛋白表达 H/R组大鼠心肌细胞NFκBp65蛋白表达水平升高,与Normal组比较,差异具有统计学意义(P<0.05);OMT-L、OMT-M、OMT-H组大鼠心肌细胞NF-κBp65蛋白水平依次降低,与H/R组比较,差异具有统计学意义(P<0.05),氧化苦参碱减少缺氧复氧大鼠心肌细胞NF-κBp65蛋白表达(图2,表3)。
2.4 NF-κB信号通路激活剂逆转氧化苦参碱抑制缺氧复氧大鼠心肌细胞NF-κBp65蛋白表达的功能 与OMT-M组比较,OMT-M+LPS组大鼠心肌细胞中NF-κBp65蛋白表达水平升高,差异具有统计学意义(P<0.05),NF-κB信号通路激活剂LPS逆转氧化苦参碱抑制氧复氧大鼠心肌细胞NF-κBp65蛋白表达的功能(图3,表4)。
2.5 NF-κB信号通路激活剂逆转氧化苦参碱抑制缺氧复氧大鼠心肌细胞损伤和凋亡功能 与OMT-M组比较,OMT-M+LPS组大鼠心肌细胞活力降低,LDH和MDA水平升高,SOD和CAT活性降低,凋亡率和C-Caspase-3蛋白表达水平升高(P<0.05)。NF-κB信号通路激活剂LPS逆转氧化苦参碱抑制缺氧复氧大鼠心肌细胞损伤和凋亡功能(图4,表5)。
3 讨论
氧化苦参碱含有四环喹嗪啶类结构,其是从豆科槐属中提取出来的生物碱,其有很多生物学作用,对于组织纤维化、脂肪肝、神经损伤等均具有保护作用[3]。研究显示,氧化苦参碱有心血管保护作用,其可以抑制肺动脉平滑肌细胞发生氧化损伤[11]。氧化苦参碱减轻大鼠心肌缺血再灌注氧化损伤[5]。本次实验结果显示,氧化苦参碱可以体外提高缺氧复氧条件下心肌细胞活力,这与之前的研究结果一致,均提示氧化苦参碱可能具有改善缺血再灌注心肌细胞损伤的作用。
缺血再灌注损伤的发生机制复杂,氧化应激诱导的心肌细胞凋亡是目前研究较多的机制之一[12]。缺氧复氧条件下,心肌细胞中的抗氧化酶活性降低,产生的氧自由不能及时降解,从而导致细胞中氧自由基过度积累,这些氧自由基可以刺激细胞中的脂质发生过氧化[13]。MDA大量的氧自由基不仅可以造成细胞氧化损伤,其还可以激活细胞内的Caspase凋亡反应诱导细胞凋亡的发生[17]。Caspase蛋白家族成员多以酶原形式存在于细胞内,其只有被活化剪切后才可以诱导细胞凋亡发生[18]。Caspase-3是Caspase凋亡反应的下游执行因子,其被活化后形成C-Caspase-3是细胞凋亡发生的标志[19]。本次实验结果表明,氧化苦参碱处理后的缺氧复氧心肌细胞LDH水平和MDA水平降低,SOD和CAT活性升高,细胞凋亡率减少,细胞中C-Caspase-3水平降低,提示氧化苦参碱可以减轻缺氧复氧心肌细胞氧化损伤,减少细胞凋亡。
表1 氧化苦参碱处理后的缺氧复氧心肌细胞活力(OD值)和LDH、SOD、MDA、CAT水平(±s)

表1 氧化苦参碱处理后的缺氧复氧心肌细胞活力(OD值)和LDH、SOD、MDA、CAT水平(±s)
注:Normal:正常对照组;H/R:缺氧复氧组;OMT-L:15μmol/L氧化苦参碱处理组;OMT-M:30 μmol/L氧化苦参碱处理;OMT-H:60 μmol/L氧化苦参碱处理组;OD;光密度值;LDH:乳酸脱氢酶;MDA:丙二醛;SOD:超氧化物歧化酶;CAT:过氧化氢酶;与Normal比较,aP<0.05;与H/R比较,bP<0.05;与OMT-L比较,cP<0.05;与OMT-M比较,dP<0.05
?
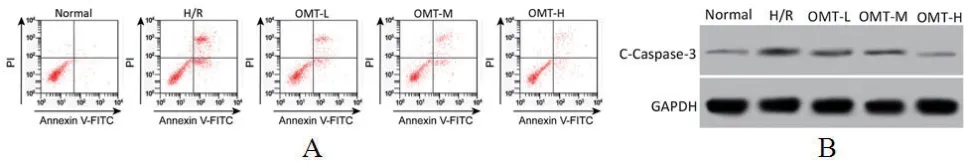
图1 氧化苦参碱对缺氧复氧心肌细胞凋亡影响
表2 氧化苦参碱处理后的缺氧复氧大鼠心肌细胞凋亡率和C-Caspase-3蛋白表达水平(±s)
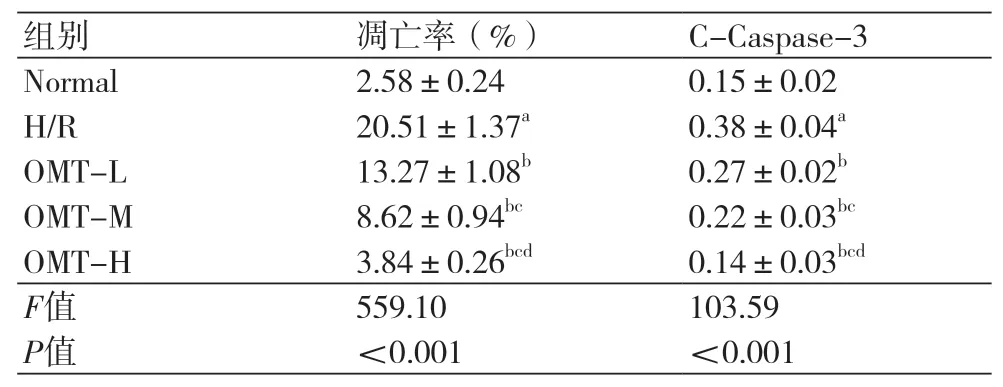
表2 氧化苦参碱处理后的缺氧复氧大鼠心肌细胞凋亡率和C-Caspase-3蛋白表达水平(±s)
注:Normal:正常对照组;H/R:缺氧复氧组;OMT-L:15 μmol/L氧化苦参碱处理组;OMT-M:30 μmol/L氧化苦参碱处理;OMT-H:60 μmol/L氧化苦参碱处理组;与Normal比较,aP<0.05;与H/R比较,bP<0.05;与OMT-L比较,cP<0.05;与OMT-M比较,dP<0.05
?

图2 Western blot检测NF-κBp65蛋白表达
表3 氧化苦参碱处理后的缺氧复氧大鼠心肌细胞NF-κBp65蛋白表达水平(±s)
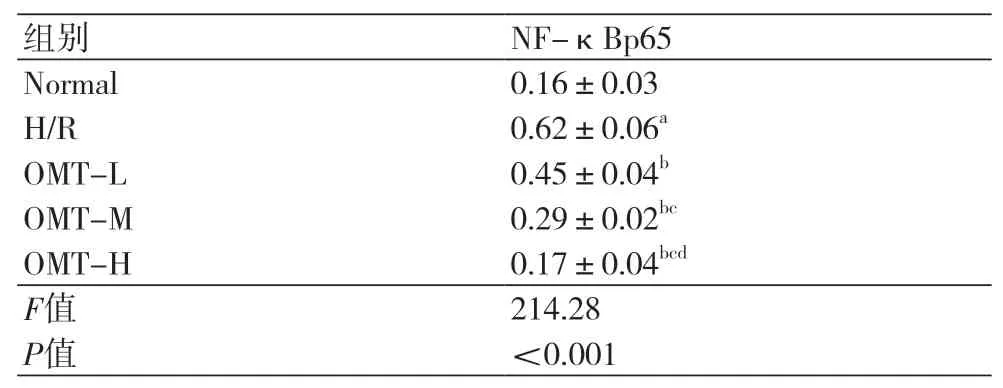
表3 氧化苦参碱处理后的缺氧复氧大鼠心肌细胞NF-κBp65蛋白表达水平(±s)
注:Normal:正常对照组;H/R:缺氧复氧组;OMT-L:15 μmol/L氧化苦参碱处理组;OMT-M:30 μmol/L氧化苦参碱处理;OMT-H:60 μmol/L氧化苦参碱处理组;与Normal比较,aP<0.05;与H/R比较,bP<0.05;与OMT-L比较,cP<0.05;与OMT-M比较,dP<0.05
?

图3 Western blot检测LPS和氧化苦参碱对心肌细胞中NF-κBp65蛋白表达影响
是脂质发生过氧化的产物[14]。脂质是细胞膜的重要组成部分,其发生过氧化后可以诱导细胞膜结构破坏,导致原本存在于细胞内的LDH进入细胞外[15]。SOD和CAT是存在于机体内的抗氧化酶,其活性的高低与细胞内的氧自由基密切相关[16]。
表4 氧化苦参碱和LPS处理后的缺氧复氧大鼠心肌细胞NF-κBp65蛋白表达水平(±s)
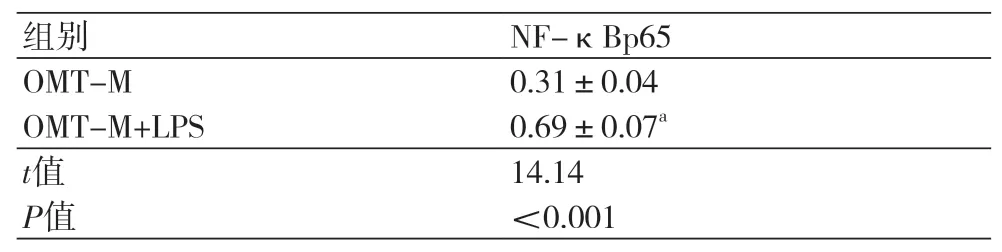
表4 氧化苦参碱和LPS处理后的缺氧复氧大鼠心肌细胞NF-κBp65蛋白表达水平(±s)
注:OMT-M:30 μmol/L氧化苦参碱处理;OMT-M+LPS:在缺氧复氧前30 min同时添加1 mg/L的NF-κB激活剂LPS和30 μmol/L的氧化苦参碱组
?

图4 氧化苦参碱和LPS对缺氧复氧大鼠心肌细胞凋亡和C-Caspase-3蛋白水平影响
表5 氧化苦参碱和LPS处理后的缺氧复氧大鼠心肌细胞活力(OD值)和LDH、SOD、MDA、CAT水平以及凋亡率、C-Caspase-3蛋白水平比较(±s)

表5 氧化苦参碱和LPS处理后的缺氧复氧大鼠心肌细胞活力(OD值)和LDH、SOD、MDA、CAT水平以及凋亡率、C-Caspase-3蛋白水平比较(±s)
注:OMT-M:30 μmol/L氧化苦参碱处理;OMT-M+LPS:在缺氧复氧前30 min同时添加1 mg/L的NF-κB激活剂LPS和30 μmol/L的氧化苦参碱组;OD值:光密度值;LDH:乳酸脱氢酶;SOD:超氧化物歧化酶;MDA:丙二醛;CAT:过氧化氢酶;C-Caspase-3:剪切的含半胱氨酸的天冬氨酸蛋白水解酶3;与OMT-M比较,aP<0.05
?
NF-κB是一个细胞核转录因子,其可同B细胞的免疫球蛋白的κB序列结合,其可调控很多基因的表达,在肿瘤发生、免疫激活、病毒复制等过程中发挥作用[20]。NF-κB家族成员含有多个,在哺乳动物中NF-κB p65是NF-κB行使功能的关键亚单位。NF-κB信号在缺氧复氧心肌细胞中过度活化,抑制其激活可以减轻心肌细胞损伤[21]。氧化苦参碱的作用机制与NF-κB信号通路有关,其可以通过抑制NF-κB信号激活减轻外界有害刺激诱导的正常细胞损伤[8,22]。本次的实验结果表明,氧化苦参碱可以降低缺氧复氧心肌细胞中NF-κB信号通路的激活程度,并且NF-κB信号通路激活剂可以逆转氧化苦参碱对心肌细胞氧化损伤和凋亡的影响,提示氧化苦参碱作用机制与NF-κB信号有关。
综上,氧化苦参碱可以通过下调NF-κB信号通路的激活水平减轻缺氧复氧心肌细胞损伤,减少细胞凋亡。这为研究氧化苦参碱在缺血再灌注心肌损伤中的作用提供了参考,为临床上氧化苦参碱治疗缺血再灌注心肌损伤提供了理论依据。

