多重复合诱变选育金霉素高产菌株
蔡玉凤


摘 要: 为提高金色链霉菌产金霉素水平,增大突变多样性,研究常压室温等离子体(ARTP)、紫外线与氯化锂复合诱变对构建金色链霉菌突变库的影响。结合前体物及高浓度产物耐受性确定筛选模型,通过初筛及摇瓶复筛,选育获得2株菌落形态特性改变、金霉素效价较出发菌株提高20%以上,且其高效价特性稳定的高产金霉素突变菌株。基于多重复合诱变和前体/产物耐受构建了高产菌株选育模型,不仅突变库的多样性更高,而且简便快捷,提高了筛选效率,并减少筛选工作量,对金霉素及其他链霉菌来源抗生素的生产成本降低和产能提高都具有一定的应用价值和指导意义。
关键词: 金霉素;常压室温等离子体诱变;耐受性;复合诱变;筛选
中图分类号: R978文献标志码: A文章编号: 0253-2301(2020)06-0001-06
DOI:10.13651/j.cnki.fjnykj.2020.06.001
Breeding of High-yield Aureomycin Strain by Multiple Complex Mutagenesis
CAI Yu-feng
(Fuzhou Industrial Microorganism Technology Co., Ltd., Fuzhou, Fujian 350007, China)
Abstract:In order to improve the production level of aureomycin by Streptomyces aureus and increase the diversity of mutations, the effects of atmospheric pressure room temperature plasma (ARTP), ultraviolet radiation and lithium chloride mutagenesis on the construction of the mutant library of streptomyces aureus were studied. The screening model was established by overcoming the tolerance of precursors and a high concentration of products. Then, after the primary screening and shake flask re-screening, two mutant strains with high yield of aureomycin and stable high potency were selected, of which the colonial morphological characteristics were changed and the aureomycin potency was increased by more than 20% compared with the original strain. Based on the multiple complex mutagenesis and precursor/product tolerance, the screening model of high-yield strains was established, which not only increased the diversity of the mutant library, but also improved the screening efficiency and reduced the screening workload. It had certain application value and guiding significance for reducing the production cost and increasing the production capacity of aureomycin and other antibiotics from streptomyces.
Key words:Aureomycin; ARTP mutation; Tolerance; Complex mutagenesis; Screening
金霉素chlortetracycline分子式為C 22 H 23 ClN 2O 8,分子量478.88,结构式如图1所示,是由金色链霉菌 Streptomyces aureofaciens 发酵产生的四环素类广谱抗生素。金霉素以其抑菌、促生长、饲料利用率高、在肌体内残留量低的特点以及其生产技术成熟和生产成本低的优点,成为在饲料工业中用量最大的抑菌促生长剂[1] 。金色链霉菌是重要的药用微生物,属于高度好气、革兰氏阳性放线菌。然而,目前金霉素生产菌株产金霉素水平相对较低(金霉素发酵效价常在 18 000 μg·mL-1 左右)[2] ,严重影响了生产效益。
抗生素的高产菌株诱变育种方法包括物理或化学诱变[3] 、原生质体诱变[4-5] 等,程序简单,突变类型丰富,被广泛应用于科研及生产领域高产菌株的选育。但是金色链霉菌经过多次传统诱变,经常出现诱变效率低、负变率高、易回复突变等现象,且反复诱变常产生诱变饱和效应,使产量难以提高。与传统常规诱变方法相比,常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变系统具有操作简便、设备简单、条件温和、安全性高、诱变快速、产生突变的多样性大等特点,已成功应用于细菌、藻类、真菌、放线菌等多种微生物的菌种选育,并筛选到高产突变株[6-10] 。紫外线诱变中加入诱变剂氯化锂可以提高诱变效率,诱变效果更好[11] 。常压室温等离子体、紫外线和氯化锂复合处理金色链霉菌,诱变损伤更多样化,其诱变效应显著,获得比单一诱变更多的突变类型,从而增加诱变库的多样性,大大提高获得高产突变株的概率。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株 金色链霉菌菌株FJ0084(由工业微生物教育部工程研究中心保藏提供)。
1.1.2 培养基 斜面及固体平板培养基:麸皮30g·L-1 ,硫酸镁0.01g·L-1 ,磷酸二氢钾0.01g·L-1 ,磷酸氢二胺0.03g·L-1 ,琼脂20g·L-1 ,pH自然。
种子培养基: 玉米淀粉30g·L-1 ,花生饼粉10g·L-1 ,黄豆饼粉15g·L-1 ,酵母粉5g·L-1 ,硫酸铵4g·L-1 ,碳酸钙4g·L-1 ,氯化钠3g·L-1 ,硫酸镁0.1g·L-1 ,磷酸二氢钾0.1g·L-1 ,豆油0.8g·L-1 ,pH自然,装量为25 mL三角瓶(250 mL)。
发酵培养基: 玉米淀粉80g·L-1 ,花生饼粉30g·L-1 ,玉米粉20g·L-1 ,蛋白胨15g·L-1 ,黄豆饼粉15g·L-1 ,玉米浆8g·L-1 ,酵母粉3g·L-1 ,碳酸钙5g·L-1 ,氯化钠3.4g·L-1 ,硫酸铵4g·L-1 ,硫酸镁0.2g·L-1 ,磷酸二氢钾0.1g·L-1 ,淀粉酶0.02g·L-1 ,豆油25g·L-1 ,pH自然,装量为25 mL三角瓶(250 mL)。
1.1.3 单孢子悬液制备 将培养好的金色链霉菌斜面加入20 mL无菌水,轻轻刮下成熟孢子,倒入带有玻璃珠的100 mL三角瓶中振摇20 min,制备浓度 107~ 108 个·mL-1 单孢子悬液。
1.2 试验方法
1.2.1 金色链霉菌FJ0084的培养方法 斜面活化培养:接种后于34℃培养箱,培养4 d;摇瓶种子培养:培养好的菌株斜面加入5 mL无菌水,刮下成熟孢子,制备得孢子悬液,接种1 mL至25 mL种子培养基中,30℃、270r·min-1 培养22 h;摇瓶发酵培养:以10%的移种量移入发酵培养基中,30℃、270r·min-1 培养6 d。
1.2.2 金霉素耐受性试验 制备不同浓度金霉素耐受性种子培养基,终浓度为0、 2 000 、 3 000 、 4 000 、 5 000 μg·mL-1 ,將金色链霉菌的单孢子菌悬液接种于金霉素耐受性种子培养基,30℃、270r·min-1 培养16 h,然后稀释涂布于平板34℃培养5 d,观察菌落形态并计算菌落数。
1.2.3 NaCl耐受试验 大多数微生物在0.5%~3.0%的盐浓度范围内可正常生长[12] ,为提高金色链霉菌对前体物的耐受性,制备浓度0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%的NaCl平板,将金色链霉菌的单孢子菌悬液稀释涂布于NaCl平板,34℃培养7 d,观察菌落形态并计算菌落数。
1.2.4 ARTP诱变处理 ARTP诱变仪设置:以氦气作为工作载气,设定功率为110 W,工作气量10 SLM。取900 μL单孢子悬液,加入100 μL 50%甘油,充分混匀后吸取10 μL均匀涂在载片上,使孢子悬液均匀覆盖在载片的表面,处理时间梯度设为0、20、40、60、80、100、120 s。处理结束后将载片上的孢子全部洗脱下来,适当梯度稀释后并取100 μL涂布于平板培养基,每组3个平行,
34℃避光培养5 d,通过平板菌落计数,计算致死率,绘制致死率曲线。
1.2.5 紫外线 LiCl复合诱变 取单孢子悬液于无菌培养皿中(每皿加5 mL),在磁力搅拌器搅拌下,置于30 cm处,功率20 W的紫外灯下,照射时间为0、10、20、30、40、50、60 s。适当梯度稀释后涂布至含有1.0% LiCl的分离平板上,每组3个平行,34℃避光培养5 d,通过平板菌落计数,绘制致死率曲线。
1.2.6 ARTP 紫外线 LiCl复合诱变 将单孢子菌悬液进行ARTP诱变处理后再进行紫外线诱变,接种于金霉素耐受性种子培养基,30℃、270r·min-1 培养8 h,进行适当梯度稀释后涂布至含有1.0% LiCl和2.0% NaCl的分离平板上,每组3个平行,34℃避光培养5 d,挑取单菌落,通过摇瓶发酵,计算致死率和突变率。
1.2.7 高产菌的发酵筛选 根据菌落生长的形态、颜色、大小和背部色素,挑取单菌落,按1.2.1方法培养,6 d后按1.3.1方法测定其效价,从初筛高于对照10%以上的突变菌株中进行摇瓶复筛,每批3个平行样,选取摇瓶效价高、发酵稳定的菌株进行保藏传代。
1.2.8 稳定性试验 对诱变复筛后的高产突变株传5代,按1.2.1方法培养发酵,6 d后按1.3.2方法测定其效价,主要考察突变株孢子的外观及发酵水平的稳定性。
1.3 测定方法
1.3.1 化学法测定金霉素效价 化学测定法的原理是根据金霉素在酸性溶液中加热脱去一分子水,生成黄色的脱水金霉素,其比色度与含量成正比,此性质符合比尔定律,因此用比色法来测定金霉素的效价[13] 。取10 g发酵液经草酸酸化过滤后,分别吸取0.1 mL滤液和5 mL 2mol·L-1 盐酸溶液于2个100 mL容量瓶中,一份作为空白对照,另一份于沸水浴中加热5 min,冷却后加蒸馏水定容至刻度,摇匀后于440 nm波长测定吸光值,将吸光值代入公式(1)中计算发酵液效价。
效价(μg·mL-1 )= A-b k × V2 V1 (1)
式中, b 为金霉素工作曲线回归方程中的截距; k 为金霉素工作曲线回归方程中的斜率; A 为测得的吸光值; V 1为吸样体积; V 2为容量瓶体积。
1.3.2 HPLC法测定金霉素效价 参照中国药典2005年版第二部金霉素的高效液相色谱测定法[14] ,色谱柱:C8(75 mm×4.6 mm,3.5 μm),柱温45℃;检测波长为280 nm,流速:0.4mL·min-1 ;流动相∶ 高氯酸∶ 二甲亚砜∶ 水(8∶525∶ 467) 为流动相(pH<2.0);流速为1.0mL·min-1 ;发酵液样品处理参照化学测定法处理,根据估计效价将滤液适当稀释后取10 μL进样测定。
2 结果与分析
2.1 金霉素耐受性选择试验
金霉素作为金色链霉菌的次级代谢产物,产量与其对终产物的耐受性有关,因此取其产物盐(金霉素盐酸盐)为底物,用于高耐受突变株的选育。金色链霉菌在不同浓度的金霉素耐受性培养基上的生长情况如表1所示,随着金霉素浓度的增大,金色链霉菌单菌落数逐渐减少,生长缓慢产孢少;金色链霉菌在对照平板培养基的菌落形态如图2a所示,图2b、2c、2d、2e分别为2 000、3 000、 4 000 、5 000μg·mL-1 金霉素耐受性培养基上金色链霉菌的菌落形态。由于盐酸金霉素的室温溶解度只有 8 600 μg·mL-1 ,只能过滤除菌,且不可高温灭菌,金霉素耐受性培养基终浓度最多增大到 5 000 μg·mL-1 。因此,金霉素耐受性选择培养基耐受浓度设置为 5 000 μg·mL-1 作为后续筛选高产菌株的选择压力浓度。
2.2 NaCl耐受试验
氯离子为金霉素合成的前体物,因此从对氯离子耐受的突变株中获得高产金霉素菌株的可能性更高。金色链霉菌在对照平板培养基的菌落形态如图3a所示,随着氯化钠浓度的增大,金色链霉菌生长缓慢,菌落数减少,产孢少,菌落形态、颜色、大小也明显受浓度影响,金色链霉菌在2.0% NaCl培养基上基本表现为4种菌落形态(图3b、3c、3d、3e),图3b形态菌落较小而突起,黑色,表面光滑;图3c形态菌落黄褐色突起,表面光滑;图3d形态菌落略有皱褶,白色菌丝;图3e形态菌落较小,白色。当氯化钠浓度增加到3.5%时,只有4个透明小菌落,可能是高渗溶液的Na +离子影响了细胞和培养基的渗透压,抑制了菌体生长繁殖。为便于挑选突变菌株,尽可能提高金色链霉菌对前体物 Cl - 离子的耐受性,因此选择NaCl的耐受浓度为2.0%。
2.3 ARTP诱变处理
不同ARTP诱变处理时间对金色链霉菌致死情况如图4所示,诱变40 s时致死率已达79.1%,当诱变时间为120 s时已完全致死。现代育种理论认为,在更高的致死率下,虽然突變率可能较高, 但负突变率也很高,而正突变率却很低,当致死率在70%~80%时,产量性状的正突变率较高[15] 。因此,致死率过高或过低都不利于突变菌株的筛选,为利于突变菌株的进一步筛选,选择诱变时间为 40 s。
2.4 紫外线 LiCl复合诱变处理
从图5可以看出,金色链霉菌对紫外线非常敏感,在紫外线的作用下,照射时间越长,致死率越高,紫外线照射处理20 s,致死率就达到78.6%,而处理50 s,几乎全部致死,为提高获得高产菌株的概率,选择紫外线照射时间为20 s。
2.5 ARTP 紫外线 LiCl复合诱变
将金色链霉菌单孢子菌悬液先通过ARTP诱变处理40 s后,进行紫外线照射20 s,结合前体物及高浓度产物耐受性选育,每组3个平行,ARTP 紫外线 LiCl复合诱变致死率达到91.6%,挑取 2 355 株突变株,通过摇瓶发酵,进行突变率的统计,金色链霉菌菌株正突变率达5.7%。
2.6 高效价菌株的发酵筛选
研究过程中发现菌落生长的形态、颜色、大小及背部色素对金色链霉菌的效价有一定的影响,因此通过前体物、高浓度产物耐受性选育,以及菌落形态的确定,可以建立简便快捷且高效率的高产菌株筛选方法,为突变菌株的初筛提供依据。经发酵复筛,获得2株生长较好且效价高于对照20%以上的突变菌,结果见表2,其中FAL 065变株为浅绿色菌落,孢子较为饱满,背部色素较深(图6b);FAU 083变株为鼠灰色铜钱状菌落,中心有小孔,孢子饱满(图6c)。其中FAL 065变株的菌落颜色与出发菌株差异较大,说明重复合诱变方法确实使金色链霉菌损伤更多样化,遗传信息多样性更好,产生了新的遗传性状,其诱变效应显著,且可以有效地筛选到高产菌株。
2.7 稳定性试验
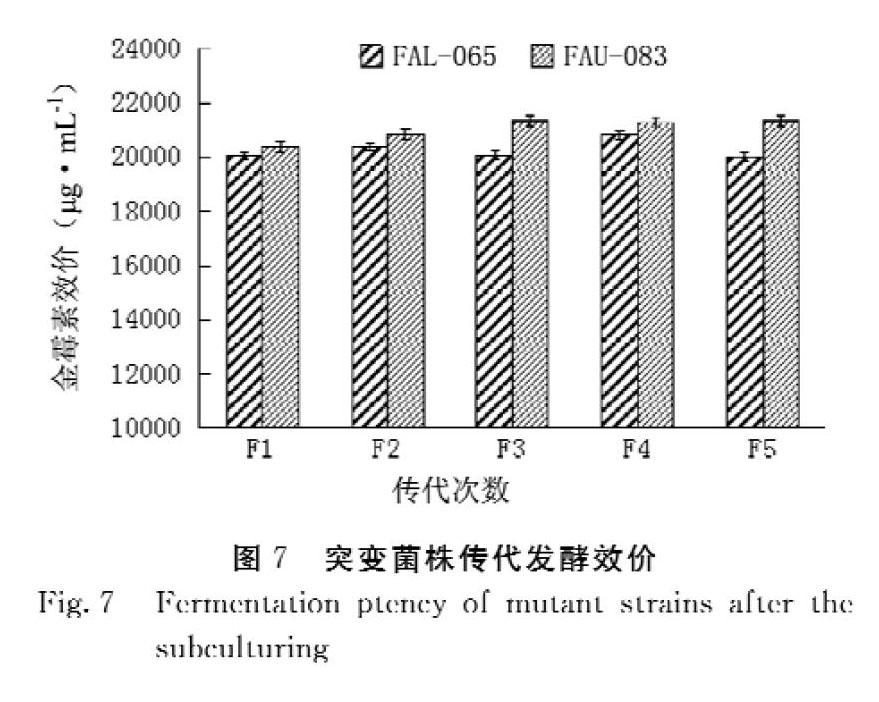
为了确保筛选到的高产突变株具有遗传稳定性,对诱变选育后产量较高的菌株进行传代试验。共传5代,每代做3个平行,结果如图7所示。从第1代到第5代,FAL 065菌株产量平均为 20 274 μg·mL-1 , T 值为 0.236 7 , P > 0.05表示差异性不显著,且突变株孢子外观性状稳定, FAU 083 菌株产量平均为 21 037 μg·mL-1 , T 值为 0.168 8 , P > 0.05表示差异性不显著,说明这两株突变菌株遗传稳定性较好。
3 结论
应用常压室温等离子体(ARTP)、紫外线和氯化锂对金色链霉菌进行复合诱变处理,增大了突变的多样性,结合前体物及高浓度产物耐受性选育,建立了简便快捷且高效率的高产菌株筛选模型,提高筛选效率,减少筛选工作量。最终获得2株金霉素效价较出发菌株提高20%以上、高效价且遗传稳定的菌株FAL 065、FAU 083,其中FAL 065变株为浅绿色菌落,孢子较为饱满,背部色素较深,且性状稳定,产量平均为 20 274 μg·mL-1 ,FAU 083变株为鼠灰色铜钱状菌落,中心有小孔,孢子饱满,产量平均为 21 037 μg·mL-1 。本研究未能解除高渗溶液对菌体生长的影响,可寻找其他带前体物Cl -的盐溶液进行耐受性选育。多重复合诱变方法损伤更多样化,可以有效地筛选到高产菌株且遗传稳定,其诱变效应显著,这不仅对金色链霉菌,对其他产抗生素链霉菌的工业遗传育种也同样具有重要的参考价值。
参考文献:
[ 1] 扶教龙,储炬,张明,等.金霉素发酵条件优化[J].中国医药工业杂志,2002,33(12):583-587.
[ 2]陈梁军.金霉素发酵工艺研究[J].海峡药学,2010,6(22):22-25.
[ 3]王鵬飞,谢昌贤,刘运添,等.氯化锂、紫外线对金色链霉菌( Streptomyces aureofaciens )产金霉素特性的诱变作用[J].微生物学杂志,2013,33(1):86-88.
[ 4]繆克排.金色链霉菌发酵条件优化及高产菌株选育的新方法[D].杭州:浙江大学,2005.
[ 5]贺筱蓉,李永泉,赵小立,等.原生质体诱变选育去甲基金霉素高产菌[J].杭州大学学报(自然科学版),1997,24(2):170-177.
[ 6]杨立鹏,李小刚,魏爱英,等.基于常压室温等离子体诱变技术选育高产色氨酸突变株的研究[J].发酵科技通讯,2015,44(1):28-32.
[ 7]FANG M,JIN L,ZHANG C,et al.Rapid Mutation of Spirulina platensis by a New Mutagenesis System of Atmospheric and Room Temperature Plasmas (ARTP) and Generation of a Mutant Library with Diverse Phenotypes [J]. PLOS ONE ,2013, 8(10):1-12.
[ 8]祝金山,吴烨飞,陆建卫.常压室温等离子体诱变选育核黄素高产突变株[J].发酵科技通讯,2020, 49(1): 58-62.
[ 9]袁红梅,薛正莲,杨心萍.常压室温等离子体和紫外诱变选育腺苷高产菌株[J].发酵科技通讯,2019,48(2):100-105.
[10]田淑翠,牛延宁,常忠义,等.常压室温等离子体(ARTP)诱变茂源链霉菌菌株[J].中国生物工程杂志,2016,36(9):47-53.
[11]徐亲民.抗生素工艺学[M].北京:中国建材工业出版社,1994:8.
[12]施巧琴,吴松刚.工业微生物育种学[M].北京:科学出版社, 2003.
[13]王鹏飞.金霉素生产菌种的选育及发酵工艺优化研究[D].呼和浩特:内蒙古大学,2013.
[14]国家药典委员会.中华人民共和国药典 [M] .二部.北京:化学工业出版社,2005:539.
[15]卜美玲.纳他霉素高产菌株的诱变选育及发酵工艺的优化[D].洛阳:河南科技大学,2012,37(4):81-86.
(责任编辑:柯文辉)

