沉淀溶解平衡考点探析
◇ 江苏 田玉宝
难溶电解质的沉淀溶解平衡是高中教材《化学反应原理》专题3“溶液中的离子平衡”中的内容,是高考的常考考点.高考复习中,通过题型分类、方法提炼,可以提高复习的针对性和有效性.本文就“沉淀溶解平衡”考点进行分类探析.
1 运用溶度积常数(K)判断沉淀的产生或转化
【考点分析】溶度积常数(K)的大小反映了难溶电解质在水中溶解能力的强弱,对于同种类型的难溶电解质,K越小,其溶解能力越弱,越易转化为沉淀.
例1(改编题)下列叙述错误的是( ).
A.(2020年全国卷Ⅱ)二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如图1所示.海水酸化能促进CaCO3的溶解,导致珊瑚礁减少

图1
C.(2020年山东卷)以菱镁矿(主要成分为MgCO3,含少量SiO2、Fe2O3和A12O3)为原料制备高纯镁砂的工艺流程如图2所示.
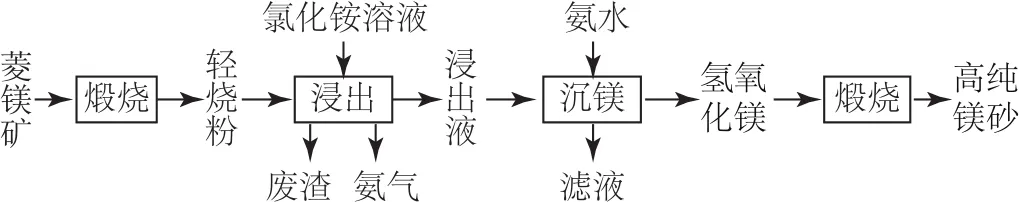
图2
已知浸出时产生的废渣中有SiO2、Fe(OH)3和Al(OH)3.分离 Mg2+与 Al3+、Fe3+是利用了它们氢氧化物的Ksp不同
D.(2020年天津卷)FeS溶于稀硫酸,而CuS不溶于稀硫酸,则Ksp(FeS)<Ksp(CuS)
海水酸化,CO2-3浓度减小,导致CaCO3溶解平衡正向移动,促进了CaCO3溶解,导致珊瑚礁减少,选项A正确;硫酸钙的溶解度大于碳酸钙的溶解度,溶解度大的物质能向溶解度小的物质转化,所以锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,沉淀转换的实质就是沉淀溶解平衡的移动,平衡一般向生成更难溶物质的方向移动,则离子反应为

选项B正确;Fe(OH)3、Al(OH)3的Ksp远小于Mg(OH)2的Ksp,所以当pH达到一定值时Fe3+、Al3+产生沉淀,而 Mg2+不沉淀,从而将其分离,选项C正确;CuS的溶解度较小,将CuS投入到稀硫酸溶液中,CuS溶解平衡电离出的S2-不足以与H+发生反应,而将FeS投入到稀硫酸中可以得到H2S气体,说明Ksp(FeS)>Ksp(CuS),选项D错误.答案为D.
解析
点评
沉淀的生成、溶解和转化都遵守溶度积规则:
1)在溶液中,有关离子能否生成沉淀析出,可通过相应离子的实际浓度积Qc与其溶度积常数Ksp的比较来作出判断.
当Qc<Ksp时,溶液对于相关离子而言是未饱和的,则没有沉淀生成;
当Qc=Ksp时,溶液对于有关离子而言是刚好饱和的,则溶液处于多相离子平衡;
当Qc>Ksp时,溶液对于有关离子而言是过饱和的,则有沉淀生成.
2)沉淀的转化也可以用溶度积规则来判断.当化学反应中有多种沉淀生成时,溶度积常数小的同类型沉淀优先生成.
2 有关溶度积常数(K)的计算
【考点分析】有关难溶电解质沉淀、溶解的计算,主要是计算离子浓度或溶液的pH.首先要理解难溶电解质沉淀溶解平衡、溶度积表达式的含义,利用表达式进行解题.
例2(2020年全国卷Ⅲ,节选)某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质.采用如图3所示工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O).
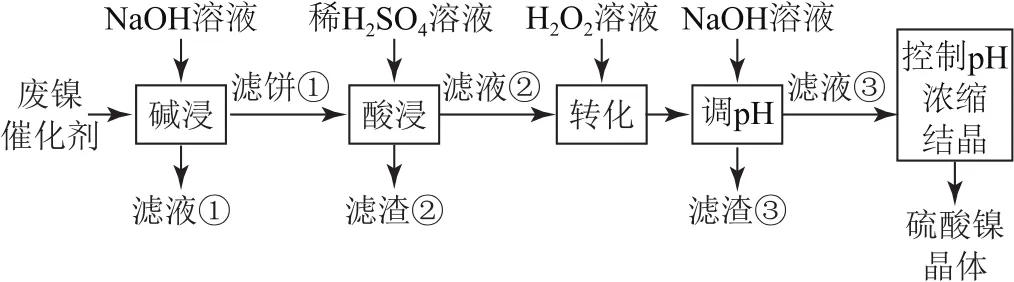
图3
溶液中金属离子开始沉淀和完全沉淀的pH如表1所示.

表1
利用上述表格数据,计算Ni(OH)2的Ksp=________(列出计算式).如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,则“调pH”应控制的pH范围是____.
解析
由上述表格可知,Ni2+完全沉淀时的pH=8.7,此时


或者当Ni2+开始沉淀时pH=7.2,此时

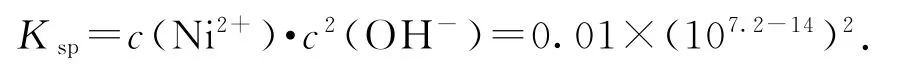
如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,为避免 Ni2+沉淀,此时

点评
Ksp的计算及“调pH”时pH范围的确定是溶度积常数计算的难点,计算复杂,要求考生细心认真解题,才能得出正确答案.
3 沉淀溶解平衡的图象问题
【考点分析】高考主要考查学生对数据、图形等进行观察,并运用分析、比较、推理等方法对获取的信息进行初步加工和应用的能力,沉淀溶解平衡的图象是其中一个考点.
例3(2019年全国卷Ⅱ)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌.硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图4所示.下列说法错误的是( ).
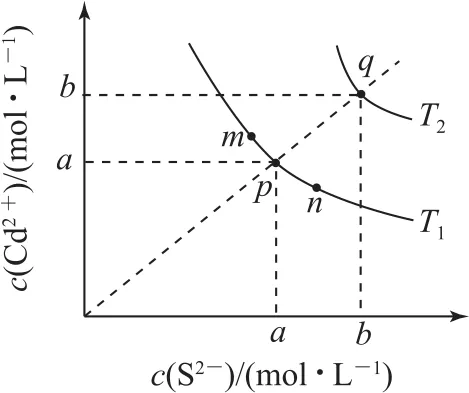
图4
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为

C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
解析
CdS在水中存在沉淀溶解平衡:

其溶度积Ksp=c(Cd2+)·c(S2-),在饱和溶液中,c(Cd2+)=c(S2-),结合图象可以看出,图中a和b分别表示T1和T2温度下CdS的溶解度,选项A正确;CdS的沉淀溶解平衡中的溶度积受温度影响,m、n和p点均对应温度T1条件下所测的离子浓度,则其溶度积相同,选项B错误;m点达到沉淀溶解平衡,向其中加入Na2S后,平衡向逆反应方向移动,c(Cd2+)减小,c(S2-)增大,溶液组成由m沿mpn向p方向移动,选项C正确;从图象中可以看出,随着温度的升高,离子浓度增大,说明CdS(s)⇌Cd2+(aq)+S2-(aq)为吸热反应,则温度降低时,q点对应饱和溶液的溶解度下降,溶液中的c(Cd2+)与c(S2-)同时减小,会沿qp线向p点方向移动,选项D正确.答案为B.
点评
沉淀溶解平衡的图象题陌生度大,解题关键是仔细审题,获取相关信息,抓住图象中横、纵坐标表示的意义进行分析、推理,问题就会迎刃而解.

