lncRNA-CCAT2 对宫颈癌CaSki 细胞凋亡的影响及其机制
王 霞, 姚玉君, 汤 静, 李开慧
(湖北省鄂州市中医医院妇产科,湖北 鄂州 436006)
宫颈癌是一种常见的妇科癌症,是世界范围内女性癌症相关死亡的主要原因之一[1-2]。2018 年,全球约有57 万宫颈癌新增病例,约31.1 万宫颈癌患者死亡,大部分发生在中低收入国家[3]。宫颈癌严重危害女性健康,但目前临床常规治疗方法的效果并不理想,因此急需探索有效治疗的新策略。研究[4]显 示: 包 括 结 肠 癌 相 关 转 录 本2 (colon cancer-associated transcript 2, CCAT2) 在内的约14 种 长 链 非 编 码RNA (long non-coding RNA,lncRNA) 通过调控相关信号通路在宫颈癌的诊断和治疗中发挥关键性作用。CCAT2 在宫颈癌中异常高表达, 促进肿瘤细胞增殖、 迁移和抑制凋亡[5-6],但其具体作用机制尚不明确。人类第十号染色体缺失的磷酸酶与张力蛋白同源基因(phosphatase and tensin in homolog deleted on chtomosome ten,PTEN) 可调节肿瘤细胞的生长与增殖, 在宫颈癌的发生发展中起重要作用[7]。PTEN 主要通过抵消磷脂酰肌醇 3- 激酶(phosphoinositide 3-kinase, PI3K) 活 性, 抑 制PI3K/蛋白激酶B (protein kinase B, AKT) 信号传导,从而影响细胞的增殖和凋亡[8]。因此本文作者推测: CCAT2 与PTEN 之间可能存在调控关系,进而在宫颈癌细胞增殖和凋亡过程中发挥作用,但有关CCAT2 和PTEN 在宫颈癌中关系的研究少见报道。本研究改变宫颈癌细胞中CCAT2 的表达水平,观察细胞增殖及凋亡的变化,并检测PTEN/PI3K/AKT 通路表达情况, 旨在阐述CCAT2 对宫颈癌作用的可能机制。
1 材料与方法
1.1细胞、主要试剂和仪器人宫颈癌CaSki 细胞购自中国科学院上海细胞库。RPMI-1640 培养基购自 美 国Hyclone 公 司, 载 体pSICOR、 pCDHCMV-MCS-EF1-CopGFP-T2A-Puro 购 自 美 国Addgene 公 司, LipofectamineTM2000 购 自 美 国Invitrogen 公 司,TRIzol 购 自 美 国Ambion 公 司,逆转录试剂盒购自大连TaKaRa 公司,SYBR Green PCR 试 剂 盒 购 自 美 国KAPA Biosystems 公 司, 兔抗B 淋巴细胞瘤2 (B-cell lymphoma-2,Bcl-2)、兔抗Bcl-2 相 关X 蛋 白(Bcl-2 associated X protein,Bax)、兔抗PTEN、兔抗磷酸化PI3K (p-PI3K)、兔抗PI3K、 兔抗p-AKT 和兔抗AKT 抗体购自武汉贝茵莱生物科技有限公司,凋亡检测试剂盒购自美国BD 公司,PVDF 膜和化学发光试剂购自美国Millipore 公司,CCAT2 过表达及干扰载体由武汉华联科生物技术有限公司构建。倒置显微镜购自德国Leica 公司,荧光定量PCR 仪、电泳仪和凝胶成像系统购自美国Bio-Rad 公司,酶标仪购自杭州奥盛仪器有限公司,流式细胞仪购自艾森生物(杭州) 有限公司。
1.2细胞培养和分组将宫颈癌CaSki 细胞从液氮罐中取出,进行复苏处理后,转移至离心管中,1 000 r·min-1离心3 min,加入1 mL 含10% 胎牛血清的RPMI-1640 培养基悬浮细胞,并转移至培养瓶中,再加入4 mL 含10% 胎牛血清的培养基,将培养瓶置于37 ℃、5%CO2培养箱中。将CaSki 细胞分为对照组、 CCAT2 过表达组、 CCAT2 干扰组、过表达NC 组和干扰NC 组。CCAT 过表达组和CCAT2 干扰组宫颈癌细胞分别转染CCAT2 过表达及干扰载体。
1.3 CCAT2过表达及干扰载体的构建以及各组CaSki细胞中CCAT2 mRNA表达水平TRIzol 法提取细胞总RNA,采用反转录试剂盒将RNA 反转录为cDNA, 进行PCR 扩增获取目的基因片段,PCR 引物序列为CCAT2-F:GCTCTAGACCGAGGTGATCAGGTGGA;CCAT2-R:CGGGATCCGTCTTCTGGGCTGATGTT。 设 计 合 成CCAT2 干扰靶序列(GCTACCAGCAGCACCATTTCA),获取干扰基因片段。载体进行线性化处理后,与目的基因重组,筛选阳性表达重组质粒, 提取质粒DNA, 采用LipofectamineTM2000 转染试剂转入细胞。转染24 h 后,qRT-PCR 法检测转染效率。引物序列:CCAT2-F,CAAGAGGGAGGTATCAACA;CCAT2-R,GCAATAAGAGCAGGAAAAGA;GAPDH-F,CCACTCCTCCACCTTTG;GAPDH-R,CACCACCCTGTTGCTGT。 以GAPDH 为 内 参, 采 用2-ΔΔCt法 计 算细胞中CCAT2 mRNA 表达水平。
1.4 MTT法检测各组CaSki细胞增殖率取对数生长期细胞, 调整细胞密度后, 置于96 孔板中,每孔约5×103个细胞, 每孔180 μL, 每组设3 复孔,培养过夜,待细胞贴壁。分组处理细胞,继续培养24 h,每孔加入20 μL MTT 溶液(5 g·L-1),培养4 h 后弃上清,每孔加入150 μL 二甲基亚砜溶解液, 摇床低速振荡10 min, 酶标仪测量各孔490 nm 处的吸光度(A) 值,计算细胞增殖率。细胞增殖率= (实验组A 值/对照组A 值) ×100%。
1.5流式细胞术检测各组CaSki细胞凋亡率各组细胞经消化后,收集于离心管中,1 000 r·min-1离心5 min,弃上清,加入PBS 重悬细胞并计数。取1×105个 细 胞, 1 000 r·min-1离 心5 min, 弃 上清,重复3 次。加入200 μL Binding buffer 重悬细胞沉 淀,再 加 入10 μL Annexin V-FITC 和10 μL PI,混 匀 后, 避 光 孵 育30 min。 加 入300 μL Binding buffer,进行流式细胞术检测。细胞凋亡率=(早期凋亡细胞数+晚期凋亡细胞数)/总细胞数×100%。
1.6 qRT-PCR法检测各组CaSki细胞中PTEN mRNA表达水平TRIzol 法提取细胞RNA,反转录合成cDNA,进行PCR 扩增,反应条件:95 ℃变性5 s,56 ℃退火10 s,72℃延伸25 s,共39 个循环。引物序列:PTEN-F,5′-CTGGAAAGGGACGAAC-3′;PTEN-R,5′-GCCTCTGACTGGGAAT-3′;GAPDH-F,5′-CCACTCCTCCACCTTTG-3′;GAPDH-R,5′-CACCACCCTGTTGCTGT-3′。以GAPDH 为内参,采用2-ΔΔCt法计算各组CaSki 细胞中PTEN mRNA 表达水平。
1.7 Western blotting法检测各组CaSki细胞中Bax、Bcl-2、PTEN、p-PI3K和p-AKT蛋白表达水平取出各组细胞,加入裂解液提取细胞总蛋白并进行定量,以20 μg 蛋白上样量进行SDS-PAGE 电泳。将蛋白转移至PVDF 膜上,5% 脱脂奶粉4℃封闭过夜,加入一抗稀释液(1∶1 000),37℃孵育1 h。PBST 洗涤3 次,加入二抗稀释液,37℃孵育1 h。PBST 洗涤3 次,加入发光试剂,于全自动化学发光分析仪中检测, 读取条带灰度值。 以GAPDH 为内参,Bax、Bcl-2 或PTEN 蛋白相对表达 水 平=Bax、 Bcl-2 或PTEN 条 带 灰 度 值/GAPDH 条带灰度值;p-PI3K 或p-AKT 蛋白相对表达水平=p-PI3K 或p-AKT 蛋白条带灰度值/PI3K 或AKT 蛋白条带灰度值。
1.8统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组宫颈癌CaSki 细胞中CCAT2 和PTEN mRNA 表达水平, Bax、 Bcl-2、 p-PI3K 和p-AKT 蛋白表达水平以及细胞增殖率和凋亡率均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析(One-way ANOVA),组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1各组宫颈癌CaSki细胞中CCAT2 mRNA表达水平与对照组比较,CCAT2 干扰组CaSki 细胞中CCAT2 mRNA 表达水平明显降低(P<0.05), CCAT2 过 表 达 组 宫 颈 癌CaSki 细 胞 中CCAT2 mRNA 表达水平明显升高(P<0.05),而CCAT2 干扰组和过表达NC 组宫颈癌CaSki 细胞中CCAT2 mRNA 水平无明显变化(P>0.05),提示本研究转染实验成功。见图1。
2.2各组宫颈癌CaSki细胞增殖率与对照组比较,CCAT2 干扰组宫颈癌CaSki 细胞增殖率明显降 低(P<0.05), 而CCAT2 过 表 达 组 宫 颈 癌CaSki 细胞增殖率明显升高(P<0.05)。见图2。
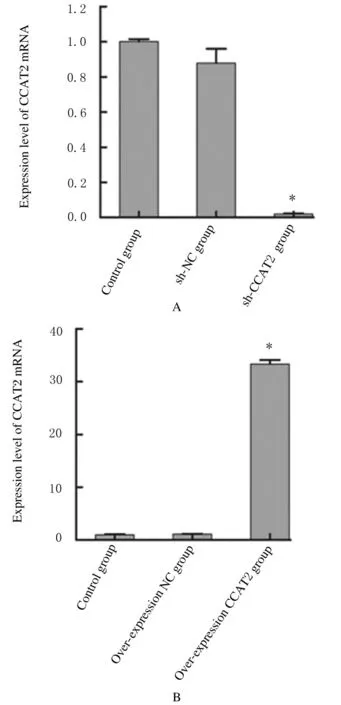
图1 各组宫颈癌CaSki 细胞中CCAT2 mRNA 表达水平Fig.1 Expression levels of CCAT2 mRNA in cervical cancer CaSki cells in various groups
2.3各组宫颈癌CaSki细胞凋亡率与对照组比较,CCAT2 干扰组宫颈癌CaSki 细胞凋亡率明显升高(P<0.05), CCAT2 过表达组宫颈癌CaSki细胞凋亡率明显降低(P<0.05)。见图3 和图4。
2.4各组宫颈癌CaSki细胞中PTEN mRNA表达水平与对照组比较, CCAT2 干扰组宫颈癌CaSki 细胞中PTEN mRNA 表达水平明显升高(P<0.05), CCAT2 过 表 达 组CaSki 细 胞 中PTEN mRNA 表 达 水 平 明 显 降 低(P<0.05)。见图5。
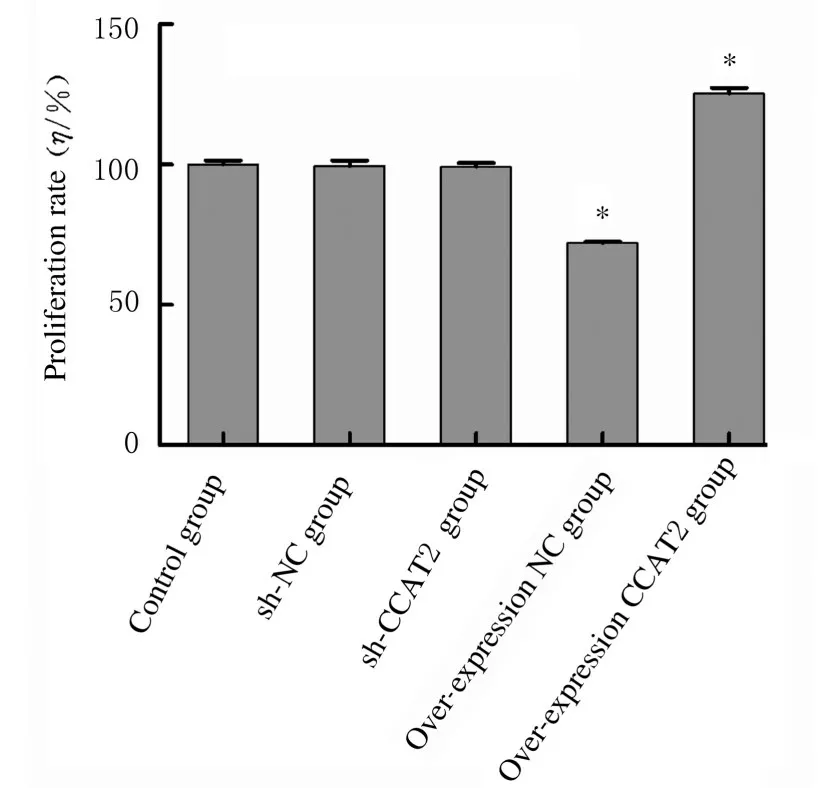
图2 各组宫颈癌CaSki 细胞增殖率Fig.2 Proliferation rates of cervical cancer CaSki cells in various groups
2.5各组宫颈癌CaSki细胞中凋亡相关蛋白及其信号通路蛋白表达水平与对照组比较,CCAT2干扰组宫颈癌CaSki 细胞中Bax 和PTEN 蛋白表达水平明显升高(P<0.05 ), Bcl-2 、 p-PI3K 及p-AKT 蛋白表达水平明显降 低(P<0.05), 而CCAT2 过表达组CaSki 细胞中各蛋白表达趋势与之相反, Bax 及PTEN 蛋白表达水平明显降低(P<0.05), Bcl-2、 p-PI3K 及p-AKT 表达水平明显升高(P<0.05)。见图6。
3 讨 论
lncRNAs 可通过介导基因的表达,在转录调控和蛋白复合物的形成及蛋白修饰等多种过程中发挥作 用[9]。 CCAT2 是 一 种 潜 在 的 新 型 癌 症 标 记物[10-12], 研 究[13]显 示: CCAT2 在 宫 颈 鳞 癌 组 织中高表达,其高表达水平与宫颈磷癌患者的不良预后有关,推测CCAT2 可能是宫颈磷癌的潜在治疗靶 点 和 新 的 预 后 标 志 物。 研 究[6]显 示: 敲 除CCAT2 后,宫颈癌细胞发生G1期阻滞,诱导细胞凋亡。本研究结果与上述研究结果一致,CCAT2过表达可促进宫颈癌细胞增殖,抑制细胞凋亡,而抑制宫颈癌细胞中CCAT2 表达后,Caski 细胞增殖受到抑制, 细胞凋亡率升高, 提示lncRNACCAT2 对宫颈癌的发生发展起促进作用。

图3 流式细胞术检测各组CaSki 细胞凋亡率Fig.3 Apoptotic rates of cervical cancer CaSki cells in various groups detected by flow cytometry

图4 各组宫颈癌CaSki 细胞凋亡率Fig.4 Apoptotic rates of cervical cancer CaSki cells in various groups
PTEN 是一种重要的肿瘤抑制基因,可通过抑制PI3K/AKT/mTOR 抗凋亡途径遏制肿瘤的恶性发展,这一直是肿瘤临床研究的热点[14]。在宫颈癌组织中PTEN 表达水平明显低于宫颈上皮内瘤变和正常上皮组织中的水平,低PTEN 表达是肿瘤不良预后和生存的潜在标记物[15]。促进PTEN 表达可抑制宫颈癌细胞的增殖和上皮-间质转化,诱导宫颈癌细胞凋亡[16]。PI3K/AKT 通路在人类癌症中经常被异常激活,可通过整合来自外部细胞刺激的信号通路来调节基本的细胞功能,对肿瘤的发生发展产生促进作用[17]。PI3K/AKT 信号通路在宫颈癌细胞中经常失调,提示其可能是治疗宫颈癌的潜在靶点,并可能作为一种新的评估宫颈癌风险的生 物 标 记 物[18]。 研 究[19]显 示: 下 调PI3K/AKT可降低宫颈癌细胞活力,诱导细胞凋亡。本研究结果显示: CCAT2 表达干扰后, 宫颈癌细胞中PTEN mRNA 和蛋白表达水平升高,而p-PI3K 和p-AKT 蛋白表达水平降低,反之,CCAT2 过表达后,PTEN 蛋白表达水平降低,p-PI3K 和p-AKT蛋白表达水平升高,提示CCAT2 可抑制PTEN 表达,减少了PTEN 对PI3K/AKT 通路的抑制,从而使PI3K/AKT 通路水平异常升高,发挥其促增殖和抗凋亡作用,从分子水平解释了CCAT2 过表达后宫颈癌细胞增殖能力增强和凋亡率降低的生物学特性。

图5 各组宫颈癌CaSki 细胞中PTEN mRNA 表达水平Fig.5 Expression levels of PTEN mRNA in cervical cancer CaSki cells in various groups
PI3K/AKT 通路激活后,引发信号转导通路的级联反应, 如调节Bcl-2 家族成员的活性, 其中Bcl-2 为AKT 的底物之一[20]。PI3K/AKT/Bcl-2 是一条重要的生存信号通路,调节细胞增殖、存活及凋亡等生物学过程[21]。Bcl-2 家族成员在细胞凋亡的内源性信号通路中发挥关键性作用,当抗凋亡因子Bcl-2 水平下调、 促凋亡因子Bax 水平上调时,线粒体通透性增加,线粒体细胞色素c 被释放,触发caspase 依 赖 性 的 凋 亡 途 径[22]。 使 用Bcl-2 选 择性抑制剂可抑制宫颈癌细胞的增殖与侵袭,是治疗宫颈癌的潜在策略之一[23]。 本研究结果显示:CCAT2 表达干扰后,宫颈癌细胞中Bax 蛋白表达水平升高,Bcl-2 蛋白表达水平降低,CCAT2 过表达后Bax 蛋白表达水平降低,Bcl-2 蛋白表达水平升高,该结果进一步解释了过表达CCAT2 在宫颈癌细胞中抑制细胞凋亡的作用。

图6 各组宫颈癌CaSki 细胞中Bax、Bcl-2、PTEN、p-PI3K 和p-AKT 蛋白表达水平Fig.6 Expression levels of Bax, Bcl-2, PTEN, p-PI3K, and p-Akt proteins in cervical cancer CaSki cells in various groups
综上所述,CCAT2 表达上调可促进宫颈癌细胞的增殖,降低细胞凋亡率,其作用机制可能与调控PTEN/PI3K/AKT 通路和Bcl-2/Bax 表达有关联。

