苦菜、茵陈内生真菌的分离鉴定与生物活性
王盈桐 李学威 陆云彪

摘要:植物内生菌是尚未得到充分开发利用的微生物资源。为了充分开发苦菜、茵陈这2种菊科植物的内生菌资源,获得具有抗菌、抗氧化活性的内生菌,采用组织分离法从茵陈、苦菜中分离内生真菌,并使用平板对峙法对内生真菌进行抗菌活性验证,并测定内生真菌提取物1,1-二苯基-2-三硝基苯肼自由基(DPPH·)清除率,以验证内生真菌的抗氧化活性。此外,对于具有抗菌和抗氧化活性的菌株,通过内转录间隔区(ITS)测序并构建系统发育树、形态学观察进行鉴定。结果表明,分离自苦菜的KC-G-2-3-2和分离自茵陈的YC-J-4-2对串珠镰刀菌、尖孢镰刀菌、层生镰刀菌均具有拮抗作用,抑菌率在50%以上,其中KC-G-2-3-2对白绢病病菌也有较强的抑制作用;2株内生真菌菌液和菌体提取物都表现出较好的DPPH·清除功效,其中YC-J-4-2的PDB培养基发酵液的菌液提取物对DPPH·的清除率超过90%。由菌株鉴定结果看出,KC-G-2-3-2为木霉属菌株,YC-J-4-2为间座壳属菌株。
关键词:苦菜;茵陈;内生真菌;抗菌活性;抗氧化活性
中图分类号:S182 文献标志码: A 文章编号:1002-1302(2020)20-0265-05
内生菌(endophytes)是一类非常重要的微生物资源,在自然界中广泛存在,它们具有独特的生理和代谢机制,能够适应植物内部特殊的环境,同时还能够产生多种活性物质,帮助植物抵抗病原微生物[1-2]。此外,一些药用植物内生菌因长时间与宿主协同进化,可产生某些与宿主植物相似或相同的具有药用价值的代谢物质[3-6]。因此,从植物内生菌中,特别是药用植物内生菌中挖掘活性天然产物,不仅可为药物的研发提供新的方向,还能在一定程度上解决传统的天然产物药源——药用植物生长缓慢、资源紧缺等问题。
苦菜(Sonchus oleraceus)和茵陈(Artemisiae scopariae)广泛分布于全国各地,是药食两用的菊科植物。近年来,学者们对这2种植物的活性成分研究也较为深入,已经证实它们均具有抗菌、抗氧化活性[7-8]。苦菜中的抗氧化活性成分主要包括黄酮[9-10]、多酚[11]和多糖[12],其提取物对革兰氏阳性菌、革兰氏阴性菌、酵母菌和霉菌都具有较好的抑制作用[13-14]。茵陈的抗氧化活性成分主要为香豆素类化合物[15]、黄酮类化合物[16-17]、绿原酸[18]及挥发油类化合物[19],其中绿原酸对多种细菌、霉菌具有抑制作用[20]。目前,针对苦菜、茵陈植物内生菌的研究鲜有报道,本研究从苦菜、茵陈中分离获得内生真菌,测定其抗菌、抗氧化活性,并对有活性的菌株进行鉴定,旨在为进一步开发利用植物内生菌资源提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 新鲜、健康的茵陈和苦菜于2018年10月初采集自山东泰山。
1.1.2 供试菌株 供试菌株有串珠镰刀菌(Fusarium moniliforme)、尖孢镰刀菌(Fusarium oxysporum)、白绢病病菌(Selerotium rolfsii)、层生镰刀菌(Fusarium proliferatum)等植物病原真菌,由山东农业大学农业微生物重点实验室惠赠。
1.1.3 培养基 内生菌分离纯化培养基包括马铃薯葡萄糖琼脂(PDA)培养基和麦芽汁(ME)培养基。PDA配方:200 g马铃薯,20 g葡萄糖,琼脂 20 g,1 L去离子水,pH值自然。ME配方:20 g麦芽提取物,2 g蔗糖,0.2 g蛋白胨,20 g琼脂,1 L去离子水,pH值自然。内生菌发酵培养基为马铃薯葡萄糖肉汤(PDB)培养基和ME液体培养基,即分离纯化培养基中不加琼脂。
1.2 试验方法
1.2.1 内生菌的分离纯化 采用组织分离法[21]分离纯化苦菜和茵陈中的内生菌。将新鲜植物材料用无菌水冲洗干净并晾干,将根、茎、叶分别用无菌手术刀片切成小块,先用75%乙醇消毒3 min、无菌水冲洗3次,再用10%次氯酸钠浸泡8 min、无菌水冲洗3次,最后用无菌滤纸吸干水分。将组织材料纵切后置于分离纯化培养基上,每个培养基放4组,于28 ℃恒温培养箱中培养7 d,待组织块边缘有菌丝长出后,挑取不同形态的菌丝接种于新鲜培养基上,反复分离纯化即得内生真菌。
1.2.2 抑菌试验 采用平板对峙法[22]进行抑菌试验,用直径为5 mm的无菌打孔器打取供试病原真菌菌饼、内生菌菌饼,将其对称放于PDA培养基上,于28 ℃下培养5 d,分别测量病原菌对峙侧、非对峙侧半径,并按如下公式计算抑菌率:
抑菌率=(非对峙侧半径-对峙侧半径)/(非对峙侧半径)×100%。
挑取供试病原真菌和内生菌生长交界处的菌丝制片,并用顯微镜观察其形态。
1.2.3 发酵液的制备和萃取 挑取内生菌菌丝接种于装有100 mL发酵培养基的250 mL三角瓶中,于28 ℃、150 r/min条件下培养10 d。将发酵培养物过滤,除去菌体,滤液用等体积乙酸乙酯萃取3次,合并有机相,于55 ℃条件下减压浓缩蒸干,即得菌液粗提物。将过滤得到的菌体用适量95%乙醇冷凝回流3次,合并乙醇相,减压浓缩蒸干,即得菌体粗提物。用体积比为1 ∶ 1的无水乙醇和去离子水溶液溶解粗提物。菌液粗提物和菌体粗提物均置于4 ℃冰箱保存备用。
1.2.4 内生菌1,1-二苯基-2-三硝基苯肼自由基(DPPH·)清除能力测定 参照Li等的方法[23]测定内生菌清除DPPH·的能力。精确称取0.001 97 g DPPH粉末,用无水乙醇溶解并定容至100 mL(终浓度为0.05 mmol/L),作为母液,于4 ℃下低温避光保存。向2 mL DPPH母液中加入1 mL菌液粗提物和2 mL无水乙醇(最终提取液浓度为 3 mg/mL),混匀,于25 ℃下水浴30 min,以相同浓度的维生素C溶液为阳性对照,测定517 nm处的吸光度,记作A1处理;另外将1 mL菌体粗提物与 4 mL 无水乙醇混匀,记作A2处理。按如下公式计算DPPH自由基清除率:
DPPH自由基清除率=[1-(D517 nm(1)-D517 nm(2))/D517 nm(3)]×100%。
式中:D517nm(1)为提取液或维生素C溶液的吸光度;D517nm(2)为背景溶液(提取液或维生素C溶液)不加DPPH时的吸光度;D517 nm(3)为空白对照(蒸馏水代替提取液或维生素C溶液)的吸光度。每个样品设3次重复,取平均值。
1.2.5 菌株的鉴定 采用平板培养法、显微镜镜检法对具有活性的内生真菌进行形态学鉴定。通过内转录间隔区(ITS)测序对菌株进行分子生物学鉴定。将平皿中培养好的内生真菌直接交给睿博兴科(青岛)测序部进行PCR测序。将测定的ITS序列与GenBank中已知的核酸序列进行BLAST比对分析,从中获得与菌株ITS同源的序列,用MEGA 70软件构建系统发育树。
2 结果与分析
2.1 内生菌对病原真菌的拮抗作用
从苦菜中共分离获得21株内生真菌,其中从根部、茎部分别分离获得14、7株;从茵陈中共分离获得13株内生真菌,其中从根部、茎部分别分离获得8、5株。使用平板对峙法测定内生真菌对病原真菌的拮抗能力,结果显示,分离自苦菜根部的 KC-G-2-3-2对白绢病病菌、串珠镰刀菌、尖孢镰刀菌、层生镰刀菌等4种植物病原菌都具有良好的抑菌效果,抑菌率分别为50%、40%、41%、65%(图1);分离自茵陈茎部的YC-J-4-2对串珠镰刀菌、尖孢镰刀菌、层生镰刀菌等3种植物病原菌具有良好的抑菌效果,抑菌率分别为56%、46%、63%,但对白绢病菌无抑菌作用(图2)。
由图1、图2还可以看出,在内生菌菌株 KC-G-2-3-2、YC-J-4-2的作用下,4种植物病原真菌菌丝的正常生长均受到了抑制,表现为无法向外生长延伸,被抑制的地方产生明显的分界线,对该位置的菌丝进行显微观察,未发现病原真菌菌丝有畸形现象,表明内生真菌主要是通过与病原真菌竞争生存空间和营养物质来抑制其生长。
2.2 待测样品的制备
将“2.1”节中得到的具有抑菌活性的内生菌分别用PDB培养基、ME液体培养基进行摇瓶培养,10 d 后共得到4份待测样品, 将KC-G-2-3-2
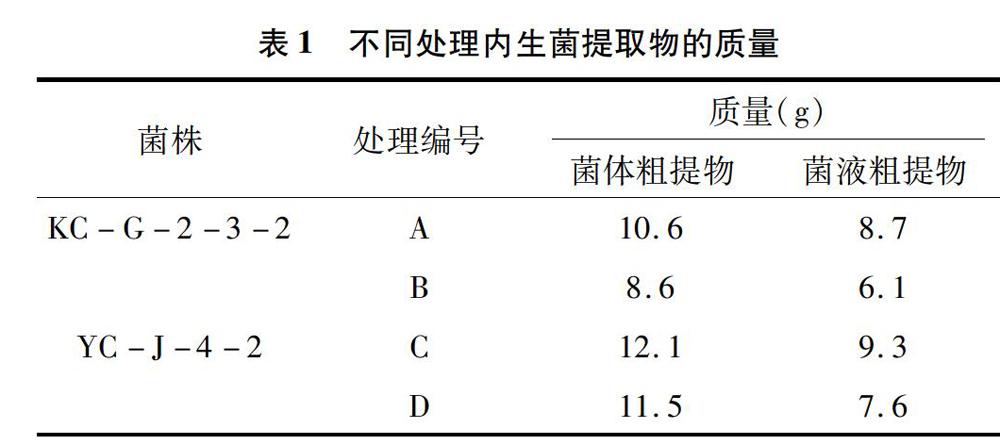
的PDB发酵液记作A样品,ME发酵液记作B样品;YC-J-4-2的PDB发酵液记作C样品,ME发酵液记作D样品。4份样品过滤后,分别萃取过滤液和菌体,将其进一步分为菌液提取物、菌体提取物,共8份样品,每份样品的质量见表1。
2.3 抗氧化活性的测定结果
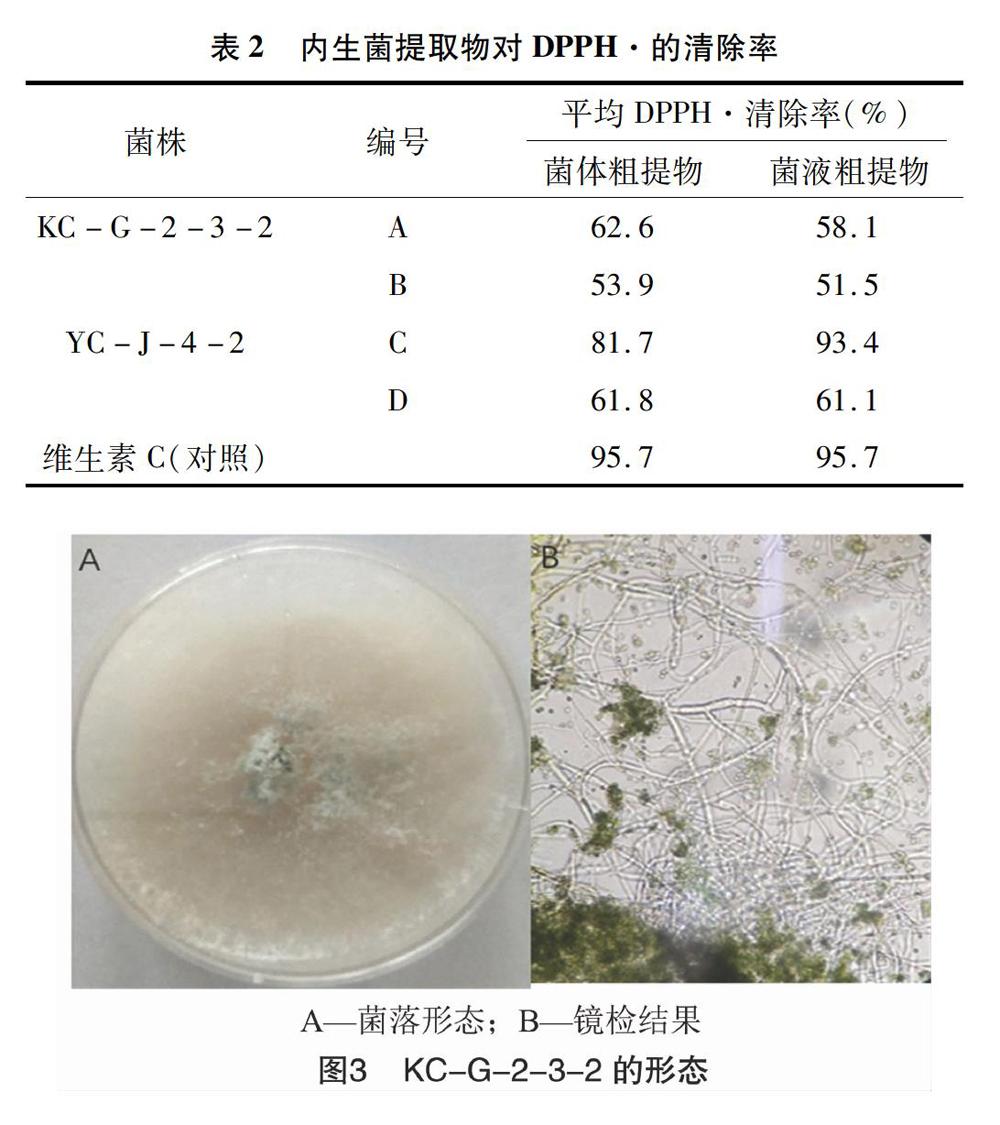
由表2可知,在3 mg/mL的质量浓度下,测试样品对DPPH·表现出了不同程度的清除作用,其中YC-J-4-2的PDB培養基发酵液的菌液粗提物对DPPH·的清除率超过了90.0%,菌体粗提物对DPPH·的清除率超过了80.0%,显示出较强的抗氧化活性,其余样品对DPPH·的清除率均在500%以上。
2.4 内生菌的鉴定结果
2.4.1 形态学鉴定结果 KC-G-2-3-2菌株的菌落形态和镜检结果见图3。KC-G-2-3-2菌株生长迅速,初期菌落为白色,呈致密、绒毛状,随后菌落中央产生绿色孢子,中央变成绿色。分生孢子产生后,单生或簇生,呈圆形、绿色,初步鉴定属于木霉属(Trichoderma sp.)。
YC-J-4-2菌株的菌落形态和镜检结果见图4。YC-J-4-2菌株在生长初期呈乳白色,气生菌丝发达致密,呈羽毛状,后期逐渐转为灰色。在显微镜下只观察到菌丝,未见有分生孢子产生,可能与培养时间、培养条件有关,需要进一步用分子手段对其进行鉴定。
2.4.2 分子水平的鉴定结果 经测序可知,KC-G-2-3-2菌株ITS 序列长581 bp(GenBank登录号:MN823637)。对该序列进行BLAST比对分析,结果显示,它与短木霉(Trichoderma breve)的同源性最高,相似度为100%;选出相关性较高的属内相关菌株的ITS序列,用MEGA 7.0构建系统发育树,结果显示,它与Trichoderma breve聚为1族(图5),确定KC-G-2-3-2为木霉属菌株,命名为Trichoderma breve KC-G-2-3-2。
经测序可知,YC-J-4-2菌株ITS序列长 544 bp(GenBank登录号:MN823638)。对该序列进行BLAST比对分析,结果发现,它与间座壳菌(Diaporthe goulteri)的同源性最高,相似度为100%;选出相关性较高的属内相关菌株的ITS序列,用MEGA 7.0构建系统发育树,结果显示,它与Diaporthe goulteri聚为1族(图6),确定YC-J-4-2为间座壳属菌株,命名为Diaporthe goulteri YC-J-4-2。
3 结论与讨论
化学农药的滥用不仅会对人类生态环境产生恶劣影响,还会导致病虫害抗性等问题,因而亟需开发出高效、低毒、无污染的新型农药。生物农药具有选择性强、药效高、对环境较友好、不易产生抗药性等优点,这些特性不仅满足了当代人的需求,更满足了可持续发展的战略目标,因此,生物农药具有十分广阔的发展前景,有望成为最具发展潜力的农药品种[24-25]。本试验以药食两用植物苦菜、茵陈为材料,分离筛选出2株对串珠镰刀菌、尖孢镰刀菌、层生镰刀菌具有良好抑制作用的植物内生菌KC-G-2-3-2、YC-J-4-2,其中KC-G-2-3-2还对白绢病菌有良好的抑制作用。这2株植物内生真菌均有潜力作为生防菌开发为生物农药。
抗氧化活性是备受医学界关注的生物学活性之一。越来越多的研究结果显示,抗氧化是预防衰老的重要途径,消除过多的氧化自由基对于预防许多由自由基引起的相关疾病是非常重要的。抗氧化剂对于防治癌症、心脏病、脑卒中、阿尔茨海默症、风湿性关节炎及白内障等慢性疾病都具有一定的效果[26]。本试验分离得到2株植物内生真菌 KC-G-2-3-2、YC-J-4-2,用不同液体培养基发酵后,其发酵过滤液、菌体萃取液的抗氧化活性检测结果显示,2株内生菌均具有良好的DPPH·清除能力,清除率均在50%以上。特别是YC-J-4-2的PDB培养基发酵液的菌液提取物,对DPPH·的清除率超过90%,菌体提取物对DPPH·的清除率超过80%,显示出较强的抗氧化活性。
通过形态学及分子生物学水平的鉴定,确定 KC-G-2-3-2为木霉属菌株,YC-J-4-2为间座壳属菌株,这2个属均为常见的植物内生菌属,近年来关于这2个菌属菌株的抗菌、抗氧化研究也较多。如Hu等从荔枝内生菌绿木霉(Trichoderma virens)中分离得到一系列倍半萜类化合物,这些化合物均具有抑制植物病原真菌的活性[27];Ikram等研究发现,牛茄子内生菌娄地青霉(Penicillium roqueforti)、里氏木霉(Trichoderma reesei)的发酵萃取物具有抑制植物病原细菌和抗氧化活性[28];Guo等从植物内生菌间座壳属某菌株中获得了1个新化合物diaporone A,该化合物抑芽孢杆菌的活性中等,细胞毒活性弱[29];da Rosa等采用超临界流体萃取技术从植物内生菌Diaporthe schini中获得了具有抗氧化活性的提取物,该提取物对DPPH·的清除率可达9662%[30]。本试验从苦菜、茵陈中所得菌株,既具有拮抗植物病原真菌活性,又具有抗氧化活性,具有较高的潜在应用价值,结果可为这2种植物内生菌的开发利用提供理论基础和数据支持。
参考文献:
[1]杨志军,邓 毅,曼 琼,等. 内生菌在天然药物研究中的研究进展[J]. 中国临床药理学杂志,2018,34(5):593-596.
[2]黄敬瑜,张楚军,姚瑜龙,等. 植物内生菌生物抗菌活性物质研究进展[J]. 生物工程学报,2017,33(2):178-186.
[3]陈金阳,陆儒涵,王 玲,等. 药用植物内生菌抗氧化活性研究进展[J]. 中草药,2016,47(20):3720-3727.
[4]郑有坤,刘 凯,熊子君,等. 药用植物内生放线菌多样性及天然活性物质研究进展[J]. 中草药,2014,45(14):2089-2099.
[5]靳 锦,赵 庆,张晓梅,等. 植物内生菌活性代谢产物最新研究进展[J]. 微生物学杂志,2018,38(3):103-113.
[6]Masand M,Jose P A,Menghani E,et al. Continuing hunt for endophytic actinomycetes as a source of novel biologically active metabolites[J]. World Journal of Microbiology and Biotechnology,2015,31(12):1863-1875.
[7]刘 畅,严铭铭,邵 帅,等. 山苦菜化学成分及药理作用的研究进展[J]. 中国实验方剂学杂志,2015,21(20):231-234.
[8]刘玉萍,邱小玉,刘 烨,等. 茵陈的药理作用研究进展[J]. 中草药,2019,50(9):2235-2241.
[9]韩阳阳,王天晓,朱海芳,等. 苦菜不同部位提取物的抗氧化活性[J]. 食品科学,2010,31(19):45-48.
[10]周劝娥,田呈瑞,关 为,等. 陕西苦菜叶总黄酮的提取及抗氧化活性的测定[J]. 食品工业科技,2013,34(9):97-102.
[11]郑翠萍,田呈瑞,马婷婷,等. 苦菜多酚的提取及其抗氧化性研究[J]. 食品与发酵工业,2016,42(3):224-230.
[12]谢三都,谢雷朋,龚志鹏. 苦菜粗多糖的制备及其抗氧化活性的研究[J]. 农产品加工,2015(6):15-18,22.
[13]郭愛华,任静宇,王 佩,等. 苦菜不同部位提取物的抑菌活性与抗氧化性[J]. 贵州农业科学,2016,44(4):60-62.
[14]侯金丽. 苦菜提取液抗菌效能试验研究[J]. 现代农业科技,2015(7):77-81.
[15]祝 茗,张开梅,丁 燕. 茵陈蒿中滨蒿内酯及东莨菪素抗氧化活性的评价[J]. 沈阳药科大学学报,2016,33(11):889-893.
[16]齐善厚. 茵陈黄酮的抗氧化及镇痛作用研究[J]. 现代食品科技,2013,29(3):501-504.
[17]史 娟,张泽浩,李 江,等. 陕西茵陈黄酮提取及抗氧化性能研究[J]. 油脂化学,2018,43(9):30-34,39.
[18]康 娜,梁永锋. 茵陈中绿原酸提取工艺及抗氧化活性研究[J]. 中国中医药科技,2017,24(5):587-590,598.
[19]赵娜娜,路 伟,傅文佳,等. 四种菊科蒿属植物精油杀螨活性及茵陈蒿挥发油成分分析[J]. 新疆农业科学,2019,56(1):166-173.
[20]赵良忠,蒋贤育,段林东,等. 茵陈蒿水溶性抗菌物质提取工艺和抑菌效果研究[J]. 食品工业科技,2005,26(10):100-102.
[21]Li Y L,Xin X M,Chang Z Y,et al. The endophytic fungi of Salvia miltiorrhiza Bge.f.alba are a potential source of natural antioxidants[J]. Botanical Studies,2015,56(5):1-7.
[22]王贵生,陆 娟,唐 娟,等. 1株亳菊内生菌的分离鉴定及其生物活性分析[J]. 西北农林科技大学学报(自然科学版),
2019,47(4):138-145,154.
[23]Li X,Li X M,Xu G M,et al. Antioxidant metabolites from marine alga-derived fungus Aspergillus wentii EN-48[J]. Phytochemistry Letters,2014,7(1):120-123.
[24]郭明程,王晓军,苍 涛,等. 我国生物源农药发展现状及对策建议[J]. 中国生物防治学报,2019,35(5):755-758.
[25]Seiber J N,Coats J,Duke S O,et al. Biopesticides:state of the art and future opportunities[J]. Journal of Agricultural Food Chemistry,2014,62(48):11613-11619.
[26]张 明,冯璐璐. 抗氧化活性评价标准与发展[J]. 安徽农学通报,2010,16(8):33-34,106.
[27]Hu Z B,Tao Y W,Tao X Y,et al. Sesquiterpenes with phytopathogenic fungi inhibitory activities from fungus Trichoderma virens from Litchi chinensis Sonn.[J]. Journal of Agricultural Food Chemistry,2019,67(38):10646-10652.
[28]Ikram M M,Ali N,Jan G. et al. Novel antimicrobial and antioxidative activity by endophytic Penicillium roqueforti and Trichoderma reesei isolated from Solanum surattense[J]. Acta Physiol Plant,2019,41(164):1-11.
[29]Guo L F,Niu S B,Chen S L,et al. Diaporone A,a new antibacterial secondary metabolite from the plant endophytic fungus Diaporthe sp.[J]. Journal of Antibiotic,2019,73:116-119.
[30]da Rosa B V,Kuhn K R,Ugalde G A,et al. Antioxidant compounds extracted from Diaporthe schini using supercritical CO2 plus cosolvent[J]. Bioprocess and Biosystems Engineering,2019,43:133-141.任曙霞,郝 玲,李中林,等. 連云港市小麦拔节期冻害灾损判别指标和风险分布[J]. 江苏农业科学,2020,48(20):270-275.

