细胞膜受体蛋白的荧光成像与寡聚化调控研究进展
黄梓芸,薛 倩,邓翔熙,赵聪慧,孙芸琳,潘松兰,邹 振
(长沙理工大学化学与食品工程学院,细胞化学湖南省重点实验室,湖南长沙410114)
0 前言
细胞膜受体是细胞表面的一类分子,它们能识别并结合专一的生物活性物质(配体),生成的复合物能激活和启动一系列生物学过程,从而导致该活性物质的最终生物学效应[1]。细胞膜受体是沟通细胞与其外部环境的桥梁,它能感知细胞环境中各种因素的变化,随后通过受体相互作用,影响细胞内的生理过程发生相应的变化[2-3]。多年以来,通过调控细胞膜上各种受体来改变其生物或化学活性的方法层出不穷。尽管如此,许多细胞表面受体以相对较低的量存在,但是,受体在生理和病理过程中的重要性已经得到广泛认可[4-6]。细胞中的大多数生物过程是由各种受体激活的信号转导所控制的,例如细胞周期、增殖、通讯、迁移和凋亡等[7]。因此对细胞膜表面受体的荧光成像和相关活动荧光监测一直是细胞化学的热门领域。
此外,细胞膜受体寡聚(或受体低聚)是细胞活动中重要的信号转导机制[8]。大量的研究已经证实,大多数受体并不是作为单个实体起作用,它们往往可以在相应的配体介导下组装成二聚体或高阶寡聚体形式[9],细胞膜受体可利用该机制将细胞外信号传递到内部细胞质机器中,以促进细胞中下游信号传导级联反应[10]。受体寡聚的形成,大多数发生在一些主要的受体家族中,例如整联蛋白、G蛋白偶联受体(GPCR)、受体酪氨酸激酶(RTK)、T细胞受体(TCR)等[11]。它们参与了大多数重要的细胞过程[12]。细胞表面的受体二聚化或高阶寡聚化作为激活受体的一般机制,通常被认为是第一步[13]。因此,验证细胞表面受体的表达水平和二聚化状态对于深入了解细胞中下游信号转导具有重要意义。该文综述了用于活细胞中受体监测成像策略及调控细胞膜受体寡聚化策略的最新发展。
1 细胞膜受体靶向成像
化学生物学和细胞生物学的快速发展,引起了人们以自定义的方式对细胞表面受体进行监测与调控的高度兴趣[14]。对细胞膜受体精确和可靠的监测,是人工调控细胞膜受体并操纵细胞下游信号的关键和初始过程。细胞膜受体作为许多疾病的生物标志物和药物治疗靶点,实时原位、动态准确的监测和调控细胞膜受体,对探索受体与细胞生理学的复杂联系以及生理和病理功能具有重要意义[15]。已经开发出许多策略用于识别监测细胞膜表面受体,这些策略为精确识别特定细胞和对相关疾病进行治疗提供了大量重要的时空信息。近几年来,已经开发出了利用单克隆抗体、DNA适配体、靶向肽等一系列策略来对细胞膜表面受体进行识别监测[16]。
1.1 抗体识别的受体成像
单克隆抗体,是一种通过采用杂交瘤技术制备的,由单一B细胞克隆产生的高度均一、仅针对某一特定抗原表位的抗体。自从单克隆抗体问世以来,由于其独有的特征已经迅速作为医学实验室的诊断试剂,譬如特异性强、纯度高和均一性好等特点,广泛应用于免疫组化和流式细胞仪等技术[17]。2020年,Wang等[18]基于HER2受体特异性单克隆抗体Herceptin(一种注射用曲妥珠单抗,它能够与存在于HER2阳性肿瘤细胞表面的HER2受体结合,阻止它们接收生长信号并标记它们被免疫系统破坏。)合成了一种荧光Au NCs的稳定剂。该策略如图1所示:三价Au离子镶嵌在Herceptin分子复杂三维结构的空腔中,随后在碱性条件下,Herceptin的还原性被激活,以形成Au NCs。这种Herceptin单克隆抗体稳定化的Au NCs(Her-Au NCs)将对HER2受体的胞外域保持高亲和力,并具有用作HER2受体特异性荧光成像光学探针的潜力。

图1 Her-Au NC的合成与特异性活细胞表面HER2受体成像机理示意图[18]Fig.1 Her-Au NC mechanism of action[18]
2018年,Lin等[19]提出一种split proximity circuit(SPC)的一锅法分子工具箱,用于细胞表面受体成簇的自主可视化检测。该策略如图2所示:起始链I1和I2首先与特定的识别抗体结合在一起,在没有目标受体的二聚体存在时,作为两个独立的实体存在。但当它们与靶受体结合后,I1和I2的局部浓度增加,这促进了结构域a的结合以触发发夹单体(HP1和HP2)之间的杂交链反应(HCR)。该策略通过抗体识别和一系列自主DNA杂交来实现局部无酶信号放大。研究的对象是均在细胞裂解物中和原位固定的全细胞上的HER2:HER2同源二聚体和HER2:HER3异源二聚体。
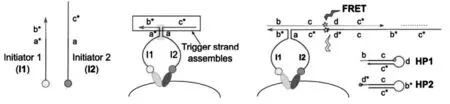
图2 用于细胞表面受体聚类的局部检测和可视化的SPC示意图[19]Fig.2 Schematics of SPC for the localized detection and visualization of cell surface receptor clustering[19]
1.2 核酸适配体的受体成像
核酸适配体,一段单链DNA或RNA寡核苷酸,是一种新型的细胞表面受体识别靶向剂[20]。利用核酸适配体对细胞膜受体进行靶向识别成像具有多种优势。核酸适配体以高选择性、可编程性和对受体高亲和力结合的能力受到人们的极大关注,其体积小且合成方便、便宜,并且具有良好的化学稳定性,低的抗原和免疫原性潜力以及优异的组织穿透能力等[21]。近些年,已经开发出多种利用功能化核酸适配体对细胞膜受体进行靶向识别成像、药物精准递送以及对一些与疾病相关的受体作为拮抗剂的系统[22]。
癌细胞行为的改变通常是由于某些细胞表面受体的突变或过度表达。最近,Tan等[21]利用多种DNA适配体以及相关的基于toehold反应来实现对细胞的高特异性鉴定。多种DNA适配体能够选择性对癌症细胞表面多种受体进行识别,以及相关的toehold反应激活以进行信号整合和放大。该系统采用“toehold区域缔合”的方法,该方法可以以编程的和定时的方式激活用于杂交链反应(HCR)启动的多个toehold区域,从而达到信号的整合和放大。该策略能够以优异的灵敏度和准确性实现癌细胞的鉴定和分离(图3)。

图3 基于多种DNA适配体及相关toehold反应HCR成像机理[21]Fig.3 HCR imaging mechanism based on multiple DNA aptamers and related toehold reactions[21]
单分子成像技术被广泛用于这些标记物的可视化和评估其相关的生物学特征,如受体扩散和同源/异源受体-受体相互作用。2020年,Burke等[23]基于适配体开发了一种可逆、高特异性、无干扰的亲和探针,应用于活细胞表面受体的单分子成像。这种可逆性探针可以在不干扰EGFR内源性行为的情况下,对与单分子示踪(Single molecule tracking,SMT)结合的活癌细胞的EGFR密度水平进行光致不敏感检测,从而获得高密度受体的运动图谱。该方法基于适配体与其靶标之间的随机和瞬时结合来定位和跟踪单个受体。他们成功地对活癌细胞上肿瘤标记物(EGFR)实现了单分子成像,并且通过合理设计适配体序列来调节对EGFR的亲和力,从而确定受体运动及密度(图4)。
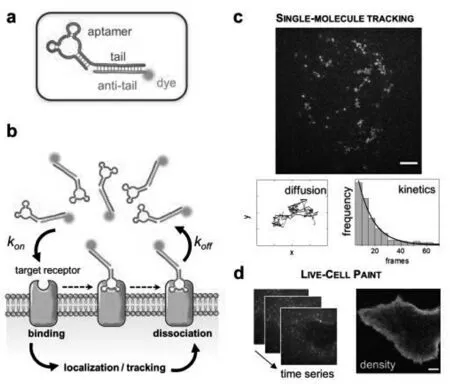
图4 荧光偶联适体探针作用原理[23]Fig.4 Principle of fluorescence coupled aptamer Probe[23]
2021年,Song等[24]报告了一个“turn-on”策略,以可视化细胞表面HER(人类表皮生长因子受体)二聚体。该工作利用鸟嘌呤(G)序列特异性适配体识别和邻近诱导DNA模板银纳米团簇(DNA/AgNCs)荧光激活的优势,将两种具有不同荧光性质的DNA/AgNCs序列连接到相应的HER适配体上,形成适配体功能化的AgNCs探针,并将富G序列附加到相应的HER适配体作为增强子。在蛋白质二聚体存在的情况下,经适配体特异性识别和结合后,可使AgNCs探针靠近富G探针,激发相应的荧光。该方法成功地实现了HER2:HER2同聚体和HER2:HER3杂二聚体的同时成像,为同时检测多个HER2二聚体提供了新的思路(图5)。

图5 基于邻近诱导的DNA/AgNCs荧光激活的HER2二聚原位成像示意图[24]Fig.5 Schematic illustration of the turn-on strategy for HER2 dimerization imaging in situ based on proximityinduced fluorescence activation of DNA/AgNCs[24]
1.3 小分子的受体识别
一些细胞膜受体在疾病的发病机制中起着核心作用。近些年,已经开发出了许多小分子受体靶向荧光激动剂,并已经将其应用到活细胞[25]。关于生物分子成像技术,与基于放射性同位素的探针相比,基于荧光的造影剂发射非电离辐射并且具有更长的保质期。此外,有机染料的荧光特性可以通过化学修饰在很宽的范围内进行调节[26-27]。
作为跨膜蛋白的最大家族,GPCRs(G蛋白偶联受体)是目前所有药物中近40%的结合作用的靶点。α1-肾上腺素能受体(α1-受体)是GPCRs家族的重要成员之一,在介导多种生理效应中起着至关重要的作用,主要分为α1A,α1B和α1D三个亚型。α1-受体参与肝糖代谢、平滑肌收缩以及心肌的肌力和变时性等有关调节,还与良性前列腺增生、下尿路症状、高血压、前列腺癌等疾病密切相关。因此,进一步研究α1-受体的分子药理学至关重要,迫切需要大量新颖有效的荧光探针分子。最近,Li等[28]基于光诱导电子转移(PET)开关,将荧光团7-(二乙氨基)香豆素-3-羧酸与α1-受体激动剂去氧肾上腺素偶联开发了α1-受体的新型荧光激动剂。在此方案中,去氧肾上腺素(PE)作为α1-ARs的选择性激动剂,可以与α1-ARs结合,同时也作为一种猝灭剂。7-(二乙氨基)香豆素-3-羧酸(DAC)作为荧光团。由于PET效应,探针只表现出最低水平的荧光,但在与α1-ARs的配体结合域结合后,PET效应被阻断,然后荧光被打开。研究结果表明,这些荧光探针分子与α1-受体具有有效的结合,可用于活细胞中选择性的荧光标记α1-受体,并且可以应用于活细胞中受体内在化动态过程的追踪。同时,这些探针还作为荧光示踪剂用于构建基于生物发光共振能量转移(BRET)的结合测定方法,该方法具有筛选α1-受体激动剂和拮抗剂的潜力。这些基于PET开关的荧光激动剂,具有作为α1-受体生理和药理学研究和药物研发的可视化工具的潜力(图6)。

图6 基于PET效应的α1-受体荧光激动剂的荧光开-关作用示意图[28]Fig.6 Principles of receptor fluorescent agonists[28]
叶酸(Folic acid,FR)是一碳代谢途径和核苷酸合成所必需的物质,早在90年代就已作为癌症组织成像的靶向配体。40%左右的癌症中α型叶酸受体(FR-α)过表达,特别是卵巢癌等恶性组织,而除肾脏以外的正常组织均不会积聚叶酸及其结合物。即使与成像剂结合后,叶酸仍以高亲和力与FR-α结合,并经受体介导的内吞过程进入细胞。另外,近红外(NIR)荧光染料由于较深的组织渗透和较低的自发荧光而广受关注。2019年,Yasuteru等[29]将含有羧基的硅基罗丹明通过带负电的三肽结构与叶酸相连接,设计合成了一种新型NIR荧光探针FolateSiR-1。硅基罗丹明作为荧光团,是一种NIR荧光染料;叶酸作为叶酸受体的配体,与硅基罗丹明带负电的三肽结构连接在一起。该探针作为一种叶酸受体靶向性荧光探针,其在30 min内聚集在荷瘤小鼠的FR过表达区域且表现出高达83倍的肿瘤-背景比(TBR)(图7)。
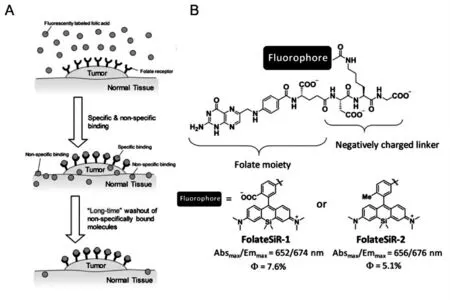
图7 (A)现有的近红外荧光探针用于活体动物体内荧光成像的成像策略;(B)用于检测叶酸受体的荧光探针的分子设计[29]Fig.7 Molecular design of fluorescent probe for detecting folate receptor[29]
2 细胞膜受体靶向调控
由上面介绍可知,细胞表面受体的各个家族在感知到细胞外刺激后会经历从自由扩散的单体到二聚或高阶低聚物的转变。大量的证据也表明,各种细胞表面受体,无论是同聚还是异聚,都会对下游各种信号转导发挥重要作用[30-31]。因此,人工调节受体的寡聚化对于精确控制信号转导和细胞行为提供了无限的可能。近年来,利用DNA手段、蛋白质手段、小分子手段及基于物理刺激的方法来调节受体的寡聚引起了科研工作者的广泛关注。由于不需要对细胞受体进行遗传修饰,可以在不干扰天然受体结构和功能的情况下调节更多的内源性受体。同时,这些方法具有灵活和可设计的特性,将会在之后的应用进一步扩展[32-34]。
2.1 蛋白质介导的受体寡聚化
受体的天然配体大多数是蛋白质分子。由于配体蛋白质具有高亲和力和靶向特异性,使得其在诱导受体寡聚领域具有很高应用的潜力[35]。2020年,Komatsu课题组[36]报告了一种抗体点击作为修饰靶向细胞表面抗体功能的策略。通过增加抗体与目标抗原结合的有效浓度,进行分子间无铜点击反应,选择性地在细胞表面启动抗体交联。通过在HER2过表达细胞表面交联四嗪和双环壬炔修饰的曲妥珠单抗,观察到抗体摄取增加和细胞内信号通路激活。研究结果表明,交联反应可以显著改变蛋白质的生物物理性质,激活其在目标细胞上的独特功能,以实现细胞信号的操纵(图8)。
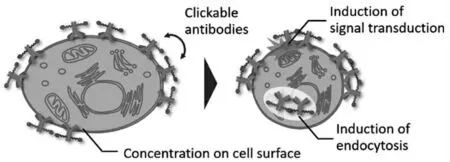
图8 细胞表面抗体交联的设计[36]Fig.8 Design of cell surface antibody cross-linking[36]
2020年,Wang等[37]开发了一种基于肽的、无毒的HER2受体介导的可转化纳米粒子,它针对单一的HER2+乳腺癌模型非常有效。该方案设计并合成了一种智能超分子肽BP-FFVLKYCDGFYACYMDV,该肽能够在水性条件下和在循环条件下组装成纳米颗粒(NP),以及在肿瘤部位原位转化为纳米原纤维(NF)结构并与细胞表面HER2结合。这种可转化的肽单体(TPM)存在一个二硫键环肽HER2结合域,一种抗HER2/neu抗体的肽模拟物(图9)。
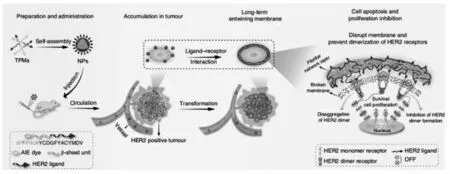
图9 智能超分子肽BP-FFVLK-YCDGFYACYMDV纳米粒子的组装及工作原理[37]Fig.9 Assembly and working principle of BP-FFVLK-YCDGFYACYMDV[37]
2.2 小分子介导的受体寡聚化
近些年,许多的细胞膜受体已经成为药物靶标。激动剂或拮抗剂的发展对受体寡聚可能会产生重要的治疗应用价值。小分子对受体寡聚的调控,通常能够让人们对受体与小分子配体之间结合的详细机制和定量关系有充分的理解。与蛋白质药物相比,小分子药物在设计和合成方面可以更加灵活[38]。
Toll样受体(TLR)是最广泛认可的一组病原体相关或损伤相关分子模式(PAMPs和DAMPs)受体,可识别病原体或异常细胞的分子成分并引发先天免疫应答。它们还可以诱导适应性免疫反应,例如疫苗在体内发挥作用往往是由于TLR系统的激活。最近,Boger等[39]合成了一种有吸引力的人类TLR小分子激动剂,其能够在极低的浓度(EC50=110 pmol/L)下引起TLR1/TLR2二聚化(图10)。
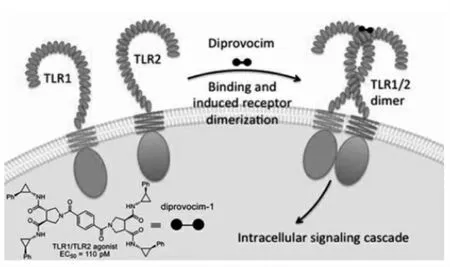
图10 TLR小分子激动剂的分子式及其诱导TL1与TL2二聚化的工作原理[39]Fig.10 The molecular formula and working principle of TLR[39]
2.3 有机高分子介导的受体寡聚化
目前,已经开发出使用多价合成聚合物来控制细胞表面受体的空间分布,从而以定制的方式调节细胞功能。多价合成聚合物往往能够使细胞表面受体成为受体簇,多价结合比二价有更高的亲和力和凋亡诱导能力。但是,多价结合高度依赖于聚合物的结构以及配体密度,这可能对具有高配体密度聚合物的合成造成困难[40]。
Kopecek等[41]通过可逆的加成-断裂链转移(RAFT)聚合反应,然后通过硫醚键连接Fab'片段,合成了嫁接有多个抗CD20单克隆抗体(mAb)Fab'片段的-(2-羟丙基)甲基丙烯酰胺(HPMA)。多价化合物会导致CD20受体交联并诱导细胞凋亡。CD20是B细胞非霍奇金淋巴瘤(NHL)最可靠的生物标志物之一,95%以上的B淋巴瘤带有CD20表面受体。该课题组合成了五个具有不同分子量和化合价(每个聚合物链的Fab'量)的共轭物,结果表明,多价导致更高的亲和力和凋亡诱导能力(图11)。
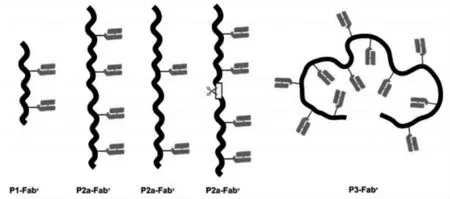
图11 抗体功能化的多价化合物示意图[41]Fig.11 Schematic diagram of antibody functionalized multivalent compounds[41]
Ji等[42]开发了一种利用在细胞表面发生聚合作用来聚集细胞表面受体的策略。作为概念证明,最初合成了抗CD20适体偶联的大分子单体,然后通过配体-受体相互作用将其有效地引入到非霍奇金淋巴瘤Raji细胞表面。该系统由抗CD20适配体修饰的大分子单体和引发剂过硫酸铵(APS)组成。抗CD20适体修饰的大分子单体可通过CD20受体与适体之间的相互作用与Raji细胞表面结合,然后APS将触发与Raji细胞表面结合大分子单体的聚合,随后会诱导细胞的凋亡(图12)。
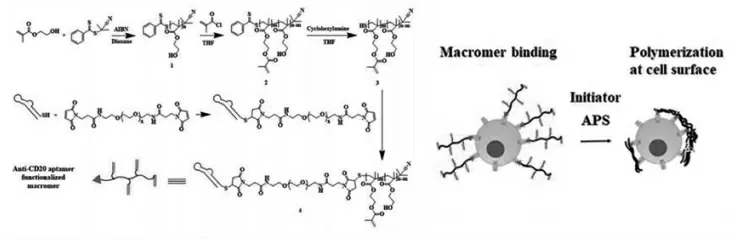
图12 抗CD20适体修饰的高分子单体作用原理[42]Fig.12 Principle of action of polymer monomer modified by anti-CD20 aptamer[42]
2.4 物理刺激介导的受体寡聚化
除了化学或生物学基础策略之外,一些物理因素也可以用作调节受体低聚的外部线索,比如磁场、温度和光等[43]。近些年以来,利用这些原理在受体调控以及肿瘤治疗等相关领域取得了很大的突破。
由于磁场可以对顺磁性粒子施加适当的力,因此纳米粒子的磁性驱动为控制细胞提供了一种新的策略。磁场可以通过磁力使磁性纳米颗粒聚集,从而导致纳米颗粒-受体复合物在细胞表面聚集。通常,磁性纳米颗粒涂有特定的配体,这些配体将它们连接到细胞表面上的受体。当细胞暴露于磁场中时,磁性纳米颗粒被拉动,从而使受体进入寡聚状态。2014年,利用这种方法,Schneck等[44]实现了对T细胞的活化(图13)。
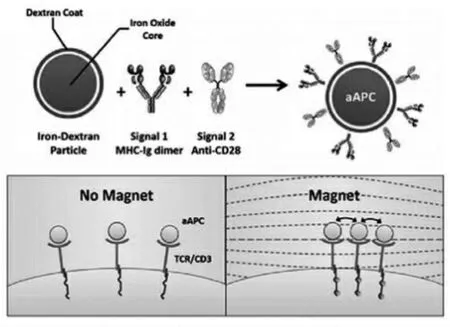
图13 功能化纳米磁珠的结构及其作用原理[44]Fig.13 The structure and principle of functionalized nano magnetic beads[44]
另一个典型的物理刺激是光,当需要对生物过程进行时空控制时,光是最常研究的物理条件。光响应材料由于具有空间和时间精度高、环境友好等优点而受到广泛关注。Aida等[45]首次报道了一种可光裂的分子胶PCGlue-NBD,它可以作为抑制剂来触发受体二聚化和激活。该化合物通过其Gu+基团和蛋白质的氧阴离子基团之间的多价盐桥相互作用,牢固地附着在目标蛋白质上,并利用其巨大的树突楔形覆盖蛋白质表面,包括它们的界面区域,以抑制蛋白质-蛋白质相互作用(PPIs)。然而,在紫外线照射下,PCGlue-NBD在氨基甲酸酯键处被切断,形成只有三个Gu+吊坠的小树突。黏附的多价性降低可能导致靶蛋白的释放,而可以参与PPIs。作为一项概念验证研究,该工作选择肝细胞生长因子(HGF)与其受体Met(间充质上皮转化受体)之间的PPI作为靶点,HGF和Met之间的PPI可以启动细胞增殖、存活和迁移的信号通路,从而促进伤口愈合(图14)。由此产生的HGF/Met相互作用允许Met磷酸化二聚,从而实现细胞的时空迁移。
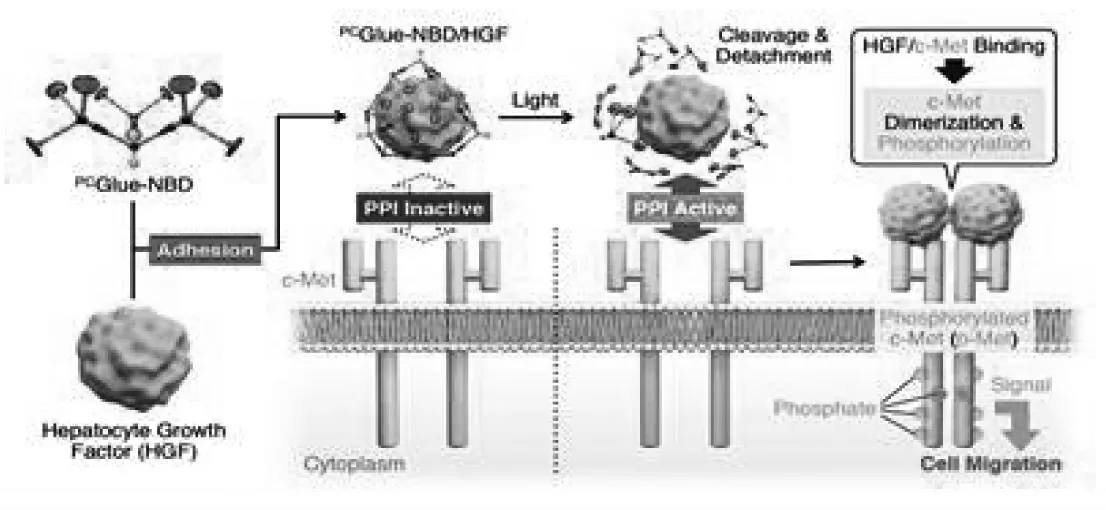
图14 PCGlue-NBD在关闭和开启由Met与其配体HGF之间的相互作用引起的Met二聚化的机制作用的示意图[45]Fig.14 Schematic illustration of the mechanistic role of PCGlue-NBD for turning off and on a protein-protein interaction(PPI)between hepatocyte growth factor HGF and its receptor c-Met[45]
2.5 DNA介导的受体寡聚化
DNA已经被视为纳米材料和生物技术中的强大构建单元。DNA的可编程性和低免疫原性使其具有精确设计和应用的便利性。Tang等[46]设计了一种基于DNA四面体诱导邻近Met二聚化的策略,可通过荧光共振能量转移(FRET),对受体的二聚化状态进行可视化。在这种纳米策略中,适配体作为识别序列,用于特异性结合受体单体。随后相邻的开关探针会相互杂交,诱导Met的二聚化,同时也会诱导Cy3和Cy5之间的FRET。该方法中,DNA四面体的良好稳定性保证了在多种生物样品中的应用价值。这项工作为开发新型蛋白质二聚化可视化纳米策略提供了一种新方法(图15)。
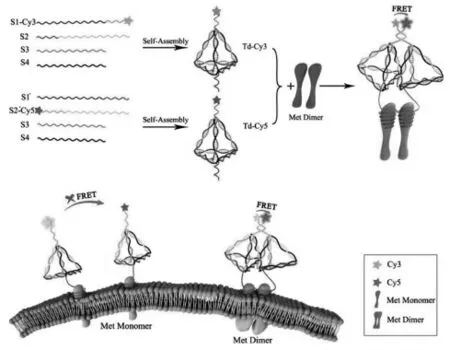
图15 DNA四面体纳米探针用于检测Met二聚体的制备和应用示意图[46]Fig.15 Schematic illustration of preparation and application of DNA tetrahedron nanoprobes for detecting Met dimer[46]
为了开发一个智能、安全且能精确调控的治疗平台,2019年,Sando等[47]设计了一种基于细胞外生物活性物质诱导可编程的Met激活的HGF模拟物DRIPaR。该方案基于双特异性DNA适配体,由一个能与Met靶向结合的序列和另一个能与细胞外空间中生物活性物质结合的序列组成,该细胞外生物活性物质可能是由一些人体内含有的不同类型的分子,例如血小板衍生生长因子(PDGF)、凝血酶等。在加入一个细胞外生物活性物质后,它将与双特异性DNA适配体形成一个2∶1的三元复合物,然后诱导Met二聚化和激活(图16)。
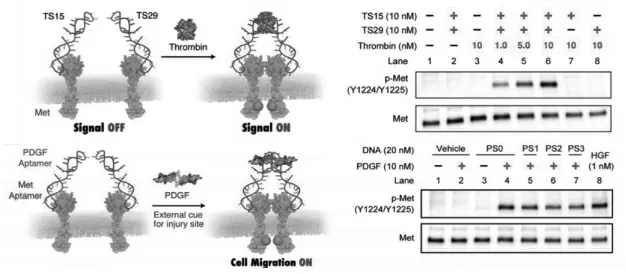
图16 诱导凝血酶依赖性或PDGF依赖性Met活化的DRIPaR原理图[47]Fig.16 Schematic diagram of DRIPaR that induces thrombin-dependent or PDGF-dependent Met activation[47]
与光遗传学相比,直接利用紫外光调控DNA的组装这种方法更方便,不需要通过耗时且昂贵的基因工程。然而,利用紫外线照射也有局限性,例如低的光穿透率和生物系统中内发生色团的固有吸收等。为了克服这些缺点,2019年,Nie等[48]提出了一种基于等离子体金纳米棒(Au NRs)的新型近红外(NIR)光激活DNA激动剂系统(NIR-DA),用于RTK二聚化和细胞信号激活的光学控制。该方案首先将过将预灭活的DNA激动剂偶联到金纳米棒(Au NRs)上来制备此纳米器件。经过近红外光处理后,DNA激动剂通过Au NRs的基于局部表面等离子共振(LSPR)产生的光热效应释放并变得有活性。活性DNA激动剂从Au NRs中释放出来并触发结合诱导的RTK二聚化,并激活活细胞中的下游信号转导。NIR的高渗透性使其在深层组织应用中成为可能(图17)。
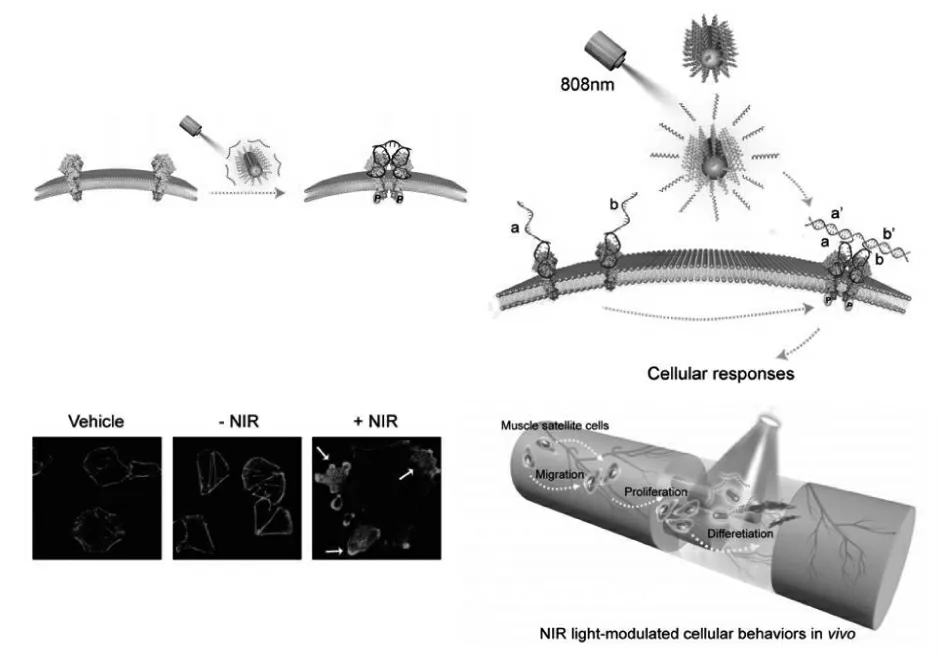
图17 基于等离子体Au NRs的NIR光激活NIR-DA系统用于诱导受体二聚化原理图[48]Fig.17 Schematic diagram of light-activated NIR-DA used to induce receptor dimerization[48]
由于细胞表面不会单单只表达某一种细胞表面受体,而是会表达多种表面受体,同时评估两种或多种细胞表面受体以识别特定的病变细胞,将会潜在地提高治疗选择性并尽可能地减少副作用。目前,大多数研究致力于通过诱导受体同聚作用来对受体进行激活和促进下游的信号转导。但是,抑制受体激活也是调节下游信号传导途径和细胞行为的一种手段。因此,在2019年,Yang等[49]开发了一种被称为双特异性适体诱导的人工蛋白质配对(BAAP)的策略,通过诱导异源受体二聚化来选择性调节受体功能。在这种策略中,双特异性适体探针充当分子介体,以结合靶受体和配对受体,这使两种受体在活细胞膜上紧密靠近。配对的受体不仅可以用作增强细胞选择性的癌症生物标志物,而且还可作为通过强大的位阻效应抑制靶受体功能的阻断助剂。这项研究提出了一种通过人工诱导异源受体二聚化并增加靶受体周围位阻的调节策略。通过使用不同的适体元件,使得该策略可以很容易地扩展到其他靶标受体。因此,该策略不仅揭示了双特异性适配体探针作为选择性调节受体功能的分子介质的潜力,而且也为开发新的治疗药物提供了一种通用的方法(图18)。

图18 选择性调节Met受体功能和下游信号通路的BAAP策略的示意图[49]Fig.18 Schematic diagram of BAAP strategy for selective regulation of Met receptor function and downstream signaling pathways[49]
3 结论与展望
细胞膜受体参与细胞周期、增殖、迁移、通讯等多种生物过程,也是调节生理和病理状态的重要靶点。实时原位、动态准确地对一些主要受体家族进行监测和调控,对探索受体与细胞生理学的复杂联系以及生理和病理功能具有重要意义。并且为开发新型治疗药物提供了一种通用的方法和全新的思路。随着分子生物学、医学、化学、材料学等学科的快速发展和相互融合,同时对生物系统更加全面、深层次的认识,为人工监测和调控细胞膜受体,进而控制细胞行为提供了无限的可能。目前,大多数特异性识别细胞膜受体的分子探针主要是一类生物分子,例如DNA、肽和抗体。但是这些生物分子通常在生命系统中缺乏可靠的稳定性和循环时间。同时,体内酶促降解和非特异性蛋白质吸附会导致受体靶向监测和调节的特异性和有效性低。因此,在未来,开发一种能够在复杂生物环境中稳定存在且对各类受体监测和调控通用的策略是非常迫切需要的。另外,由于该领域仍处于起步阶段并处于快速发展阶段,所以需要努力克服局限性,进一步满足实际应用的需求。

