不同番茄材料黄化曲叶病毒病抗性评价及抗性基因检测
刘 放,魏小红,张小芳,朱雪妹,冯 悦
(1.甘肃农业大学 生命科学技术学院,兰州 730070;2.甘肃省作物遗传改良与种质创新重点实验室,兰州 730070;3.甘肃省干旱生境作物学重点实验室,兰州 730070)
番茄黄化曲叶病毒病 (Tomato yellow leaf curl virus disease,TYLCVD)是由黄化曲叶病毒( Tomato yellow leaf curl virus,TYLCV简称TY)引起的一种对番茄产生毁灭性危害的一种病害,属于双生病毒科(Family Geminiviridae)菜豆金色花叶病毒属(Begomovirus)[1]的一类具有孪生颗粒形态的植物DNA病毒[2]。最早在20世纪50年代后期发现于阿拉伯半岛的西北部等地区[3],1964年被命名为黄化曲叶病毒病[4],烟粉虱(Bemisiatabaci)是其主要的传播方式[5]。中国首次于2006年在上海发现黄化曲叶病[6],近年来,该病毒已在上海、北京、新疆、安徽、浙江、天津、四川、陕西等地区大范围爆发[7]。目前针对对番茄黄化曲叶病毒病的防治主要以控制烟粉虱为主,但由于烟粉虱繁殖能力及其迁飞能力频率较高,并未取得理想的防治效果,目前抗病品种选育是当前防治TYLCV的最好方法之一[8-10]。
植物的防卫反应是由酶催化产生的一系列复杂生理生化代谢的结果[11],防御酶是植物体内抵制病原侵染的有关物质,其活性的变化通常作为衡量植物体内防卫反应的重要指标[12]。研究表明,其活性的高低与植物的抗病能力之间存在正相关关系[13-14]。目前已经在一些野生番茄中发现TYLCV的抗性基因,包括Ty-1、Ty-2、Ty-3、Ty-4和ty-5、Ty-6等[15],其中Ty-1、Ty-2和Ty-3在中国番茄种质资源中开发和利用较多[16]。这些抗性基因在育种中已成功应用,如瑞士先正达公司选育的‘拉比’和‘齐达利’里面都含有Ty-3a基因,法国 Clause 公司选育的‘宝丽’含Ty-3a基因,中国选育的‘浙粉701’含Ty-2基因,‘浙杂502’含有Ty-3a基因[17]。为了更加方便快捷地检测番茄携带抗性基因,针对 TYLCV 主要的抗性基因开发了一系列的分子标记[18]。如Ty-1、Ty-2和Ty-3/Ty-3a基因的 SCAR标记,这些分子标记在抗感品系间均表现出长度多态性,能够区分纯合、杂合品系,成为与 TYLCV 抗性基因紧密连锁的共显性标记,可以方便、快捷、可靠地检测大量个体[19]。
本试验选用17份番茄材料,通过苗期人工接种黄化曲叶病毒,从病情指数、防御酶活性的变化、抗性基因的检测三方面研究番茄材料对番茄黄化曲叶病毒病的抗性,为筛选和培育番茄黄化曲叶病毒病抗病番茄材料提供理论基础。
1 材料与方法
1.1 材 料
供试的15份番茄育种材料由甘肃张掖益新泉蔬菜育种公司提供,编号分别为801、802、803、805、806、817、818、819、820、822、841、842、853、857、867。‘齐达利’(先正达种子公司提供)为阳性对照,‘Money Maker’(MM)(中国农业科学院蔬菜花卉研究所鲜食番茄课题组提供)为阴性对照。用于苗期接种的 TY-DNA 侵染性克隆 pBin-PLUS-1.7A+2β(农杆菌)引自浙江大学周雪平教授实验室。
1.2 方 法
1.2.1 番茄苗的培养 将以上17份番茄材料种子用10%次氯酸钠溶液浸泡10 min,于2019年4月9日播种于50孔的育苗穴盘中,置于甘肃农业大学育苗基地培养,当番茄幼苗长出1~2片真叶时,将其定植于花盆中。
1.2.2 pBin-PLUS-1.7A+2β的培养 准备含 Kan(50 mg/L)和 Rif(50 mg/L)的固体 LB 培养基和液体LB培养基,取含 pBin-PLUS-1.7A+2β的农杆菌菌液,在固体LB培养基上涂板,静置于28 ℃培养箱,倒置暗培养,待长出单菌落,挑取之于LB液体培养基中,200 r/min 28 ℃培养,过夜摇菌。当菌液 600 nm波长处的吸光值达0.6~0.8时,可用于注射接种。
1.2.3 接种病毒 接种前一天给幼苗浇足水,使叶片细胞吸水饱胀,便于注射侵染。接种时采用叶片人工注射接种。将容量为1 mL的注射器去除针头,吸取菌液,番茄叶背压力注射至可观察到菌液渗入,每株 0.2 mL左右,每个番茄材料幼苗各接种20株。接种后20、30、40 d调查发病情况并取番茄叶组织,进行苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、多酚氧化酶(PPO)的活性测定,试验设3次重复。
1.3 测定项目与方法
1.3.1 番茄材料病情调查与分析 病情分级参照 Lapidot等[20]的抗性分级方法:0级,植株正常生长;1级,新叶轻微卷曲,发皱,其他正常;2级,叶片一定程度上黄化,发皱;3级,叶片大面积黄化卷曲,植株矮化;4级,植株严重矮化,叶片卷曲黄化严重,植株停止生长。根据通用的番茄病毒病群体分级标准[21],分为免疫(I,不表现症状,病情指数为 0)、高抗(HR,0 < 病情指数≤2)、抗病(R,2 < 病情指数≤15)、中抗(MR,15 < 病情指数≤30)、感病(S,30 < 病情指数≤100)。病情指数计算参照以下公式:
病情指数(DI)=∑(发病株数×发病级数)/(调查总株数×最高病级数)×100%
病株率=发病株数/调查总株数 ×100%
1.3.2 防御酶活性的测定 POD活性测定采用愈创木酚法;PPO 活性测定及PAL活性测定参照李翠丹等[22]的方法。
1.3.3 抗性基因的检测 于2019年5月15日,分别取17份番茄材料的新鲜组织,用液氮速冻,用试剂盒方法提取叶片的总DNA,试剂盒购自天根生物公司。用于番茄抗病基因检测的引物一共有3对,参考蒋振等[15]、Garcia等[23]、Ji 等[24],分别为Ty-1、Ty-2、Ty-3,由北京奥克鼎盛生物公司合成,引物序列及扩增长度见表1。PCR体系为20μL ,其中模板DNA 1μL、Master Mix10 μL、上游引物1 μL、下游引物1 μL、ddH2O 7 μL。PCR扩增反应程序:94 ℃变性3 min后开始循环,94 ℃变性30 s,53 ℃退火1 min,72 ℃延伸1 min,34个循环结束后,72 ℃继续延伸 5 min。PCR产物于 1.0% 琼脂糖凝胶电泳 25 min(150V),最后用Goldview染色,凝胶成像系统拍照。
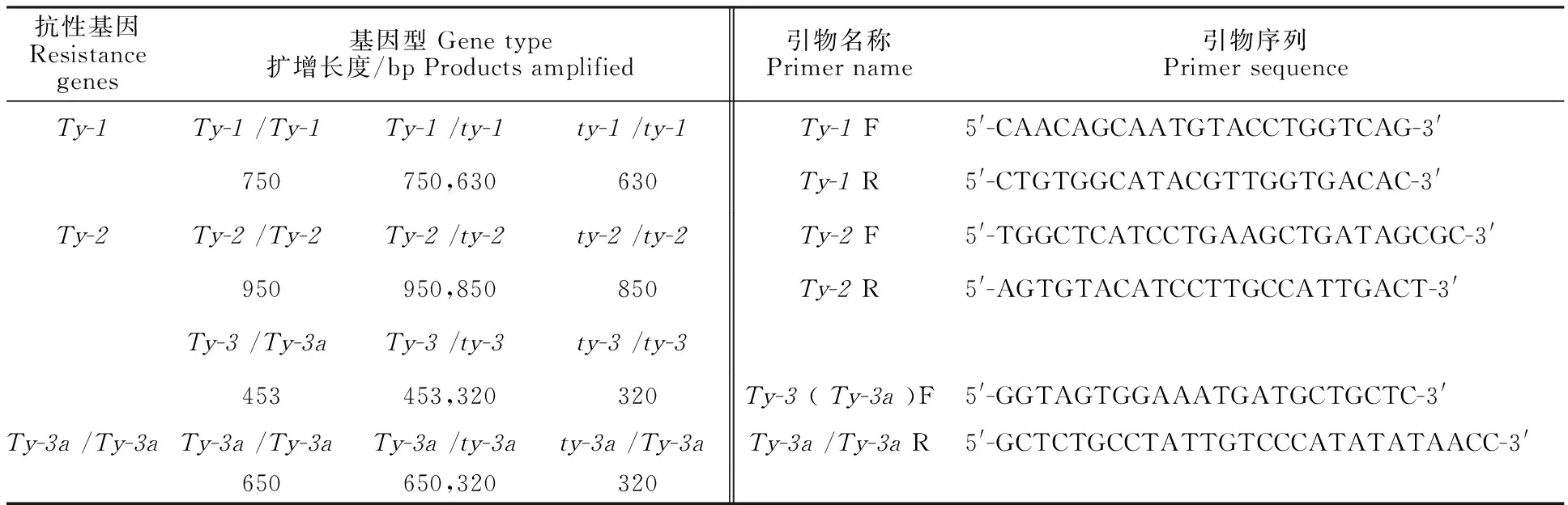
表1 抗性基因名称、基因型及所需引物统计Table 1 Resistance gene name,genotype and required primer statistics
1.4 数据处理
每组数据设定3个重复,采用 Microsoft Excel(2016 版) 计算试验数据并作图,用SPSS 19.0 软件对数据进行单因素方差分析,并运用 Duncan’s 检验法进行多重比较。
2 结果与分析
2.1 病情调查及分析
从表2可以看出,随着时间的推移,除免疫和高抗材料外,其他材料的病株率和病情指数均呈上升趋势,第20天到第30天上升趋势最快并在第40天时达到峰值;接种第20天时,805、817、819、820、841、842表现为高抗,853、857、867表现免疫,证明在感病初期对番茄黄花曲叶病毒病是有一定抗性的;接种第30天时,感病材料病株率和病情指数上升明显,801、802、806、822、阴性对照MM发病率和病情指数均较高,与其他材料有显著性差异(P<0.01 ,P<0.05);接种第40天时,大部分感病材料病株率和病情指数有缓慢上升并趋于平稳,感病情况较第30天时变化不大,证明在第40天时已经充分发病。801、802、 803、806、822、阴性对照材料MM病株率和病情指数达到峰值,发病最为严重,与其他材料有显著性差(P<0.01,P<0.05),是较为典型的感病品种。
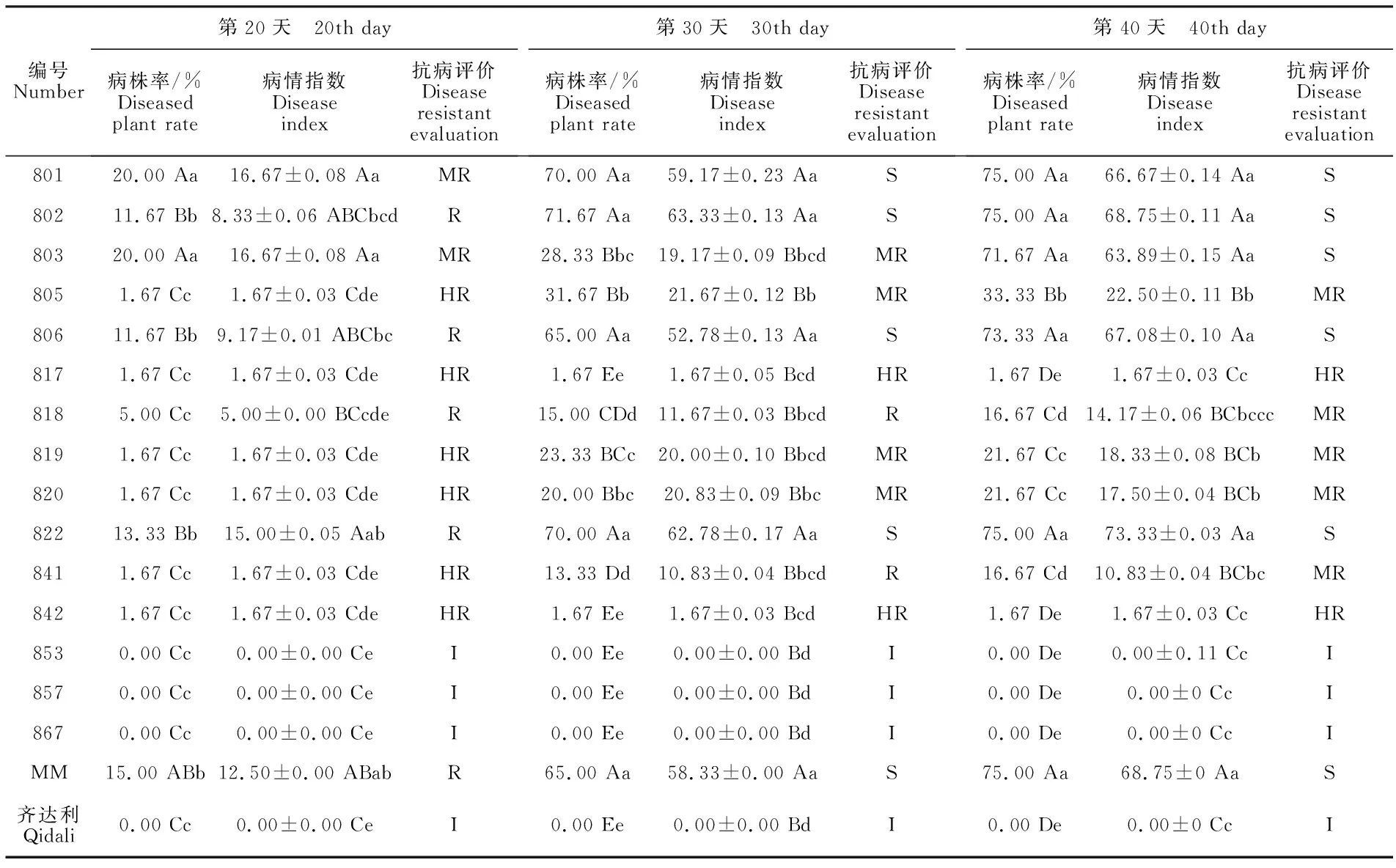
表2 不同时期番茄材料病情调查结果Table 2 Investigation result of tomato materials in different periods
2.2 番茄幼苗叶片内防御酶活性与抗病性的关系
2.2.1 PAL活性与抗病性的关系 由图1可以看出,801、805、817、818、820、842随着时间的推移,酶活性呈现先升高后降低的趋势并在第30天时达到峰值;阳性对照材料齐达利、802、803、806、819、822、841、853、857、867随着时间的推移,酶活性则呈现逐步降低的趋势并在第20天时达到峰值,说明这些番茄材料在发病初期就启动了防御酶系统;阴性对照材料MM酶活性随着时间的推移则呈现逐步上升的趋势并在第40天时达到峰值;阳性对照材料‘齐达利’的酶活性同其他材料相比有显著性差异(P<0.05)。
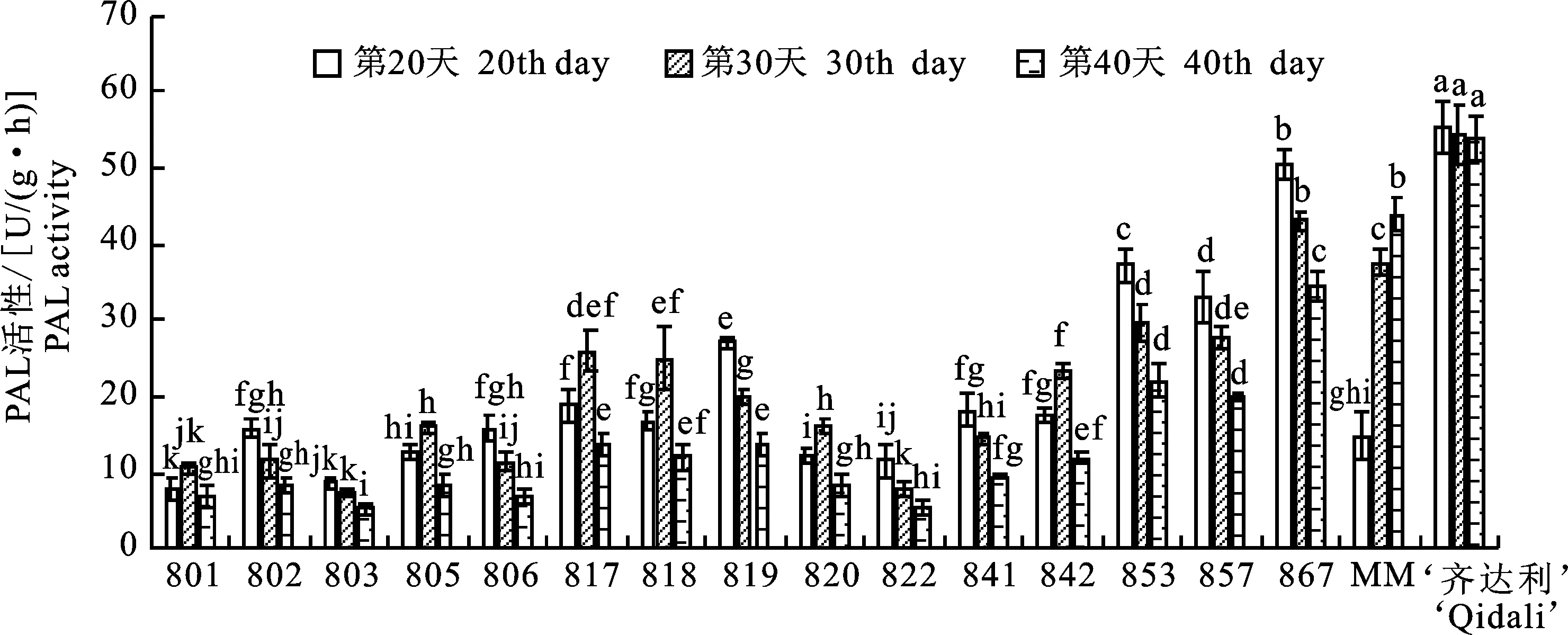
图1 不同番茄材料苯丙氨酸解氨酶(PAL)活性Fig.1 Phenylalaninase (PAL) activity of different tomato materials
2.2.2 PPO活性与抗病性的关系 由图2可以看出,801、803、817、822、841、842随着时间的推移,酶活性呈现先升高后降低的趋势并在30 d时达到峰值;阳性对照材料齐达利、阴性对照材料MM、802、805、806、818、819、820、853、857、867、857、867随着时间的推移,酶活性则呈现逐步降低的趋势并在20 d时达到峰值;阳性对照材料齐达利、857、867的酶活性同其他材料相比有显著性差异(P<0.05)。
2.2.3 POD活性与抗病性的关系 由图3可以看出,17份番茄材料随着时间的推移,酶活性呈现逐步降低的趋势并在20 d时达到峰值,阳性对照材料齐达利的酶活性同其他材料相比有显著性差异(P<0.05)。
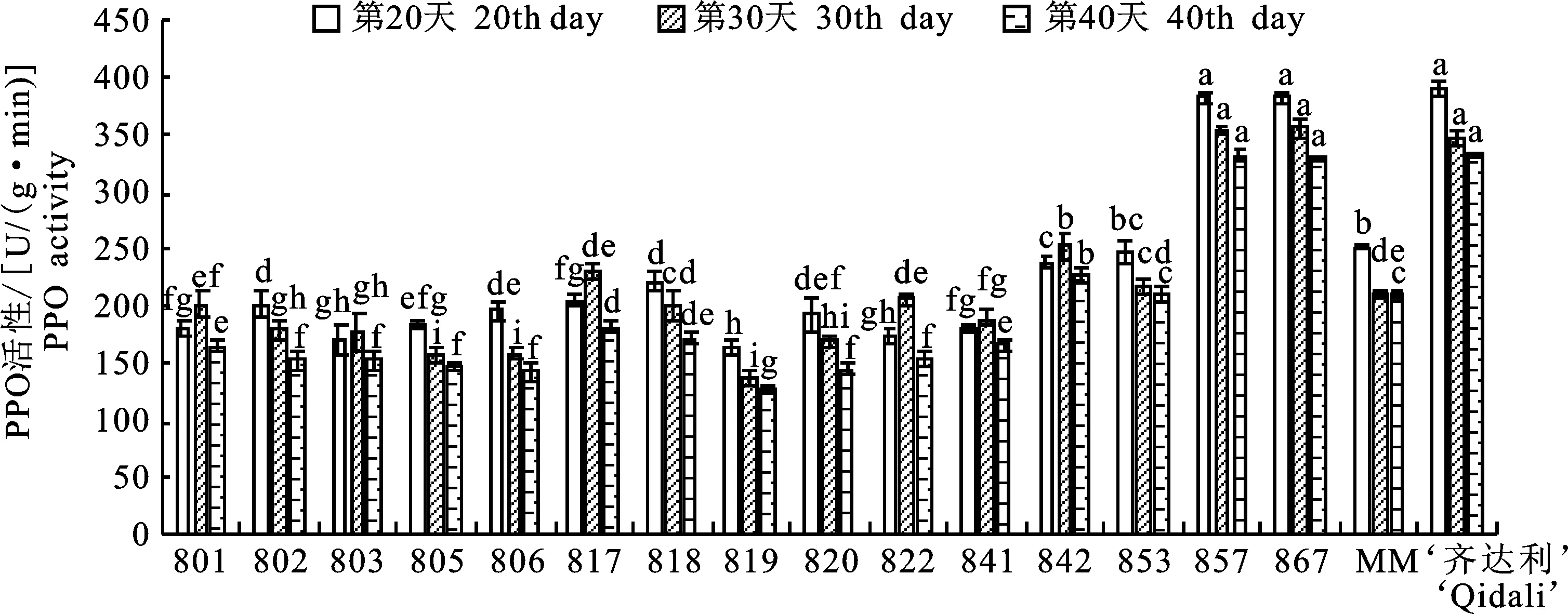
图2 不同番茄材料多酚氧化酶(PPO)活性Fig.2 Polyphenol oxidase (PPO) activity of different tomato materials
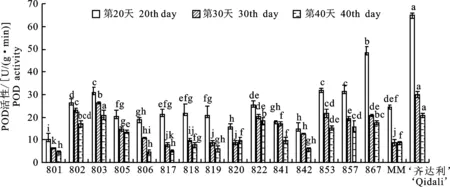
图3 不同番茄材料过氧化物酶(POD)活性Fig.3 Peroxidase (POD) activity of different tomato materials
2.3 番茄材料抗性基因的检测
由图4可知,对17份番茄材料进行PCR扩增,818、820、853、857、867和‘齐达利’扩增出约750 bp的条带,均为纯合显性材料Ty-1/Ty-1。801、802、803、805、806、817、819、822、841、842扩增出约630 bp的条带,均为纯合隐性材料Ty-1/Ty-1。MM不含Ty-1基因;801、802、803、805、806、817、818、819、820、841、842、853、857、867和‘齐达利’扩增出约850 bp的条带,均为纯合隐性材料Ty-2/Ty-2。822和MM不含Ty-2基因;853、857、867扩增出约450 bp的条带,均为纯合抗病材料Ty-3/Ty-3。 801、802、803、805、806、817、818、819、820、841、842扩增出约320 bp的条带,均为纯合隐性材料Ty-3/Ty-3。阳性对照材料‘齐达利’为杂合抗病材料Ty-3/Ty-3,阴性对照材料MM不含Ty-3基因。
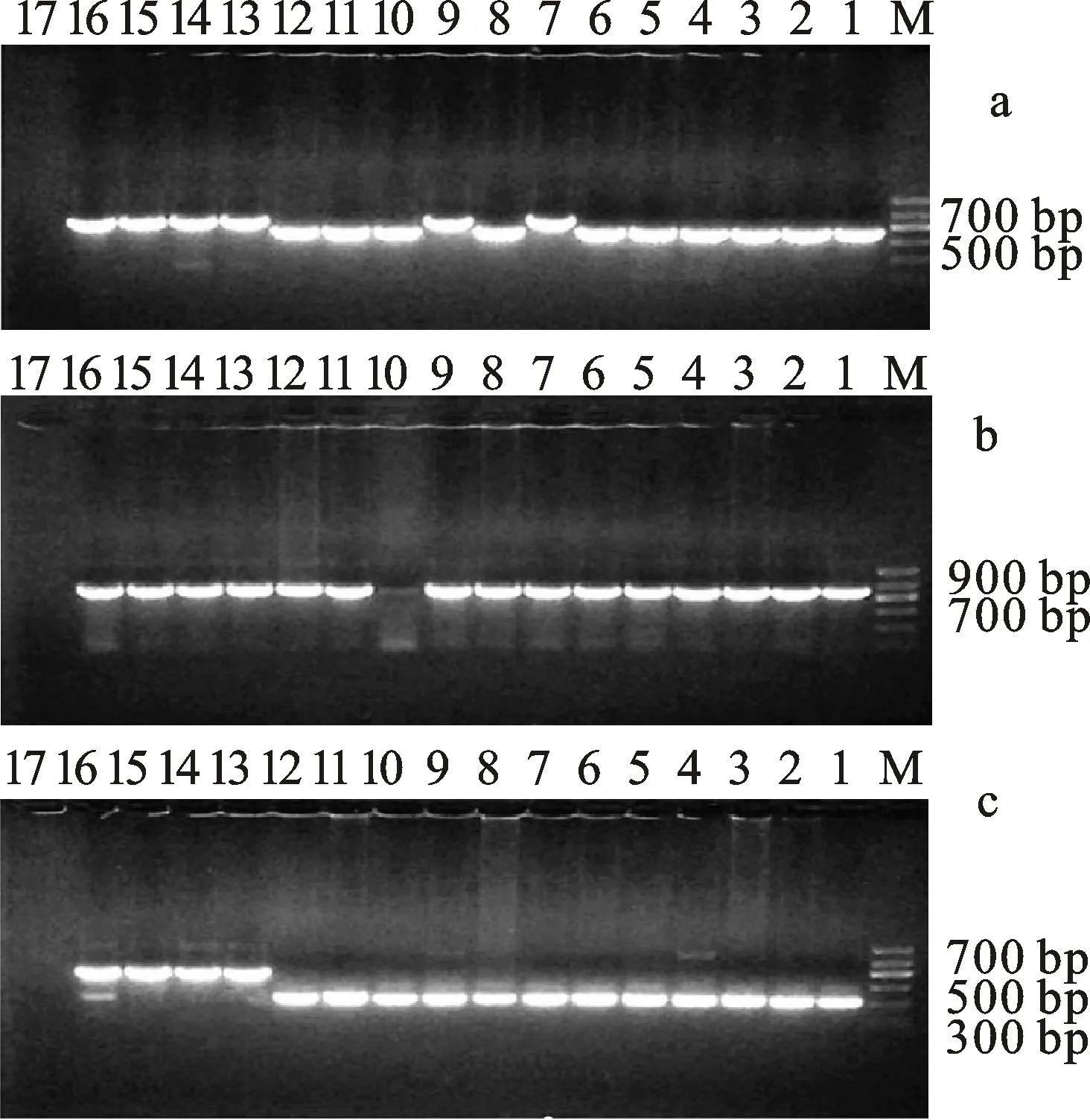
a. Ty-1PCR扩增产物; b. Ty-2 PCR 扩增产物; c. Ty-3/ Ty-3a PCR扩增产物;1-17.分别为番茄材料801、802、803、805、806、817、818、819、820、822、841、842、853、857、867、阳性对照‘齐达利’及阴性对照MM;M.marker
3 讨 论
近几年,番茄黄化曲叶病毒病逐渐成为影响番茄产量的限制因素。随着生物技术的不断发展,在抗黄化曲叶病毒病抗性基因及其相关抗病机理方面取得的研究成果,为抗病育种方面提供了扎实的理论基础[25]。
如何对番茄材料进行客观的抗性评价对选育新品种至关重要。本研究选用农杆菌接种黄化曲叶病毒,对不同的番茄材料进行病情指数调查、防御酶活性测定及抗性基因的检测。结果表明,随着时间的推移,除853、857、867对番茄黄化曲叶病毒毒病表现为免疫外,其他材料均不同程度的发病且病情指数呈上升趋势,与郑积荣等[19]研究结论一致。对黄化曲叶病毒病表现为免疫的853、857、867均在接种后的初期防御酶活性达到峰值,说明可能是由于早期防御反应出现较早,酶促反应速度快,催化诱导形成的酚类物质积累早,而其他感病材料不同程度感病且峰值出现较晚,这与马艳玲等[26]在黄瓜枯萎病抗性研究中得出的结论相同。而防御酶的启动作为植物抗病的一个表现,在实际栽培中可根据发病高峰期到来的时间,合理安排施用化学药物进行防治。TYLCV 属于双生病毒,是一种重组极度频繁的植物病毒[27],导致了该病毒极易发生变异,不同番茄材料所含抗性基因不同,其表现的抗性水平也不同[28-31]。本试验结果表明,只要含有抗性基因的材料,都表现出不同程度的抗性,而不含任何抗性基因的阴性对照材料MM发病率和病情指数则高于其他材料;对番茄黄化曲叶病毒病表现为免疫的853、857、867均含有纯合的Ty-1、Ty-3基因,且Ty-1和Ty-3作为一对等位基因,被认为是抗黄化曲叶病毒病的主效基因[32]。目前,中国育种工作者育成一些抗 TYLCV 的番茄品种。这些抗病品种一般也是基于Ty-1和Ty-3抗性基因[33]。因此在 TYLCV 为害严重的地区应尽量选择含纯合Ty-1和Ty-3基因的品种进行栽培。
4 结 论
本研究从表型、生理、分子水平分析17份番茄材料在不同抗病时期的抗病表现并对其所含的抗性基因进行鉴定,筛选出3个免疫材料(853、857和867)和2个高抗材料(817和842),3个免疫材料均含有纯合Ty-1、Ty-3基因且防御酶活性较其他材料高,峰值出现较早。番茄黄化曲叶病毒变异快,不同地区病毒种类有差异,在育种过程中还需培育多抗基因聚合品种,提高番茄对黄化曲叶病毒病的抗性,是番茄抗病育种中的一个重要研究目标。

