长枝木霉T6菌株对美洲南瓜枯萎病菌的抑制作用
刘 佳,张 悦,沈志彦,张树武,薛应钰,梁巧兰,陶 飞,徐秉良
(甘肃农业大学 植物保护学院/甘肃省农作物病虫害生物防治工程实验室,兰州 730070)
美洲南瓜(Cucurbitapepo)为一年生蔓生草本植物,因其含有多种营养成分,具有很高的食用和药用价值,在中国大部分地区普遍栽培[1]。甘肃省武威市是美洲南瓜的重要育种研发和生产基地,也是当地重要的经济作物之一[2]。瓜类枯萎病(Fusariumwilt)是瓜类生产上最难防治的土传性病害之一[3],该病在大多数瓜类种植区均有发生,发病后会造成减产,甚至全田毁灭,且防治困难。因此,枯萎病的危害是瓜类生产上急需解决的重要问题,也成为限制美洲南瓜生产的重要因素之一[4]。
目前,对枯萎病的防治主要以化学防治为主,然而长期使用化学农药容易造成农药残留,易使植株产生抗药性,此外,还会危害人畜健康,造成环境污染等[5]。生物防治污染小、适用范围广,对环境干扰小,能够有效抑制病原菌,这些特点与国家的绿色农业发展要求高度一致,近年来得到迅速推广[6]。有研究表明,复配芽孢杆菌(解淀粉芽孢杆菌Bacillusamyloliquefaciens+枯草芽孢杆菌Bacillussubtilis)具有很强的拮抗活性,能够有效防治撑绿杂交竹枯萎病[7]。伊海静等[8]研究表明,寡雄腐霉(Pythiumoligandrum)对草莓枯萎病菌具有很好的抑制效果。潘俊等[9]发现,荧光假单杆菌(Pseudomonasfluorescence)和枯草芽孢杆菌(Bacillussubtilis)的组合对石榴枯萎病有很好防治效果,而单用荧光假单杆菌(Pseudomonasfluorescence)的防治效果相对 较差。
瓜类枯萎病多为土传病害,对土壤进行大面积的药剂处理在生产中难以实现。因此,采用高效、安全、环境友好型生物制剂成为研究的热点。有研究[10]表明:解淀粉芽胞杆菌(Bacillusamyloliquefaciens)Lh-1对西瓜枯萎病具有较好的防治效果。侯圆圆等[11]以绿针假单胞菌(Pseudomonaschlororaphis)G5菌株为生防因子来研究对瓜类枯萎病的防治。朱育菁等[12]研究表明,枯草芽孢杆菌(Bacillussubtilis)NH-BS-2000对瓜类枯萎病同样具有一定的防治效果。
木霉菌(Trichodermaspp.)作为一种具有重要开发价值的自然资源正逐渐被农业生物防治领域研究、开发和利用[13]。谷祖敏等[14]发现,将绿色木霉(Trichodermaviride)与菇渣和牛粪复配,不仅可以显著提高木霉对黄瓜枯萎病的防病效果,而且对黄瓜生长具有促生作用。也有报道指出,添加少量营养元素为增效剂的木霉菌多功能生防菌剂、哈茨木霉菌Ta22(Trichodermaharzianira)和绿色木霉菌T23(Trichodermaviride)对甜瓜、黄瓜、西瓜枯萎病均具有很好的防治效果,防效均达到66%以上[15]。但是有关木霉菌对美洲南瓜枯萎病防治的研究报道较少。因此,本试验对长枝木霉T6菌株对美洲南瓜枯萎病菌的抑制作用及防治效果进行研究,为美洲南瓜枯萎病的生物防治提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试病原菌 美洲南瓜枯萎病菌,从甘肃省武威市金苹果有限责任公司种质资源试验基地患枯萎病的美洲南瓜中采集,由甘肃农业大学植物保护学院植物病原学实验室分离,并鉴定为尖孢镰孢菌(F.oxysporum)。
1.1.2 供试生防菌 具有自主知识产权的生防长枝木霉T6菌株(Trichodermalongibrachiatum,CGMCC.No.13183),由甘肃农业大学植物保护学院植物病原学实验室分离、保存。
1.1.3 供试培养基 PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂15 g、蒸馏水1 000 mL。
PDB培养基:马铃薯200 g、葡萄糖20 g、蒸馏水1 000 mL。
1.2 试验方法
1.2.1 长枝木霉T6菌株对美洲南瓜枯萎病菌的抑制作用 将长枝木霉T6菌株和美洲南瓜枯萎病菌活化,分别置于28 ℃恒温培养箱培养。培养7 d后,在菌落最外层取直径为5 mm的长枝木霉T6菌株菌饼,与美洲南瓜枯萎病菌菌饼对接于PDA培养基中,两菌饼间隔3.5 cm[16]。以长枝木霉T6菌株纯培养、美洲南瓜枯萎病菌纯培养菌落作为对照,每组设立5个重复。置于 28 ℃的恒温培养箱中培养7 d,定期观察两种菌的生长情况,观察并记录其生长半径。
菌丝生长抑菌率=(美洲南瓜枯萎病菌菌落直径-木霉处理菌落直径)/美洲南瓜枯萎病菌菌落直径×100%
1.2.2 长枝木霉T6菌株对美洲南瓜枯萎病菌拮抗作用方式观察 在PDA培养基中央放置一块20 mm×20 mm的无菌盖玻片,在无菌盖玻片左右两侧20 mm处分别接种长枝木霉T6菌株和美洲南瓜枯萎病菌,设置12个重复。将接种好的培养皿放置在28 ℃恒温培养箱中培养,培养 3 d时,取下盖玻片,放在载玻片上,用光学显微镜观察两种菌菌丝之间的作用方式,并分别用照相机(Canon 100D)和生物显微成像分析系统(Nikon E200-2MV-U2)拍照。
1.2.3 长枝木霉T6菌株发酵液对美洲南瓜枯萎病菌分生孢子萌发的影响 将长枝木霉T6菌株发酵液与制备好的美洲南瓜枯萎病菌分生孢子悬浮液(浓度为1×105cfu·mL-1)[17]按1∶1的比例混匀,取60 μL滴于PDA平板上,均匀涂布,以无菌水与分生孢子悬浮液混合处理作为空白对照,每组设置5个重复,置于28 ℃的恒温培养箱中培养,分别于6 h、12 h、18 h、24 h统计分生孢子萌发率。
孢子萌发抑制率=(1-孢子萌发数)/孢子总数×100%
1.2.4 长枝木霉T6菌株对美洲南瓜枯萎病的室内防效试验 在玻璃培养皿(直径9 cm)中铺3层灭菌滤纸,用移液器均匀滴加3 mL无菌水于滤纸上,至滤纸浸湿无多余水,分别用75%酒精2 min和3%次氯酸钠5~10 min将美洲南瓜(品种为‘光板’)的种子浸泡消毒,无菌水冲洗后均匀摆在铺好的滤纸上,把培养皿放于 25 ℃、16 h光照、8 h黑暗的恒温培养箱中培养约 7 d。待种子长出1 cm左右长的根后,置于装有灭菌营养土的盆中种植培养。
待培养至4~5叶苗龄时期后,选取长势一致的美洲南瓜苗,将植株根部从花盆中挖出,冲洗干净,用无菌滤纸将水分吸干后用无菌剪刀将植株须根剪掉0.2 cm,造成伤口。利用蘸根法[18],将植株根部全部浸泡在配置好的美洲南瓜枯萎病菌孢子悬浮液(浓度为1×105cfu·mL-1)中30 min[19]。选取一部分接种病原菌的美洲南瓜苗,培养1 d,灌入配置好的长枝木霉T6菌株孢子悬浮液,以无菌水作为对照,处理后美洲南瓜苗重新种进花盆中。培养5 d后,观察并记录3组美洲南瓜苗生长及发病情况。每个处理20株,重复3次。
发病率=发病植株数/调查总株数×100%
病情指数=∑(各级病株数×各级代表值)/(调查总株数×最高级代表值)×100
病情分级标准为[20]:0级,无病症;1级,子叶萎蔫或部分子叶与真叶轻微萎蔫;2级,1片真叶萎蔫或子叶较重萎蔫;3级,子叶及部分真叶萎蔫;4级,整株轻度萎蔫,部分枯死,但是心叶仍然成活;5级,整株严重萎蔫并枯死。
1.2.5 长枝木霉T6菌株对美洲南瓜种子胚根发病的影响 在玻璃培养皿(直径18 cm)中铺3层灭菌纱布,用移液器均匀滴加3 mL无菌水于滤纸上,选取大小、长势一致的美洲南瓜种子均匀摆在滤纸上,把培养皿置于16 h光照、8 h黑暗的25 ℃恒温培养箱中培养3 d。待种子长出胚根后用灭菌的接种针将种子的胚根部表皮轻轻扎破,造成微伤口,在伤口处多次喷美洲南瓜枯萎病菌孢子悬浮液(浓度为1×105cfu·mL-1),恒温培养箱中培养。选取一部分接种病原菌的种子,培养1 d后,在伤口处多次喷长枝木霉T6菌株孢子悬浮液,同样继续放在恒温培养箱中培养。对照组同样刺伤,以无菌水处理,观察并记录种子根系的发病情况。每个处理20粒种子,重复3次。
1.3 数据统计与分析
试验数据利用Microsoft Excel 2010整理,采用SPSS 16.0统计分析软件对数据进行方差分析并做差异显著性检验(Duncan氏新复极差法)。
2 结果与分析
2.1 长枝木霉T6菌株对美洲南瓜枯萎病菌的抑制作用及方式观察
在对峙培养中,长枝木霉T6菌株生长速度较快,覆盖了平板的4/5,表明长枝木霉T6菌株在空间和营养上有明显的竞争优势。和美洲南瓜枯萎病菌的纯培养相比,与长枝木霉T6菌株对峙培养的美洲南瓜枯萎病菌生长活力低下,仅形成较小菌落(图1),经测量计算得知,长枝木霉T6菌株对南瓜枯萎病菌的抑制率为60.09% (表1)。
长枝木霉T6菌株菌落与美洲南瓜枯萎病菌菌落之间形成明显的抑菌带,说明长枝木霉T6菌株对美洲南瓜枯萎病菌具有明显抑制作用(图2-A);显微镜下观察发现长枝木霉T6菌株菌丝已经对美洲南瓜枯萎病菌菌丝发生缠绕(图2-B),表明长枝木霉T6菌株对美洲南瓜枯萎病菌有重寄生作用。
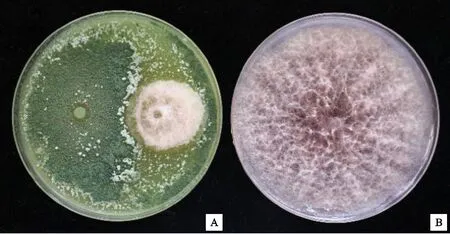
A.长枝木霉T6菌株与美洲南瓜枯萎病菌的平板对峙;B.美洲南瓜枯萎病菌纯培养

表1 长枝木霉T6菌株对美洲南瓜枯萎病菌的抑制作用Table 1 Inhibition of Trichoderma longibrachiatum T6 strain on Fusarium oxysporum
2.2 长枝木霉T6菌株发酵液对美洲南瓜枯萎病菌分生孢子萌发的影响
由表2可知,长枝木霉T6菌株发酵液对美洲南瓜枯萎病菌分生孢子萌发具有明显的抑制作用。当长枝木霉T6菌株发酵液处理24 h后,分生孢子萌发率仅为31.00%,与对照相比,萌发率下降63.10%(P<0.05)。
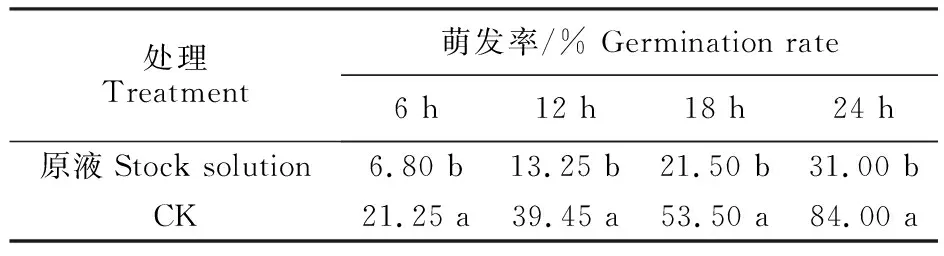
表2 长枝木霉T6菌株发酵液对美洲南瓜枯萎病菌分生孢子萌发的影响Table 2 Conidia germination of Fusarium oxysporum under treatment of fermentation broth of Trichoderma longibrachiatum T6 strain
2.3 长枝木霉T6菌株对美洲南瓜枯萎病的室内防效
如图3-A所示,无菌水处理的美洲南瓜苗生长健康,茎秆有力,叶片舒展肥大;接种病原菌的美洲南瓜苗全部萎蔫倒伏,茎基部变黄萎缩,叶片皱缩变褐(图3-B);接种病原菌后用长枝木霉T6菌株处理的美洲南瓜苗发病情况得到改善,叶片渐渐舒展(图3-C)。
长枝木霉T6菌株对美洲南瓜枯萎病的室内防效结果表明,长枝木霉T6菌株对美洲南瓜枯萎病发病率具有明显的抑制作用,接种病原菌的美洲南瓜苗的发病率高达72.06%,经过长枝木霉T6菌株处理的美洲南瓜苗,发病率降至 28.36%,比对照组下降60.6%;接种病原菌的美洲南瓜苗病情指数高达69.33,处理组的病情指数低至21.45;通过试验得知,长枝木霉T6菌株对美洲南瓜枯萎病具有一定的防治效果,防效达到69.06%(表3)。
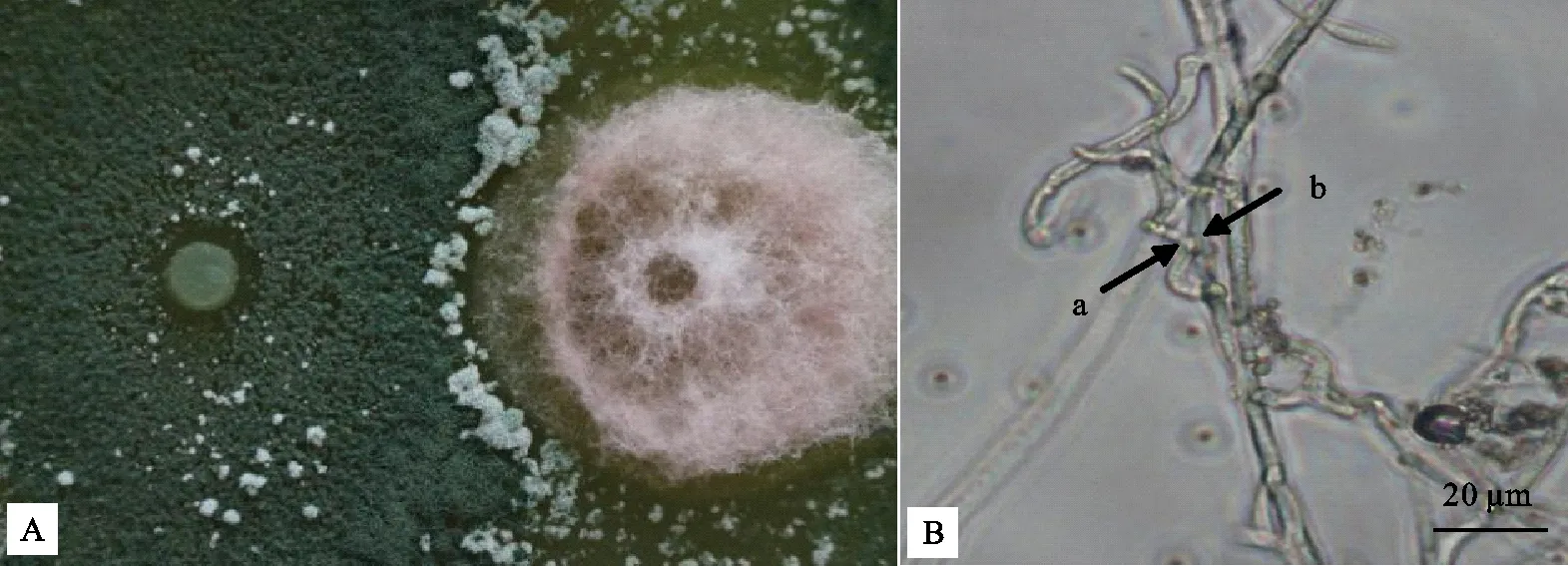
A.病原菌与生防菌间出现明显抑菌带;B.长枝木霉T6菌株菌丝缠绕在美洲南瓜枯萎病菌上生长(a为长枝木霉T6菌株菌丝;b为美洲南瓜枯萎病菌菌丝)
2.4 长枝木霉T6菌株对美洲南瓜种子催芽的影响
美洲南瓜种子未接种病菌时,种子根部和茎基部颜色白,较粗壮,根长且健康(图4-A);接菌后,种子根部和茎基部变黄、萎缩,且生长缓慢甚至停止生长(图4-B);接菌后又经过长枝木霉T6菌株处理的种子根部和茎基部变白,变粗壮,恢复生长活力(图4-C)。

A.健康美洲南瓜种子;B.接种病原菌的美洲南瓜种子; C.发病后经长枝木霉T6菌株处理的美洲南瓜种子
3 结论与讨论
李琳等[21]从胡麻种植土壤中分离出一种SF1生防菌,其对尖孢镰孢菌胡麻专化型真菌的抑菌率达58.99%。刘彩云等[22]研究表明,生防菌LB-1发酵液叶面喷施盆栽苗和浸蘸处理离体叶段,对烟草白粉病的防效和抑制率分别为 44.90%和53.11%。本研究表明,生防菌长枝木霉T6菌株对美洲南瓜枯萎病菌的抑菌率可达 60.09%,对美洲南瓜枯萎病菌分生孢子的萌发率抑制率达到31.00%。侯仙等[23]采用菌液灌根的方法测定生防菌NJZ12-2对棉花黄萎病的室内盆栽防治效果为52.41%~52.81%,本研究同样采用蘸根法测定长枝木霉T6菌株对美洲南瓜枯萎病的室内盆栽防效,防效达到69.06%,表明长枝木霉T6菌株对美洲南瓜枯萎病有较好的防治效果。
据报道,拮抗木霉菌的生防机制包括重寄生作用、抗生作用、竞争作用、诱导抗病性、促生作用和协同拮抗作用[24]。郎剑锋等[25]研究表明,哈茨木霉对小麦纹枯病的生防机制表现为营养竞争、抗生和重寄生作用。本研究亦得到一致的结论,长枝木霉T6菌株生长速度快,快速占领空间,夺取病原菌的营养,阻碍病原菌的生长,显微观察发现,长枝木霉T6木霉的菌丝缠绕在美洲南瓜枯萎病菌的菌丝上,吸取菌丝内的营养物质,分解病原菌,表现为重寄生作用。
本研究结果表明,长枝木霉T6菌株通过竞争空间,养分及菌丝缠绕美洲南瓜枯萎病菌菌丝,达到对美洲南瓜枯萎病菌的抑制作用,同时长枝木霉T6菌株发酵液对该病菌的分生孢子萌发亦具有明显的抑制作用;室内盆栽试验证实长枝木霉T6菌株对美洲南瓜枯萎病的防效达到 69.06%。该研究结果为美洲南瓜枯萎病菌的生防制剂筛选提供一定的理论基础。

