荞麦蜜中挥发性成分测定及其与成熟度的相关性分析
王桃红,张少博,张会敏,赵光跃,李学民,魏玉海,崔宗岩,
(1.秦皇岛海关技术中心,河北 秦皇岛 066004;2.西宁海关技术中心,青海 西宁 810001)
蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,经充分酿造而成的天然甜味物质[1]。蜂蜜具有较高的营养价值,是人们日常消费的主要食品之一。荞麦蜜以荞麦为蜜源植物,含有较多的矿质元素[2]和酚类物质[3]等成分,具有抗菌[4]和抗氧化活性[5],对治疗结肠炎和调节胃肠道功能有一定的效果[2]。蜂蜜风味是衡量蜂蜜品质的重要指标,主要与挥发性成分有关。挥发性物质除与蜂蜜种类[6]、酿造蜂种[7]有关外,还会受到加工工艺[8]、贮存条件和蜂蜜品质的影响,已有研究发现蜂蜜发酵会使挥发性成分发生变化[9-10]。目前国内外对荞麦蜜挥发性成分的研究较少。孙雨安等[11]测定了洋槐、荆条、枣花、椴树、荞麦等蜂蜜中挥发性成分,指出荞麦蜜中顺式-9-二十三烯含量远高于枣花蜜。Pasini等[12]利用顶空固相微萃取-气相色谱-质谱(headspace solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)技术在荞麦蜜中共检测出100 种挥发性成分,其中3-甲基丁酸为荞麦蜜主要挥发性成分。Panseri等[13]研究了意大利阿尔卑斯地区的荞麦蜜中挥发性成分和花粉来源的关系。Plutowska等[14]发现波兰荞麦蜜中特征挥发性成分为2-甲基丁醛和3-甲基丁醛。由于仪器条件和样品量的限制,对荞麦蜜挥发性成分缺乏全面的测定与分析,所以,建立有效的方法对荞麦蜜挥发性成分进行系统的分析显得很有必要。
目前,应用较广泛的挥发性成分提取方法主要有SPME法[15-17]、超声波辅助萃取法[18-19]、同时蒸馏萃取法[20]、固相萃取法[21]和溶剂萃取法[22]等。SPME作为一项新型的萃取方法,以其检测时间短、不引入萃取溶剂污染样品、高灵敏度等优势被广泛应用于蜂蜜挥发性成分的分析测定。
本实验利用HS-SPME-GC-MS法对中国产区的14 批荞麦蜜的挥发性成分进行测定,系统分析挥发性成分的组成种类和含量,比较分析不同成熟度荞麦蜜挥发性成分的差异。
1 材料与方法
1.1 材料与试剂
1.1.1 蜂蜜样品
实验所用荞麦蜜样品均于2017—2018年采自内蒙古地区。样品采集后在检测前置于-20 ℃条件下保存。详细信息见表1。
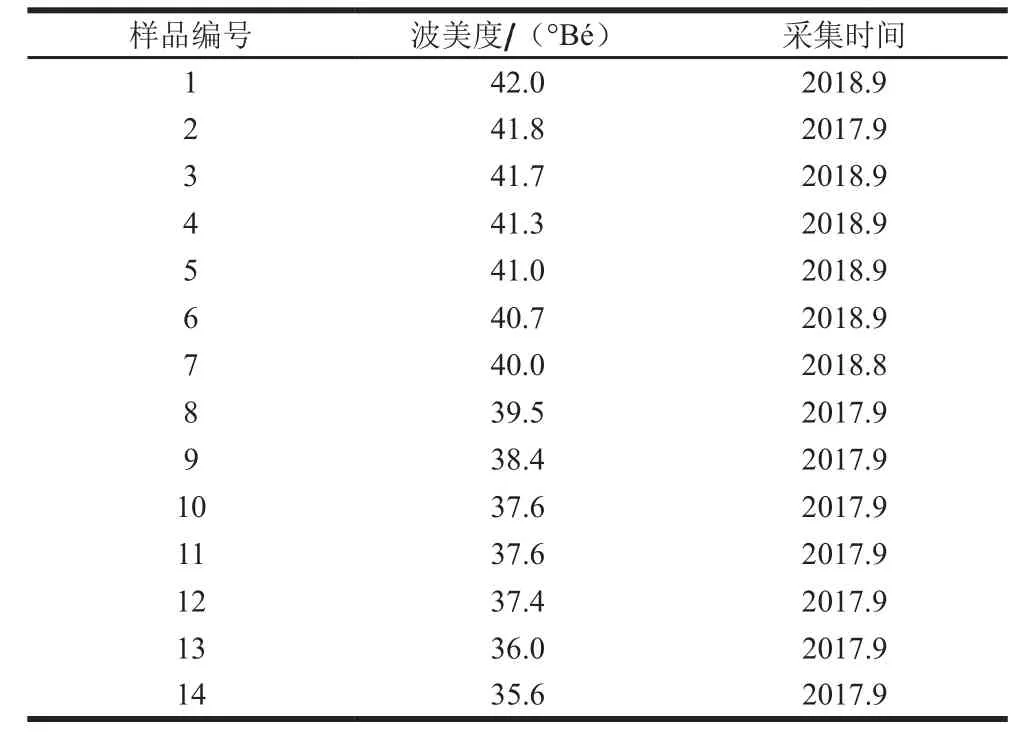
表1 荞麦蜜样品采集信息Table 1 Information about the collected buckwheat honey samples
1.1.2 试剂
乙醇、2-甲基丁醇标准品 美国Sigma-Aldrich公司;实验用水为超纯水。
1.2 仪器与设备
50/30 μm二乙烯基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)萃取纤维 美国Sigma-Aldrich公司;20 mL顶空瓶(配制硅胶/聚四氟乙烯隔垫和20 mm铁盖) 德国Gerstel公司;压盖器和启盖器 美国CNW公司;7890B-5977B型GC-MS联用仪(配制分流/不分流进样口和SPME专用衬管)、DB-5MS毛细管柱(30 m×0.25 mm,0.25 μm) 美国Agilent公司;MPS多功能样品前处理平台(配制自动化HS-SPME手柄)德国Gerstel公司。
1.3 方法
1.3.1 样品处理
准确称取(2.0±0.1)g蜂蜜样品于20 mL顶空瓶中,密封后置于样品前处理平台上进行SPME。
1.3.2 SPME条件
萃取纤维选用50/30 μm DVB/CAR/PDMS,实验前在270 ℃条件下老化30 min,萃取温度60 ℃,萃取时间45 min,平衡时间10 min,振荡速率250 r/min,进样口解吸时间5 min。
1.3.3 GC-MS条件
GC条件:进样口温度270 ℃,不分流进样;载气为高纯氦,流量1.0 mL/min;升温程序为初始温度40 ℃保持3 min,以3 ℃/min升温至160 ℃,然后以10 ℃/min升温至270 ℃,保持6 min,总运行时间为60 min。
MS条件:电子电离源;电子能量70 eV;离子源温度230 ℃;传输线温度270 ℃;数据采集方式:全扫描模式,质量扫描范围m/z25~450。选择离子模式,乙醇定量离子m/z31,定性离子m/z45、29、46,其丰度比为100∶51∶30∶22,2-甲基丁醇的定量离子为m/z57,定性离子为m/z41、56、70,其丰度比为100∶88∶88∶42。
1.3.4 定性方法
本研究主要采用如下2 种方法对目标化合物进行定性:
NIST库检索:判定目标化合物时,将目标色谱峰对应的质谱图扣除背景空白后,进行NIST 14谱库检索,正相和反相匹配度均在800以上,且相似度得分值最高的化合物,即认定为目标物,因色谱柱固定相流失带来的硅氧烷类化合物,不计在内。
保留指数定性:保留指数主要表示待测的目标物质在固定相上的保留行为,它与固定相的性质有关[23]。虽然GC-MS联用技术结合了色谱的分离能力强和质谱的鉴别能力高的特点,提高了化合物定性的高效性和准确性,但由于部分化合物具有同分异构体或结构极为相似,其质谱图差异不大,仅通过NIST谱库检索经常会出现因化合物得分相似而导致定性结果出现偏差。在这种情况下,利用保留指数可提高判断的准确性。
1.3.5 定量方法
采用面积归一化法对蜂蜜中挥发性成分的相对含量进行测定,对GC-MS总离子流色谱图中目标峰进行积分和计算峰面积,每个目标峰的面积与总峰面积之比,即为该目标物的相对含量。未准确定性的化合物标记为未知峰,柱流失带来的色谱峰不计在目标峰内。采用基质标准曲线法对特征化合物乙醇和2-甲基丁醇进行绝对定量。
2 结果与分析
2.1 GC-MS条件优化
2.1.1 色谱柱的选择
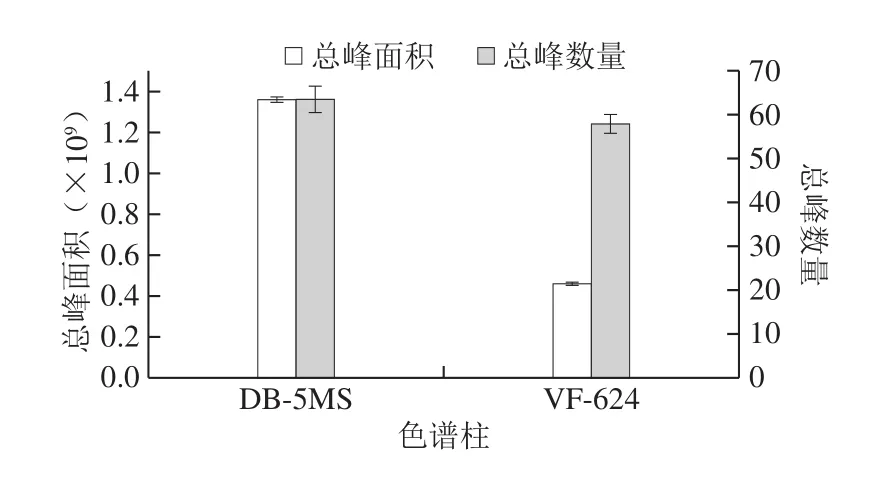
图1 VF-624和DB-5MS色谱柱对总峰面积和总峰数量的影响Fig. 1 Effect of chromatographic columns VF-624 and DB-5MS on peak area and number
色谱柱的选择直接影响检测到目标物的种类和数量,也会对目标物的检出限产生影响[24]。本研究对挥发性成分检测常用的DB-5MS(30 m×0.25 mm,0.25 μm)和VF-624(60 m×0.25 mm,1.4 μm)色谱柱进行对比分析。如图1所示,DB-5MS色谱柱相对于VF-624色谱柱,在检测目标物的响应以及目标峰的数量上,均具有明显优势,因而实验选择DB-5MS色谱柱用于荞麦蜜中挥发性成分分离测定。
2.1.2 升温程序的选择
在GC-MS检测过程中,影响目标物分离效果和峰形的因素不仅包括进样口温度、检测器温度和柱温[24],升温程序也直接影响着目标物色谱峰的保留时间和分离效果[25]。考察升温程序1(初始温度50 ℃,保持1 min,然后以5 ℃/min速率升至200 ℃,然后以10 ℃/min速率升至270 ℃,保持7 min)和升温程序2(初始温度40 ℃,保持3 min,然后以3 ℃/min速率升至160 ℃,然后以10 ℃/min速率升至270 ℃,保持6 min)对挥发性成分测定的影响,结果如图2所示。不同升温程序对挥发性成分的总峰面积影响不大。由于分析时间越长,化合物色谱峰分离度越好,所以升温程序2的总峰数量较高。综上考虑,在后续的实验中,选择升温程序2。

图2 升温程序对总峰面积和总峰数量的影响Fig. 2 Effect of rising temperature programs on peak area and number
2.2 SPME参数的优化
2.2.1 萃取纤维的选择

图3 萃取纤维对总峰面积和总峰数量的影响Fig. 3 Effect of extraction fiber coatings on peak area and number
SPME的萃取头涂有极性不同的固定相或吸附剂,用极性相匹配的涂层可减少萃取杂质的干扰、提高萃取选择性等[26]。萃取纤维的选择直接决定了萃取目标物的种类和数量。考察常用的50/30 μm DVB/CAR/PDMS、85 μm CAR/PDMS、100 μm PDMS和65 μm PDMS/DVB 4 种不同涂层的萃取头对荞麦蜜挥发性成分萃取效果的影响,如图3所示。DVB/CAR/PDMS和PDMS/DVB纤维对蜂蜜挥发性成分萃取的种类和数量要明显多于另外2 种纤维,与Ceballos[27]和Pérez[28]等报道一致。由于DVB/CAR/PDMS较PDMS/DVB纤维吸附挥发性成分的极性范围更广,在蜂蜜中挥发性成分的研究中应用更为广泛,因而本研究选用50/30 μm DVB/CAR/PDMS萃取纤维。
2.2.2 萃取温度的选择
HS-SPME体系为气、液、固三相体系[27],适当升高萃取温度,可以加快分子运动,缩短分析物组分在三相间达到分配平衡的时间,提高萃取效率,从而提高分析效率和灵敏度[8]。然而当温度升的过高,也会使一些挥发性成分从吸附涂层上脱附,影响SPME的萃取效果,此外,温度过高会使蜂蜜中部分物质成分发生转化,例如,超过70 ℃羟甲基糠醛含量会升高[29],所以选择合适的萃取温度至关重要。考察萃取温度30、40、50、60、70 ℃条件下样品中挥发性成分的萃取效果。如图4所示,在萃取温度不超过60 ℃条件下,随着萃取温度的升高,挥发性成分色谱峰的总面积和总数量逐渐增多,萃取60 ℃和70 ℃条件下目标峰数量变化不大,但峰响应值降低。结合温度过高会使蜂蜜中部分挥发性成分发生变化的情况,实验选择萃取温度60 ℃。

图4 萃取温度对总峰面积和总峰数量的影响Fig. 4 Effect of extraction temperature on peak area and number
2.2.3 萃取时间的选择

图5 萃取时间对总峰面积和总峰数量的影响Fig. 5 Effect of extraction time on peak area and number
萃取时间一般指检测分析物在样品和涂层之间达到分配平衡所需要的时间[30]。在蜂蜜挥发性成分萃取过程中,萃取时间与蜂蜜样品基质、样品体积、不同萃取头性质等因素协同作用而达到萃取平衡[8]。考察萃取时间分别为15、30、45、60、75 min条件下样品中挥发性成分的萃取效果,见图5。在萃取时间不超过45 min条件下,随萃取时间的延长,大部分挥发性成分的色谱峰总面积和总数量逐渐增多,但当萃取时间再延长至60 min或75 min时,目标物响应值变化不大,但目标峰数量略有减少,主要是因为在达到吸附平衡后,萃取纤维头上的某些挥发性成分发生解吸造成[8,31]。所以选取萃取时间45 min。
2.3 荞麦蜜中挥发性成分分析
利用HS-SPME-GC-MS联用技术测定荞麦蜜中的挥发性成分,如图6所示。由表2所示,所有荞麦蜜样品共检测出168 种挥发性成分,其中所有样品的共有物质120 种,主要包括醇类、芳香族类、醛类、酸类、萜烯类、酮类、烷烃类、酯类等,另外有20 个目标峰未鉴定出具体化合物种类(标记为未知峰)。这些物质共同构成了荞麦蜜独特的挥发性成分体系,同时赋予荞麦蜜独特的风味。
图6 荞麦蜜挥发性成分总离子流图Fig. 6 Total ion current chromatograms of volatile components in buckwheat honey
在蜂蜜采收过程中,封盖的成熟蜜仅需经过简单的加热过滤工序即可保存销售,极大程度上防止了营养成分和风味物质的损失[32-33],但水分含量较高的未成熟蜂蜜则需要脱水浓缩加工才能长期保存。一般蜂蜜的成熟度可按波美度的大小衡量。本研究采集在35~42 °Bé的荞麦蜜共14 个样品,对挥发性成分进行比较分析。由图7可以看出,不同成熟度荞麦蜜挥发性成分存在显著差异,推测与波美度存在一定的关系,因而后续分析中将样品分为2 组:即A组(40 °Bé以下,代表成熟度较差的荞麦蜜样品)和B组(40 °Bé以上,代表成熟度较好的荞麦蜜样品),分别包含7 个样品。

图7 荞麦蜜蜂蜜样品中挥发性成分种类Fig. 7 Relative contents of various classes of volatile components in buckwheat honey samples
A组共测定出149 种物质,主要包括酯类、醇类、醛类和酸类等。其中,相对含量较高的物质为醇类、酯类,二者占总含量的74.35%,其中酯类化合物种类最多,为41 种,相对含量占比为39.76%,醇类物质共16 种,相对含量仅次于酯类物质,占总含量的34.59%,酯类和醇类是构成A组荞麦蜜风味的主要物质。在A组荞麦蜜中,相对含量最高的酯类物质为醋酸苯乙酯和3-甲基丁酸乙酯,分别占总含量的16.88%和6.91%,相对含量最高的醇类物质为乙醇,占总含量的19.16%,这3 种物质是A组荞麦蜜的主要挥发性成分。

表2 荞麦蜜中挥发性成分的相对含量Table 2 Relative abundances of volatile compounds in buckwheat honeys

续表2 %

续表2 %
B组共检测出139 种挥发性成分,主要包括醛类、酸类、酮类、醇类和芳香类等物质。其中,醛类和酸类物质含量较高,占总含量的62.36%。其中醛类物质含量占比最高,为42.50%,该结果与Vilma等[34]发现的醛类是蜂蜜风味的主要来源物质一致。酸类物质在B组荞麦蜜中的含量和种类也较多,为19.86%,共15 种。其中含量最高的醛类物质为糠醛,占总含量的24.13%,酸类物质最高的为2-甲基丁酸,占总含量的7.90%。
对荞麦蜜样品挥发性成分进行整体分析,发现2-甲基丁酸在所有荞麦蜜中存在且含量较高,与Panseri等[13]的报道一致,推测2-甲基丁酸是荞麦蜜的特征挥发性成分。Zhou Qiaoxuan等[35]研究发现,英国和美国荞麦蜜中主要挥发性成分为3-甲基丁醛、2,3-丁二酮、苯乙醛、香草醛、甲酚和香豆素等,本研究发现,苯乙醛在所有样品中有检出,3-甲基丁醛在大部分样品中均有检出,但2,3-丁二酮、香豆素和香草醛等在样品中未被检出,推测可能是由于地域不同所致。该结果表明,荞麦蜜挥发性的测定可以作为其产地区分鉴别的一种技术手段。
2.4 不同成熟度荞麦蜜的挥发性成分对比分析
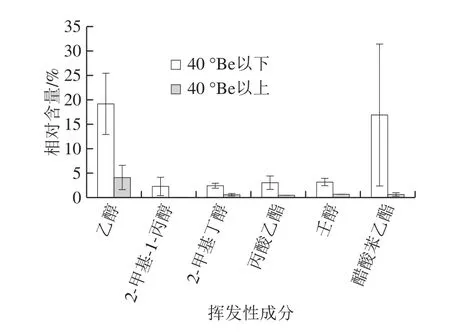
图8 不同成熟度的荞麦蜜中差异挥发性成分Fig. 8 Differences in volatile compounds of buckwheat honeys with different maturity levels
通过对荞麦蜜中挥发性成分进行对比分析,发现不同成熟度荞麦蜜中存在显著差异的物质,其中差异较大的代表性物质含量对比结果见图8。结果表明,2-甲基-1-丙醇只在A组样品中被检测出,而乙醇、醋酸苯乙酯、壬醇、丙酸乙酯、2-甲基丁醇在A组荞麦蜜中相对含量较高,分别为B组荞麦蜜的4.8、31、5.8、8.8、5.1 倍,推测是由于成熟度低的荞麦蜜中酵母菌的存在,蜂蜜中的碳水化合物发酵致使酯类和醇类物质含量升高[9]。

图9 乙醇(A)和2-甲基丁醇(B)与波美度相关性Fig. 9 Correlations of Baume degree with ethanol (A) and 2-methyl-1-butanol (B)
进一步分析代表性差异成分含量与波美度的相关性,结果如图9所示。发现乙醇和2-甲基丁醇的含量与波美度之间存在一定的负相关。随着波美度的增加,乙醇和2-甲基丁醇的含量整体呈递减的趋势,其相关系数(R2)分别达到0.90和0.87。据此说明,乙醇和2-甲基丁醇可以作为指示荞麦蜜成熟度的标志物,其含量越高,则说明荞麦蜜成熟度越差。进一步对乙醇和2-甲基丁醇的含量进行绝对定量,如表3所示。测定结果和相对含量的趋势一致,随着波美度的下降,乙醇和2-甲基丁醇的含量呈现整体增加的趋势,该结果表明,通过对荞麦蜜挥发性成分的测定,了解其特征物质含量,可以为蜂蜜的品质评价提供一定的借鉴参考。

表3 荞麦蜜中乙醇和2-甲基丁醇含量Table 3 Contents of ethanol and 1-butanol, -2-methyl in buckwheat honeys at different maturity levels
3 结 论
本研究建立HS-SPME-GC-MS法测定蜂蜜中的挥发性成分,并应用该技术对中国产区14 批不同成熟度的荞麦蜜挥发性成分进行测定。所有样品中共检测出168 种物质,通过对比分析,发现不同成熟度的荞麦蜜挥发性成分存在明显差异。低成熟度荞麦蜜的主要挥发性成分为酯类和醇类,而构成高成熟度荞麦蜜挥发性体系的主要物质为醛类和酸类。研究发现2-甲基丙醇只在低成熟度荞麦蜜中出现,乙醇、醋酸苯乙酯、壬醇、丙酸乙酯、2-甲基丁醇在低成熟度荞麦蜜中含量明显高于高成熟度荞麦蜜,而且乙醇和2-甲基丁醇的含量与波美度之间存明显的负相关性。结果表明,通过对荞麦蜜挥发性成分的测定,可以为蜂蜜的品质评价提供一定的借鉴参考。

