Ack1和MMP-14在涎腺腺样囊性癌组织中的表达与意义
张 璇,安 峰,马 赛,刘振丽,刘 博
(河北北方学院附属第一医院 1.口腔科;2.病理科,河北 张家口 075000)
涎腺腺样囊性癌(salivary adenoid cystic carcinoma,SACC)是腺源性恶性肿瘤,临床较为多见。它的发生和发展相对较慢,但具有以下特征:强烈的侵袭性,易于沿神经传播,可以侵入血管内,经常复发和可伴远处转移[1]。根据SACC在显微镜下的组织学形态的不同,可将其划分为两型,分别为分化相对良好的腺样/管状型和分化较差的实性型。由于现阶段的研究水平有限,对该肿瘤的发生和发展机制尚不明了,并且该肿瘤侵袭性较强,使得该肿瘤的治疗难度加大,并且无法获得理想的预后,无法保证较长的生存时间。因此,为了得到有效的治疗和理想的预后,对SACC做深入研究很有必要。活化的Cdc42相关酪氨酸激酶1(activated Cdc42-associated tyrosine kinase 1,Ack1)过度表达可激发细胞的肿瘤基因,使其活性和侵袭性增加。基质金属蛋白酶14(matrix metal loproteinase-14,MMP-14)的降解活性是细胞周围环境的有效调节剂,可促进肿瘤的生长和侵袭。本研究应用免疫组化SABC技术检测Ack1和MMP-14在SACC、涎腺正常组织中的表达水平,分析两者与SACC的关系,并研究两者之间是否存在相关性,探寻其在SACC发生发展中可能存在的机制。
1 资料及方法
1.1 资料 实验组的标本采集:收集2013年6月~2018年6月河北北方学院附属第一医院手术切除的标本蜡块。所有标本在术后均经病理检查,诊断为SACC,共49例。病例的临床资料详实且术前3个月内未接受相关抗癌治疗。其中男28例,女21例;年龄43~75岁,中位年龄58岁,≥58岁25例,<58岁24例;组织学(2005年制定的病理学分类标准)类型管状/筛孔型29例,实性型20例;临床分期(UICC唾液腺癌TNM分类分期,2011)Ⅰ~Ⅱ22例,Ⅲ~Ⅳ27例;颈淋巴结转移10例,未转移39例;神经系统侵犯21例,未侵犯28例。
对照组的标本采集:收集手术中切除的24例涎腺正常组织作为本研究的对照标本。
1.2 试剂 上海雅吉生物科技有限公司购买兔抗人Ack1亲和抗体,武汉维克赛思科技有限公司购买兔抗人MMP-14亲和抗体、SABC检测试剂盒、DAB试剂。
1.3 免疫组化 以4 μm的厚度将所有标本(实验组及对照组蜡块)制成实验切片。切片脱蜡至水后在枸橼酸盐缓冲液中煮沸进行抗原修复。PBS缓冲液冲洗,每次5 min,冲洗2次。一抗Ack1、MMP-14稀释浓度均为1∶200,进行SABC法染色(按照说明书操作),苏木精复染,脱水封片。
1.4 结果判定 免疫反应评分法(IRS)对实验结果进行综合评分。具体方法为PP:实验切片中阳性细胞所占总细胞数的百分比,SI:实验切片中细胞的染色强度,两者相乘计算出最终得分(IRS=PP×SI)。在每个切片中选择200倍的随机高倍镜视野10个,并计算出阳性细胞所占总细胞比例,取平均数:无阳性细胞PP计0分,0
1.5 统计学方法 采用SPSS 21.0统计软件进行数据分析。组间数据比较采用卡方检验,指标间相关分析采用Spearman秩相关检验,P<0.05为差异有统计学意义。
2 结果
2.1 Ack1、MMP-14在SACC及涎腺正常组织中的表达 阳性表达产物:Ack1的染色部位主要集中在细胞的胞质和胞膜中,MMP-14的染色部位大多集中在细胞的胞质中。
以免疫组化SABC技术所检测到的Ack1、MMP-14在SACC中的表达情况见图1、2。
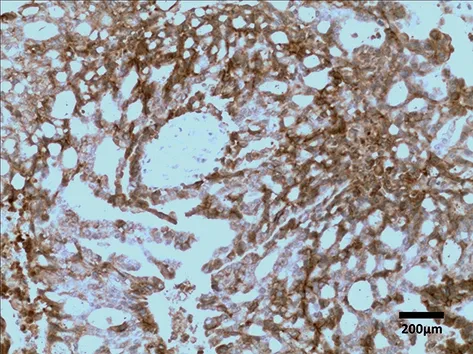
图1 Ack1在SACC中的表达(×100)
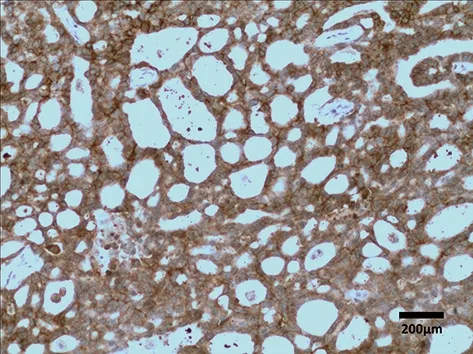
图2 MMP-14在SACC中的表达(×100)
2.2 Ack1、MMP-14在SACC组织中的表达情况及与SACC各临床病理因素之间的相关性 在SACC组织中,Ack1、MMP-14的阳性细胞表达率分别是63.3%、67.3%。在涎腺正常组织中的阳性细胞表达率分别是33.3%、37.5%,且组间差异有统计学意义(P<0.05),见表1。
在SACC组织中,Ack1、MMP-14的表达水平同患者性别和年龄无关(P>0.05)。但与肿瘤的组织学类型、临床分期、肿瘤细胞是否会侵犯到颈部淋巴结以及是否转移至周围神经有关(P<0.05)。见表1。
2.3 SACC组织中Ack1、MMP-14的关系 在SACC组织标本中检测到Ack1、MMP-14同为阳性表达25例,同为阴性表达10例。两者在SACC组织中的表达呈正相关(rs=0.372),差异有统计学意义(P<0.05)。

表1 SACC组织及涎腺正常组织中Ack1、MMP-14的表达情况及与临床病理因素之间的相关性
3 讨论
Ack1由Edward等发现,是一种非受体型的细胞内酪氨酸激酶,在癌细胞存活以及肿瘤形成和转移中具有重要作用。酪氨酸激酶是细胞内信号转导途径的关键调节剂,其活性受到严格控制。染色体易位、过表达或活化突变引起的酪氨酸激酶信号失调可能导致激酶活性和恶性转化的紊乱。其活化可导致细胞不依赖生长因子而大量生长繁殖,细胞凋亡抑制,血管生成,侵袭和转移。酪氨酸激酶的异常激活与人类癌症有因果关系。相关研究发现,Ack1在人乳腺癌[2]、食管癌[3]、前列腺癌[4]和其他肿瘤组织中具有各种水平的表达上调。在胃癌组织中更是存在明显的表达上调[5]。Van等[6]通过实验发现,在相当一部分的人类肿瘤中,包括Ack1基因序列在内的DNA片段碱基对的基因拷贝数目显著增加,并证实了Ack 1基因的明显扩增。Phillips等[7]发现,小鼠肝脏肿瘤中的一系列基因(包括Ack1)通过苯巴比妥的刺激,会发生明显的低甲基化。这种变化是由于肿瘤基因表达上调引起的。本研究显示,Ack1在SACC组织中的表达水平增高,且同SACC的组织学类型、临床分期、肿瘤细胞是否会侵犯到颈部淋巴结以及是否转移至周围神经有关,这表明Ack1可作为判断SACC病情进展的一个依据。
MMP-14又被称为MT1-MMP,是基质金属蛋白酶(MMP)蛋白质家族的成员。MMP是锌结合的内肽酶,负责细胞外空间中许多蛋白质的降解更新。大多数的肿瘤和其周围的基质细胞会过度表达MMP,从而更易突破细胞基底膜(BM)和降解细胞外基质(ECM),这是促进肿瘤生长、局部浸润和远处转移的重要因素[8]。相关研究表明,MMP-14在多种人类肿瘤中的表达水平相比正常组织增高,如结肠癌[9]、肺癌[10]、宫颈癌[11]等,这是由于癌细胞上调了MMP-14的表达和活性,而MMP-14参与各种肿瘤相关的ECM的分解,并在肿瘤的转移过程中及高度侵袭性肿瘤或晚期中渗透BM,从而分解白介素8、CD44、pro-TNF、胶原蛋白、纤连蛋白、玻连蛋白和层粘连蛋白等一系列蛋白。通过不同的信号传导功能(包括凋亡、血管生成和免疫)促进肿瘤进展。本研究显示,MMP-14的表达水平与SACC的组织学类型、临床分期、肿瘤细胞是否会侵犯到颈部淋巴结及是否转移至周围神经有关。提示MMP-14在SACC 组织中同样可以降解ECM,并同其他致癌基因一起突破BM,分解抑癌基因,从而加剧肿瘤的恶性程度及浸润程度,使病情恶化。
将SACC组织中Ack1、MMP-14的表达水平进行综合性的统计学分析后发现,两者呈正相关(r=0.372,P=0.009),提示两者间可能存在通路关系,可能原因为SACC在侵袭及扩散过程中的物理屏障被MMP-14消除,为Ack1基因的扩增提供机会,从而促进肿瘤细胞的表达上调。但Ack1与MMP-14在SACC的发生过程中的具体机制仍需深入研究确定。
综上所述,Ack1、MMP-14在SACC组织中呈现出高表达,并与部分临床病理因素密切相关。在SACC组织中两者的表达水平呈正相关关系。通过分析Ack1、MMP-14在SACC 中的表达水平,有助于我们对SACC的临床诊断。

