多角度深层次复习铜及其化合物
◇ 陈 飞(特级教师)
铜及其化合物的知识在教材中没有系统讲述,零星分散在不同章节里,但是铜及其化合物在生产和生活中有着广泛的用途,能够很好地体现化学学科的核心素养,因此铜的相关知识是高考命题的重点,在高考中频频出现.复习时如果运用“发散思维”,从多角度和多层面进行复习,会有一种“横看成岭侧成峰,远近高低各不同”的感觉,能起到“事半功倍”的效果.本文从不同角度进行归纳整理,供同学们复习时参考.
1 从颜色的角度来复习
【教材寻源】人教版《必修1》第46页图3-2有关金属化学性质的一些实验;第57页图3-14金属的焰色反应;第62页图3-21的铜绿,资料卡片中的铜盐.人教版《必修2》第93页习题3中的蓝铜矿.
【高考链接】(2019年全国卷Ⅱ)下列化学方程式中,不能正确表达反应颜色变化的是( ).
A.向CuSO4溶液中加入足量Zn粉,溶液蓝色消失:Zn+CuSO4=Cu+ZnSO4
B.澄清的石灰水久置后出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O
C.Na2O2在空气中放置后由淡黄色变为白色:2Na2O2=2Na2O+O2↑
D.向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2+2FeCl3=2Fe(OH)3+3MgCl2

向硫酸铜溶液中加入足量锌粉,会发生发下反应:Zn+CuSO4=ZnSO4+Cu,硫酸铜不断减少,溶液的蓝色就会消失,选项A正确;澄清石灰水吸收空气中的CO2生成碳酸钙白色沉淀,选项B正确;过氧化钠与空气中的H2O和CO2发生反应,最终生成白色的Na2CO3,选项C错误;Mg(OH)2和FeCl3可以反应生成溶解度更小的Fe(OH)3,选项D正确.答案为C.
【要点归纳】铜的焰色:绿色.铜及其化合物的颜色:Cu(紫红或暗红),Cu2O(红色),CuO(黑色),CuSO4(白色),CuSO4·5H2O(蓝色),Cu(OH)2(蓝色),CuCO3(蓝色),CuCl(白色),CuCl2(淡绿色),Cu2(OH)2CO3(绿色),[Cu(NH3)4]2+(深蓝色).
2 从物质分类的角度来复习
【教材寻源】人教版《必修1》第26页“科学探究2”:硫酸铜溶液用激光笔照射.
【高考链接】(2017年浙江卷)下列分散系能产生“丁达尔效应”的是( ).
A.稀硫酸 B.硫酸铜溶液
C.氢氧化铁胶体 D.酒精溶液

从物质分类的角度考虑,胶体为分散质粒子直径介于1~100 nm之间的分散系,能够产生丁达尔效应.稀硫酸、硫酸铜溶液和酒精溶液均是溶液,故不能产生丁达尔效应.答案为C.
【要点归纳】分散系可以分为溶液、胶体和浊液,丁达尔效应是胶体的特有性质.
3 从离子反应的角度来复习
【教材寻源】人教版《必修1》第34页第6题和第10题,涉及和铜有关的离子反应方程式.
【高考链接】(2019年江苏卷)下列指定反应的离子方程式正确的是( ).
A.室温下用稀NaOH溶液吸收Cl2:Cl2+2OH-=Cl O-+Cl-+H2O
B.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-=+H2↑
C.室温下用稀HNO3溶解铜:Cu++2 H+=Cu2++2NO2↑+H2O
D.向Na2SiO3溶液中滴加稀盐酸:
Na2SiO3+2H+=H2SiO3↓+2Na+

室温下用稀NaOH溶液吸收Cl2,离子方程式为Cl2+2OH-=ClO-+Cl-+H2O,选项A正确;铝粉和NaOH溶液反应的离子方程式为2Al+2H2O+2OH-=2Al O-2+3 H2↑,选项B错误;室温下用稀HNO3溶解铜的离子方程式为3Cu++8 H+=3Cu2++2NO↑+4 H2O,选项C错误;向Na2SiO3溶液中滴加稀盐酸离子方程式为+2 H+=H2SiO3↓,选项D错误.答案为A.
【要点归纳】铜可以和浓硝酸、稀硝酸等物质发生离子反应.与稀硝酸反应的离子方程式为:3Cu++8H+=3Cu2++2NO↑+4H2O;与浓硝酸反应的离子方程式为Cu++4 H+=Cu2++2NO2↑+2 H2O.Cu O、Cu(OH)2、CuCO3均可溶于强酸,离子反应方程式学生可自己写出.
4 从氧化还原的角度来复习
【教材寻源】人教版《必修1》第35页木炭还原氧化铜,铁和硫酸铜溶液反应.人教版《必修2》第89页表4-1铜的冶炼.
【高考链接】(2017年浙江卷)为探究黑色固体X(仅含2种元素)的组成和性质,设计并完成如图1所示实验.
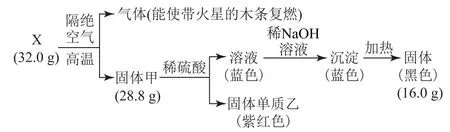
图1
请回答:
(1)X的化学式是________.
(2)固体甲与稀硫酸反应的离子方程式是_________.
(3)加热条件下氨气被固体X氧化成一种气体单质,写出该反应的化学方程式:_______.

根据题中信息,32 g X隔绝空气加热生成了能使带火星木条复燃的气体,则该气体应为氧气,因此可确定X中一定含有氧元素.生成氧气的质量为m=32.0 g-28.8 g=3.2 g,氧气中含有氧原子的物质的量为0.2 mol.甲和稀硫酸反应生成的溶液为蓝色,可知溶液中应该含有Cu2+,说明甲中含有铜元素,故X中也含有铜元素.因此可判断黑色固体X为Cu O,其物质的量为
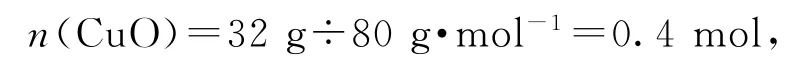
根据氧原子守恒可知,甲中

所以甲的化学式为Cu2O,固体单质乙为Cu,蓝色溶液为CuSO4,加入NaOH生成的沉淀为Cu(OH)2,加热分解得到16.0 g CuO.(1)X为Cu O;(2)Cu2O和稀硫酸反应的离子方程式为Cu2O+2 H+=Cu2++Cu+H2O;(3)加热条件下NH3被CuO氧化成的气体单质应为N2,化学方程式为3Cu+N2+3H2O.
【要点归纳】“铜三角”的氧化还原反应转化关系如图2所示.
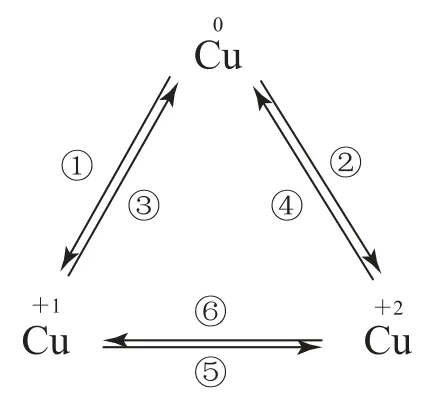
图2

5 从电化学角度来复习
【教材寻源】人教版《必修2》第40页实验2-4铜—锌原电池实验.人教版《选修4》第71页图4-1锌—铜原电池装置;第79页实验4-2电解氯化铜溶液;第81页电镀.
【高考链接】(2019年北京卷)下列示意图与化学用语表述内容不相符的是( )(水合离子用相应离子符号表示).
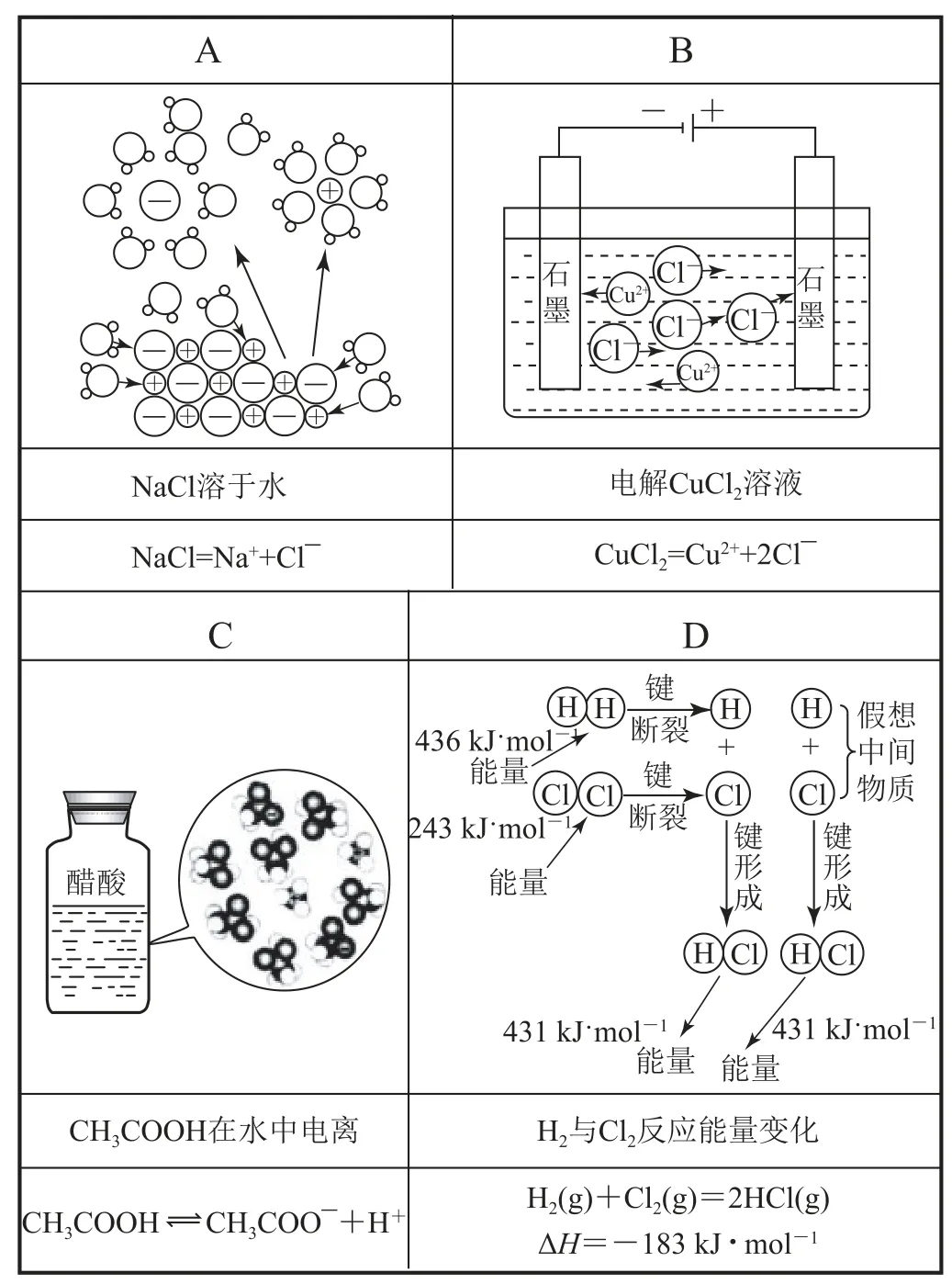

电解CuCl2溶液,是化学变化,反应方程式为,选项B不符合化学用语表述内容;选项A、C、D示意图与化学用语表达内容相符.答案为B.
【要点归纳】1)铜—锌—稀硫酸构成的原电池,负极为锌,正极为铜.
2)电解:①以惰性电极电解硫酸铜溶液和氯化铜溶液:
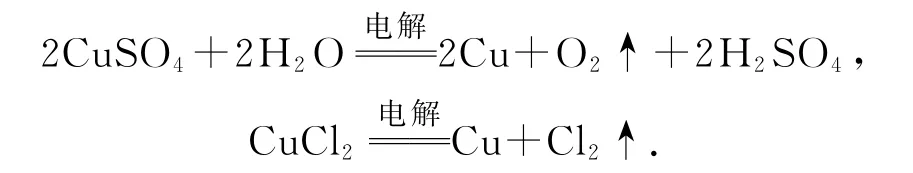
②电解精炼铜:以粗铜为阳极、纯铜为阴极、CuSO4溶液为电解液进行电解,可将粗铜提纯.
③电镀铜:以铜为阳极、镀件为阴极、CuSO4溶液为电镀液,可以在镀件表面镀一层铜.
6 从盐的水解角度来复习
【教材寻源】人教版《选修4》第54页“科学探究1”中可以增加硫酸铜溶液.
【高考链接】(2019年北京卷)实验测得0.5 mol·L-1CH3COONa溶 液、0.5 mol·L-1CuSO4溶液以及H2O的pH随温度变化的曲线如图3所示.下列说法正确的是( ).

图3
A.随温度升高,纯水中c(H+)>c(OH-)
B.随温度升高,CH3COONa溶液的c(OH-)减小
C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同

无论是否升温,纯水均为中性,c(H+)=c(OH-),选项A错误;CH3COONa水解显碱性,升高温度,促进水解,碱性增强,c(OH-)增大,选项B错误;硫酸铜水解显酸性,升温促进水解,酸性增强,c(H+)增加,升温也促进水的电离,水电离生成的c(H+)增加,二者叠加,酸性变化趋势一致,pH=-lgc(H+),c(H+)越大,pH越低,选项C正确;水解吸热,故升高温度CH3COO-、Cu2+的水解平衡都正向移动,硫酸铜溶液的pH降低.升温促进CH3COO-水解,c(OH-)增大,但pH不一定也增大,因为升温也同时促进了水的电离,Kw增大,当Kw增大幅度大于c(OH-)的增大幅度时也增大,pH=,故pH减小,选项D错误.答案为C.
【要点归纳】在铜盐溶液中存在Cu2++2H2O⇌Cu(OH)2+2H+,升高温度,水解平衡向右移动,水解程度增大;随着温度升高,水的电离程度也增大.
7 从催化剂角度来复习
【教材寻源】人教版《选修4》第23页“科学探究1”中硫酸铜作过氧化氢分解的催化剂.
【高考链接】(2019年全国卷Ⅲ,节选)近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长.因此,将氯化氢转化为氯气的技术成为科学研究的热点.
Deacon直接氧化法可按下列催化过程进行:


把上述反应分别标为反应①、②、③,根据盖斯定律,反应4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g)由(反应①+反应②+反应③)×2所得,所以ΔH=(ΔH1+ΔH2+ΔH3)×2=-116 kJ·mol-1.
【要点归纳】本题设计的目的是考查化学反应与能量变化,借助CuCl2作催化剂来加快反应速率.
8 从化学实验角度来复习
【教材寻源】人教版《必修1》第101页,实验4-9中浓硫酸与铜的反应.
【高考链接】(2019年北京卷,节选)化学小组实验探究SO2与Ag NO3溶液的反应.
实验一:用图4所示装置(夹持、加热仪器略)制备SO2,将足量SO2通入Ag NO3溶液中,迅速反应,得到无色溶液A和白色沉淀B.
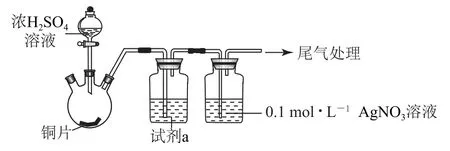
图4
①浓H2SO4与Cu反应的化学方程式是_________.
②试剂a是_________.

Cu和浓硫酸反应,生成的二氧化硫气体中混有酸雾,会对后面的实验造成干扰,故需要用饱和Na HSO3溶液进行洗气.答案为①Cu+;②饱和Na HSO3溶液.
【要点归纳】有关铜及其化合物的实验较多,往往与铜的氧化还原反应及离子反应同时出现.如铜和硝酸反应、氢气还原氧化铜、氨气还原氧化铜、制取硝酸铜、制取硫酸铜、铜绿受热分解、五水硫酸铜受热分解曲线等.通过对实验的分析可以进一步理解铜及其化合物的性质.
9 从难溶电解质的角度来复习
【教材寻源】人教版《选修4》第65页,表3-5硫化铜和氢氧化铜的溶度积.
【高考链接】(2017年全国卷Ⅲ)在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗.可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-.根据溶液中平衡时相关离子浓度的关系图(如图5),下列说法错误的是( ).

图5
A.Ksp(CuCl)的数量级为10-7
B.除去Cl-的反应为Cu+Cu2++2Cl-=2CuCl
C.加入Cu越多,Cu+浓度越高,除去Cl-的效果越好
D.2Cu+=Cu2++Cu平衡常数很大,反应趋于完全

观察图象可知,当横坐标为0时,c(Cl-)=1 mol·L-1,再看Cu+曲线对应的纵坐标为-6.7,lgc(Cu+)=-6.7,c(Cu+)=10-6.7mol·L-1,Ksp(CuCl)=c(Cl-)c(Cu+)=1×10-6.7=10-6.7=100.3×10-7,100.3为大于1小于10的一个数(100<100.3<101),所以Ksp(CuCl)的数量级为10-7,选项A说法正确;铜、硫酸铜以及氯离子发生反应,生成CuCl沉淀,反应的离子方程式应为Cu+Cu2++2Cl-=2CuCl,选项B说法正确;反应Cu+Cu2++2Cl-=2CuCl的效果也取决于Cu2+的量,如果Cu2+不足,即使加入再多Cu也不会改变除去Cl-的效果,选项C说法错误;平衡常数K的数值越大,反应程度越大,2Cu+=Cu2++Cu的平衡常数很大,说明反应趋于完全,选项D说法正确.答案为C.
【要点归纳】根据难溶电解质的溶解平衡及沉淀的转化,利用CuCl的难溶性可以除去溶液中的Cl-.也可以利用水解平衡原理通过加入氧化铜或碳酸铜的方法除去溶液中的Fe3+.
10 从环保的角度来复习
【教材寻源】人教版《必修1》第20页复习题第8题,从工业废水中回收硫酸亚铁和铜.人教版《选修4》第62页最后一句:“以Na2S、H2S等作沉淀剂,使某些金属离子如Cu2+、Hg2+等,生成极难溶的硫化物CuS、HgS等沉淀,也是分离、除去杂质常用的方法”.
【高考链接】(2017年天津卷)下列有关水处理方法不正确的是( ).
A.用石灰、碳酸钠等碱性物质处理废水中的酸
B.用可溶性的铝盐和铁盐处理水中的悬浮物
C.用氯气处理水中的Cu2+、Hg2+等重金属离子

氯气不能和Cu2+、Hg2+反应生成沉淀,用氯气不能除去水中的Cu2+、Hg2+等重金属离子,选项C说法错误;其余选项说法均正确.答案为C.
【要点归纳】水中含有较多的Cu2+时,会造成水体污染,需要加入Na2S等物质把铜离子变成沉淀除去后达到标准才能排放.
11 从物质结构的角度来复习
【教材寻源】人教版《选修3》第14页注释,铜的电子排布;第42页实验2-2硫酸铜和氨水反应;第76页资料卡片,金属晶体的堆积模型对比.
【高考链接】(2019年江苏卷,节选)Cu2O广泛应用于太阳能电池领域.以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O.
(1)Cu2+基态核外电子排布式为_________.
(2)Cu2+与OH-反应能生成[Cu(OH)4]2-,[Cu(OH)4]2-中的配位原子为________(填元素符号).
(3)1个Cu2O晶胞(如图6)中,Cu原子的数目为_____.

(1)Cu原子的价电子排布为3d104s1,Cu原子失去2个电子变为Cu2+,所以基态Cu2+的核外电子排布式为1s22s22p63s23p63d9;(2)在[Cu(OH)4]2-中,Cu2+提供空轨道,OH-中的O原子提供孤对电子,所以[Cu(OH)4]2-的配位原子为O原子;(3)1个Cu2O晶胞中,顶点和体心的白色原子的数目为1+8×1/8=2,位于内部的黑色原子的数目为4,根据化学式Cu2O可知,Cu原子的数目为4.
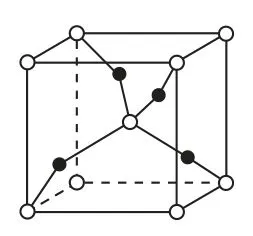
图6
【要点归纳】在结构化学中,铜原子的电子排布式、电子排布图、铜离子形成的配位化合物以及和铜有关的晶胞都是高考的重点.
12 从有机化学角度来复习
【教材寻源】人教版《必修2》第74页实验3-3,铜作催化剂乙醇被氧气氧化;人教版《必修2》第79页实验3-5,葡萄糖被新制氢氧化铜氧化;人教版《选修5》第57页实验3-6,乙醛被新制氢氧化铜氧化.

【要点归纳】1)铜作催化剂的条件下乙醇可以被氧气氧化为乙醛:
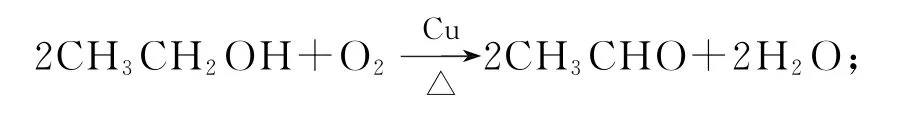
2)新制的碱性氢氧化铜悬浊液,可以与含有醛基的醛类、甲酸、甲酸某酯类、甲酸盐以及葡萄糖等发生反应,例如,CH3CHO+2Cu(OH)2+Cu2O↓+3H2O+CH3COONa.利用这个性质可以检验醛基.
总之,关于铜及其化合物的知识在高考中屡屡出现,只要我们复习时从不同角度分析总结,抓住重点,抓住主干,构建铜的知识网络,可以达到事半功倍的复习效果.
链接练习
1.(2020年全国卷Ⅱ)北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧.挹其水熬之则成胆矾,烹胆矾则成铜.熬胆矾铁釜,久之亦化为铜.”下列有关叙述错误的是( ).
A.胆矾的化学式为CuSO4
B.胆矾可作为湿法冶铜的原料
C.“熬之则成胆矾”是浓缩结晶过程
D.“熬胆矾铁釜,久之亦化为铜”是发生了置换反应
2.(2020年全国卷Ⅲ)宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料(主要成分为Cu(OH)2·CuCO3),青色来自蓝铜矿颜料(主要成分为Cu(OH)2·2CuCO3).下列说法错误的是( ).
A.保存《千里江山图》需控制温度和湿度
B.孔雀石、蓝铜矿颜料不易被空气氧化
C.孔雀石、蓝铜矿颜料耐酸耐碱
D.Cu(OH)2·CuCO3中铜的质量分数高于Cu(OH)2·2CuCO3
链接练习参考答案
1.A 2.C

