超声波辅助提取玉木耳多糖及其抗氧化活性分析
吴玉柱,崔维建,李 妍
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林长春 130118)
玉木耳(AuriculariacorneaEhrenb.)[1]是吉林农业大学李玉院士团队从毛木耳菌株中分离纯化、驯化栽培而形成稳定遗传结构的天然变异菌株,玉木耳耳片通体白色,肉质滑嫩,味道鲜美,含有丰富的营养和药用价值,其中多糖6.56%,粗脂肪2.7%,粗蛋白7.3%,不饱和脂肪酸6.22%,可食性膳食纤维35.1%,富含17种氨基酸,在木耳中有“白富美”之称[2-4]。目前已在吉林、辽宁、河南、山东、江苏、浙江、新疆、广西等省市及自治区推广,并获得良好经济效益[5]。
研究表明,食用菌之所以具有良好的药用价值,与富含的多糖类物质密切相关。传统的多糖提取方法与加热或煮沸有关[6-7]。但这些技术通常提取产率较低,并且需要大量的溶剂、较长的提取时间或较高的提取温度。当长时间且高温下进行溶剂萃取时,多糖的结构可能被破坏,生物活性也会下降或完全消失。近年来,超声波辅助提取法被认为是一种温和、高效、节能和环保的方法,已广泛应用于多糖的提取过程[8-9]。目前已有几位学者研究了玉木耳多糖的提取与活性分析,引起了人们的广泛关注,如金凤石[10]采用高温高压法提取了玉木耳多糖并研制玉木耳抗疲劳饮料;王秀秀[11]采用热水提取和蜗牛酶提取法提取玉木耳多糖并证明其有抗氧化抗炎症和保肝作用;罗敬文等[12]利用水提醇沉法得到玉木耳多糖并测定了其羟自由基、超氧阴离子自由基、DPPH自由基和亚硝酸根离子清除能力。但相比于黑木耳与毛木耳的研究[13-14],现阶段玉木耳多糖药理活性的相关报道仍较少且不够深入,还需补充大量数据及验证,未见超声波辅助法及FRAP、ORAC等体外抗氧化能力测试。
本研究采用超声波辅助提取法提取玉木耳多糖,在单因素实验的基础上,利用响应面试验优化提取工艺,采用傅里叶红外光谱对玉木耳多糖的结构进行初步表征,并分析其体外抗氧化能力,以期为超声波辅助提取玉木耳多糖提供理论依据。
1 材料与方法
1.1 材料与仪器
玉木耳 食用菌国家工程实验室(吉林长春);1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 北京博奥拓达科技有限公司;总抗氧化能力(T-AOC)测试盒 南京建成生物工程研究所;水溶性维生素E(Trolox)、2,2-偶氮二(2-甲基丙基咪)二盐酸盐(2,2′-Azobis(2-methylpropionamidine)dihydrochloride,AAPH) 美国Sigma 公司;荧光素钠(Fluorescein,disodium salt) 上海罗恩试剂;无水葡萄糖、正丁醇、三氯甲烷、苯酚、浓硫酸、无水乙醇等 均为分析纯。
Spectramax190全波长酶标仪 美国Molecular Devices公司;AllegraX-30离心机 美国BECKMA公司;电子分析天平 Sartorious(北京)有限公司;RE-52旋转蒸发器 上海亚荣生化仪器厂;JH电动搅拌器 江苏金坛市江南仪器厂;Alphal-4LDplus冷冻干燥机 德国Christ公司;KQ5200DE超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 玉木耳多糖的提取 玉木耳洗净后,烘干、粉碎并过60目筛,在室温下,置于80%乙醇中浸提4 h,以除去其中单糖、低聚糖及有色物质[15]。完成后以4000 r/min离心10 min,将沉淀物干燥得到玉木耳粉,放置于干燥器中备用。称取玉木耳粉,按一定液料比加入蒸馏水,在设计的超声条件下进行提取。提取完成后,冷却至室温,以4500 r/min离心15 min,洗涤沉淀,合并上清液,使用旋转蒸发器在65 ℃条件下浓缩至初始体积的1/4,加入无水乙醇至最终浓度为80%,在4 ℃条件下静置过夜[16],以4500 r/min离心10 min并收集沉淀物,利用Sevag法除蛋白,冷冻干燥后得到玉木耳多糖。
1.2.2 玉木耳多糖得率计算
1.2.2.1 葡萄糖标准曲线制定 按照苯酚-硫酸法显色法绘制葡萄糖标准曲线[17],将100 mg/L葡萄糖标准溶液稀释为不同浓度的待测液,于490 nm处测定溶液的吸光值,绘制以吸光度值为纵坐标、葡萄糖质量浓度为横坐标的标准曲线,得出的回归方程为:y=10.056x-0.0216,R2=0.9985,线性关系良好。
1.2.2.2 玉木耳多糖含量测定及得率计算 按照1.2.1试验方法提取玉木耳多糖,提取液分别加蒸馏水定容至100 mL,吸取1 mL稀释液,采用苯酚-硫酸法进行测定。
利用标准曲线回归方程计算多糖含量,多糖得率计算方法如下:
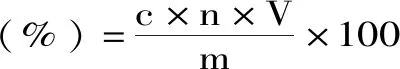
式中:c为样品稀释液中多糖的浓度(mg/mL);n为稀释倍数;V为样品测定液体积(mL);m为玉木耳粉质量(mg)。
1.2.3 单因素实验设计 按照1.2.1节的方法,提取条件为:固定超声功率180 W,超声温度60 ℃和超声时间20 min,考察液料比(20∶1、30∶1、40∶1、50∶1、60∶1 mL/g)对玉木耳多糖得率的影响;固定液料比40∶1 mL/g、超声温度60 ℃和超声时间20 min,考察超声功率(120、150、180、210、240 W)对玉木耳多糖得率的影响;固定液料比40∶1 mL/g、超声功率180 W和超声时间20 min,考察超声温度(30、40、50、60、70 ℃)对玉木耳多糖得率的影响;固定液料比40∶1 mL/g、超声功率180 W和超声温度60 ℃,考察超声时间(10、20、30、40、50 min)对玉木耳多糖得率的影响。每组试验重复3次,结果取平均值。
1.2.4 响应面试验设计 在单因素实验的基础上,选择液料比(A)、超声功率(B)、超声温度(C)、超声时间(D)为自变量,以多糖得率为响应值(Y),根据Box-Behnken设计原理,采用响应面分析法进行试验设计,优化超声波辅助提取玉木耳多糖的工艺,因素与水平设计见表1。

表1 响应面试验设计因素与水平
1.2.5 傅里叶红外光谱分析(FT-IR) 根据Zhao等[18]的方法稍作修改进行FT-IR测试。称取1.5 mg超声波辅助提取法制备的玉木耳多糖样品于玛瑙研钵中,加入100 mg溴化钾粉末并置于红外灯下研磨均匀,然后压成薄片,扫描范围400~400 cm-1,使用热水浸提法得到的玉木耳多糖作为对照(提取条件:液料比40∶1 mL/g,浸提温度95 ℃,提取时间120 min),记录样品的FT-IR光谱。
1.2.6 玉木耳多糖体外抗氧化活性试验
1.2.6.1 DPPH自由基清除试验 根据Zhou等[19]报道的方法,对DPPH自由基的清除作用进行分析。吸取2 mL稀释为不同质量浓度的样品溶液,加入2 mL 0.2 mmol/L的DPPH溶液中,混匀,在室温黑暗条件下保持30 min,在517 nm处测量溶液的吸光度,用VC标准品作为对照组。DPPH自由基清除率计算如下:
式中,A0为对照反应(DPPH)的吸光度,A1为加入样品时的吸光度。
1.2.6.2 铁离子还原能力的测定(FRAP法) 根据试剂盒中检测方法[20]。准确称取玉木耳多糖,加入4倍体积的PBS溶液(10 mmol/L,pH7.0),充分溶解,离心(4 ℃,12000 r/min,5 min)取上清液作为待测液。在96孔板中加入180 μL FRAP工作液和5 μL待测液后轻轻混匀,37 ℃孵育5 min,测定其在593 nm波长处吸光度,FeSO4标准曲线为y=0.2117x+4.2144×10-5,R2=0.9991。样品总抗氧化能力以达到同样吸光度所需FeSO4标准溶液的浓度来表示(mmol/L)。
1.2.6.3 氧自由基吸收能力的测定(ORAC法) 参考Huang等[21]方法并加以改进。向96孔板(黑板)中加入25 μL样品后放入预热好的酶标仪中,37 ℃温育10 min后加入150 μL荧光素钠工作液,混匀温育20 min后加入25 μL AAPH溶液(0.125 g/mL),以激发波长490 nm、发射波长530 nm连续测定荧光强度。计算空白(无AAPH)和每个样品之间的荧光素衰减曲线下的面积(净面积)的差值。以Trolox系列浓度的函数净面积绘制标准曲线为y=0.4264x-0.7951,R2=0.9944,样品抗氧化能力表示为mg Trolox/mg。
1.2.7 统计分析 试验均重复3次,使用Origin 2018软件绘图,采用OMNIC 8.0软件及Design-Expert 8.0.6软件处理数据,通过ANOVA进行差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 单因素实验
2.1.1 液料比对玉木耳多糖得率的影响 多糖等大分子在水中溶解度与液料比密切相关。料液比对玉木耳多糖得率的影响如图1所示。液料比较低时,溶液黏度较高不利于多糖扩散,随着液料比的增大,多糖得率逐渐增大,在料液比为40∶1 (mL/g)时达到最大值7.03%,随后得率降低。可见料液比越大,可容纳的多糖分子越多,但并不能无限增多,过大的液料比还会增加后期浓缩和醇沉的能耗与工作量,从而增加玉木耳多糖的提取成本。因此,液料比选择为40∶1 (mL/g)。

图1 液料比对玉木耳多糖得率的影响
2.1.2 超声功率对玉木耳多糖得率的影响 图2为超声功率对玉木耳多糖得率的影响。当功率从120 W增加到210 W时,玉木耳多糖的得率显著增加,且几乎线性增加到7.14%,当超声功率超过210 W时,多糖得率下降。这可能是由于超声功率的增大有助于液固两相的相互混合和细胞结构的破碎,但功率过强时,超声波空化作用加大,机械力增强,多糖结构可能遭到破坏,多糖的得率降低[22]。因此,超声功率选择为210 W。
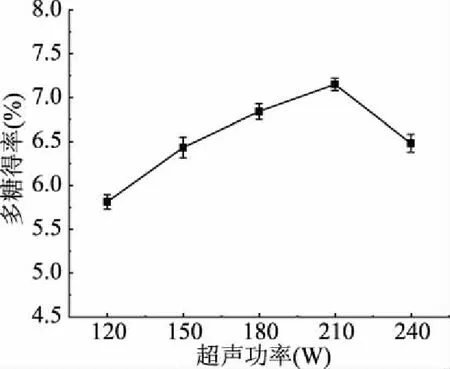
图2 超声功率对玉木耳多糖得率的影响
2.1.3 超声温度对玉木耳多糖得率的影响 温度过低时,分子运动速度较慢,多糖无法充分溶出,当温度升高,分子运动速率加快,多糖溶解度增加。如图3所示,随温度升高,溶液原料间的相互作用加速,细胞结构更好地被破坏,多糖更有效地溶出,得率最大可达7.16%,但当提取温度高于60 ℃时,得率出现下降的趋势,可能是温度过高使部分糖链发生断裂。因此,玉木耳多糖的提取温度可控制在60 ℃左右。

图3 超声温度对玉木耳多糖得率的影响
2.1.4 超声时间对玉木耳多糖得率的影响 超声时间的变化影响了多糖的得率,玉木耳多糖得率在早期迅速增加,超声时间为30 min时多糖得率达到最大值(图4)。这可能是由于多糖暴露在释放介质中的时间要求,液体渗透到干燥的原料中,溶解多糖,然后从原料中扩散出来,较长的提取时间有利于多糖的产生,但是,超声时间过长可使超声空化作用增强,机械力增大,温度上升,从而将已溶出的多糖结构发生破坏[23]。因此,超声时间选择为30 min。

图4 超声时间对玉木耳多糖得率的影响
2.2 玉木耳多糖提取工艺条件的优化
2.2.1 模型方程建立与显著性检验 选择液料比(A)、超声功率(B)、超声温度(C)及超声时间(D)为影响因素,以得率(Y)为响应值进行试验设计,得到的响应面试验设计分析结果如表2所示(实测值为3次平行实验结果的平均值),利用Design-Expert 8.0.6软件分析处理试验数据,可以得到回归方程为Y=7.48+0.14A+0.25B+0.21C+0.14D-0.035AB-0.063AC-0.55AD+0.40BC-0.25BD-0.63CD-0.86A2-1.03B2-0.93C2-0.35D2。
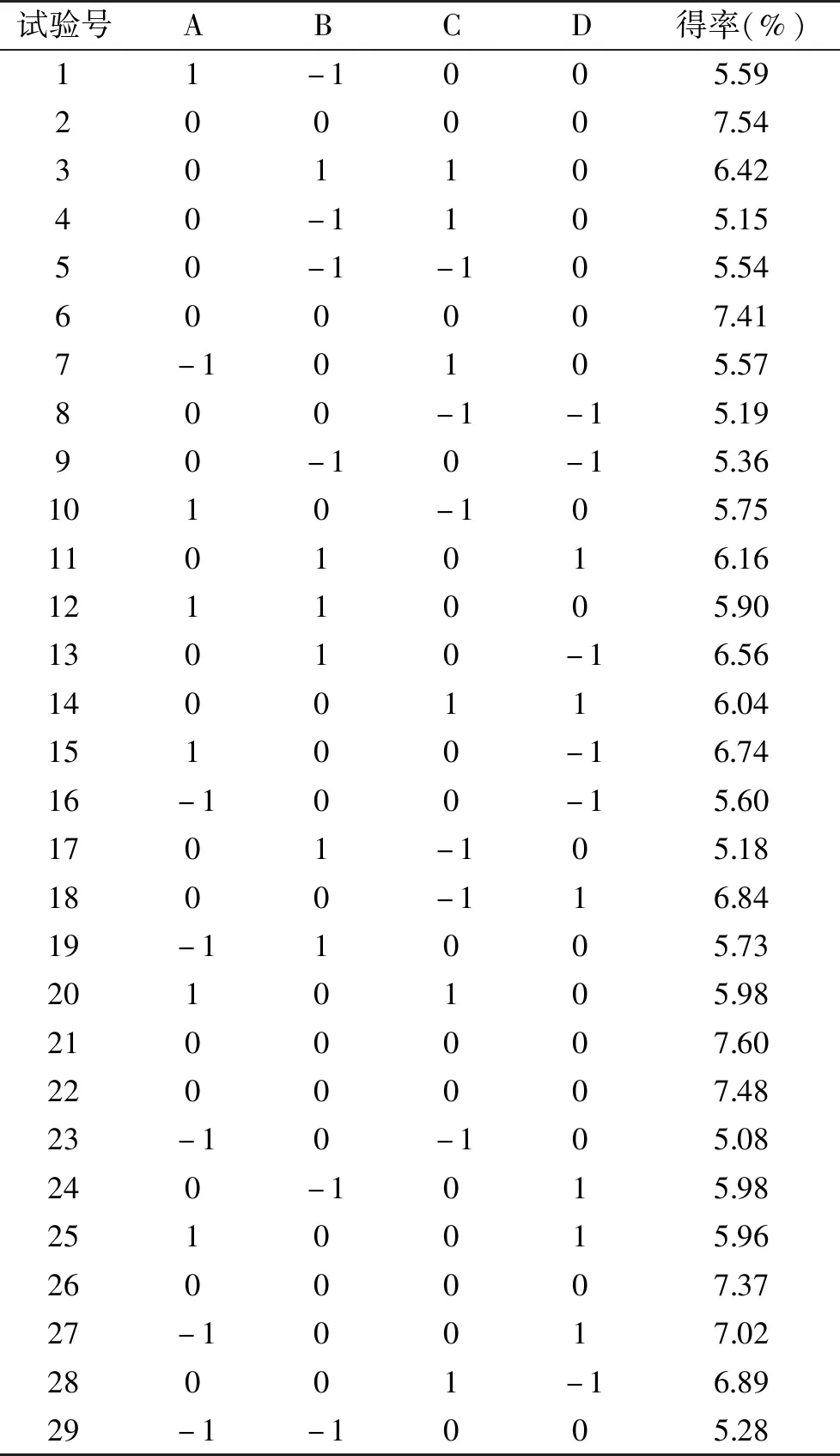
表2 响应面分析方案及试验结果
根据回归模型方程进行方差分析结果见表3。模型P<0.0001,说明回归模型对多糖得率的结果达到极显著水平,试验设计可靠。失拟项P=0.1023>0.05,表明模型计算结果与检验结果的差异不显著。模型线性决定系数R2=0.9804,变化系数CV=2.60,表明试验的预测值和实际值相关度高,多糖提取率的回归模型拟合度较好,可以用于响应值的预测。从表3中回归系数的显著性检验可知,回归模型二次项中的B、C、D、AD、BC、BD、CD、A2、B2、C2、D2(P<0.01)达到极显著水平以及A达到显著水平(P<0.05),AB与AC不显著(P>0.05)。根据F值可以得出,四个因素对玉木耳多糖得率的影响大小顺序为:超声功率>超声温度>超声时间>液料比。
2.2.2 响应面交互作用影响结果 等高线图、响应面图可以直观地反映两因素间的交互作用。响应面图越陡说明两自变量的交互作用对响应值影响程度越大,相反,越平缓交互作用影响越不显著[24]。等高线图越偏离圆形,交互影响越强,反之,越接近圆形,交互影响越弱。由图5分析得出,AD、BC、BD、CD响应面3D图陡峭,且等高线图呈明显的椭圆形,因此交互作用显著,AB与AC等高线图接近圆形,表明交互作用不显著(P>0.05),这与方差结果一致。

图5 各因素交互作用的响应面和等高线图
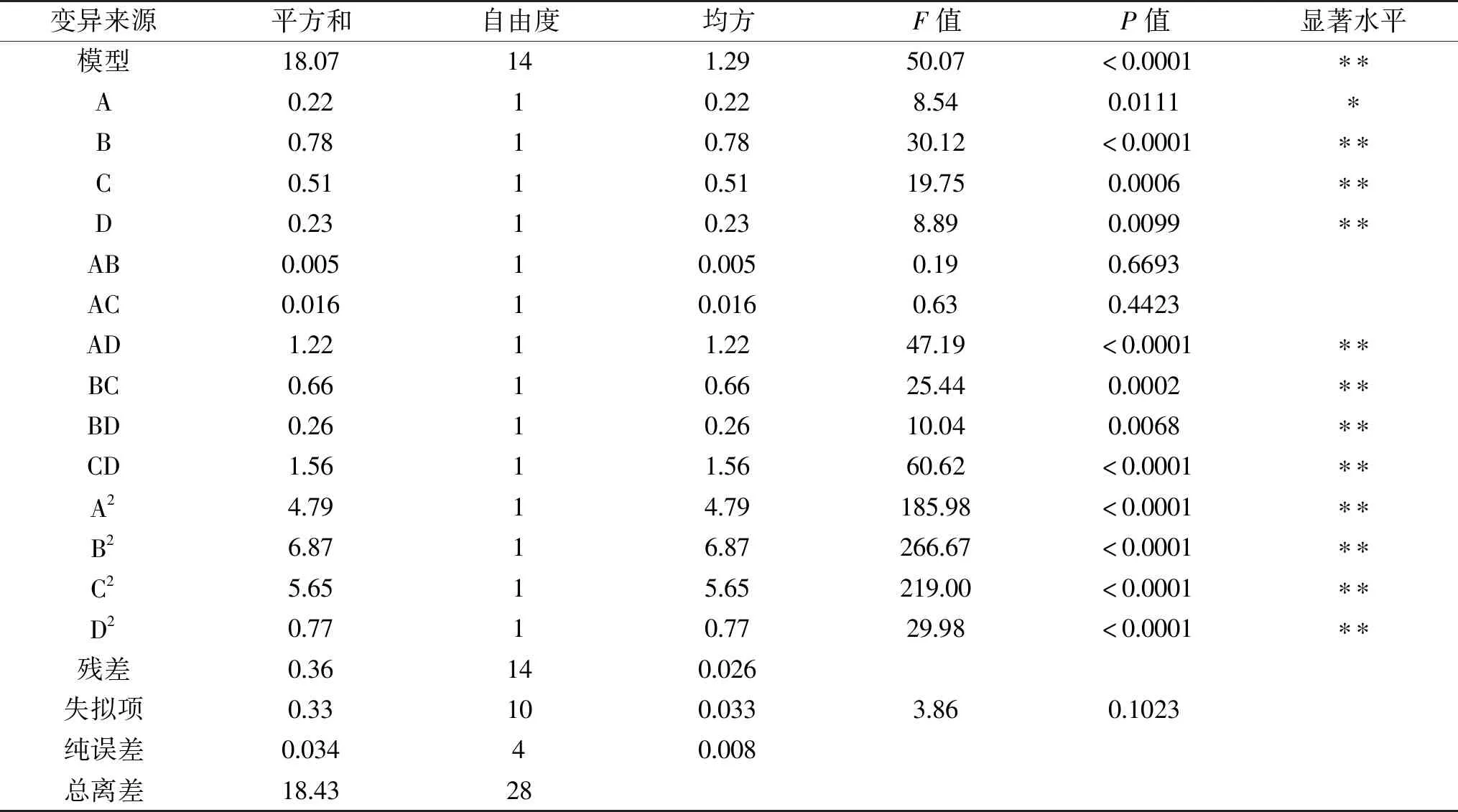
表3 回归方程方差分析表
2.2.3 最优条件的确定与回归模型的验证 通过试验分析,确定超声波辅助法提取玉木耳多糖的最佳提取工艺为液料比41.03∶1 mL/g,超声功率215 W,超声温度61.8 ℃,超声时间28.91 min,此条件下玉木耳多糖得率为7.52%。考虑到实际操作的简便性和可行性,将提取条件调整为:液料比40∶1 mL/g,超声功率210 W,超声温度62 ℃,超声时间29 min,此工艺条件下进行超声波辅助法提取玉木耳多糖,试验重复3次取平均值,得率为7.43%。结果与预测值误差较小,表明优化后的工艺条件准确可靠,具有一定的应用价值。
2.3 傅里叶红外变换光谱分析
红外吸收光谱是分析多糖等化合物结构的重要方法之一,依据吸收峰的位置和形状能够获得糖链上的官能团类型和糖环构型等结构信息[25]。如图6所示,红外光谱表明超声波处理未改变玉木耳多糖的结构。玉木耳多糖具有糖类化合物特征吸收峰,其中在3367 cm-1处的吸收峰是O-H伸缩振动引起的,峰形强而宽,说明存在分子间氢键。2931 cm-1处是饱和C-H的伸缩振动吸收峰,1645和1423 cm-1可分别对应于糖醛酸中的羰基C=O振动和羰基C-O伸缩振动,这表明玉木耳多糖是酸性多糖[26];1374 cm-1是甲基C-H弯曲振动吸收峰,与C-H的伸缩振动构成了糖环的特征吸收[27],1248 cm-1处为-COOH中O-H键伸缩振动,1040 cm-1处是C-O的伸缩振动峰,说明多糖中含有吡喃糖环。在895 cm-1处出现的小峰,推测是由次甲基的横向振动引起的,说明其中含有β-型糖苷键[28]。
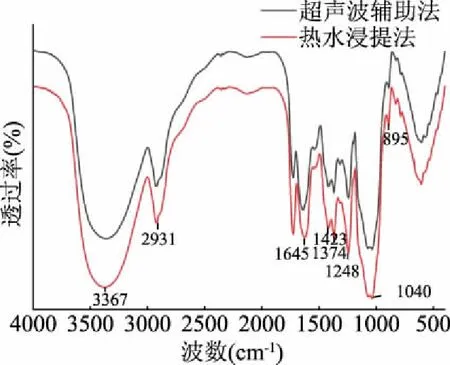
图6 玉木耳多糖傅里叶变换红外光谱
2.4 体外抗氧化试验结果与分析
2.4.1 DPPH自由基清除能力 DPPH·是一种非常稳定的自由基,以氮为中心,在517 nm处具有强吸收,通常用于检测抗氧化能力。由图7可知,玉木耳多糖及VC对DPPH自由基清除能力随质量浓度增加而增强,并且呈现一定的剂量效应关系,在浓度为1.0 mg/mL 时,玉木耳多糖的DPPH自由基清除率达到43.36%,低于1.0 mg/mL VC97.35%的清除率,当玉木耳多糖质量浓度为5 mg/mL时,自由基清除率达到74.83%,这高于Zeng等[29]纯化后的黑木耳多糖抗氧化能力,且与王秀秀[11]和罗敬文等[12]的研究结果相近。采用半数抑制率(IC50)定义为清除自由基达50%时的样品浓度。经曲线拟合方程计算求得玉木耳多糖的IC50值为1.445 mg/mL,阳性对照VC的IC50值为0.062 mg/mL。在本试验测试的浓度范围内,尽管玉木耳多糖的DPPH自由基清除活性不如VC强,但仍具有有效清除能力,可作为天然抗氧化剂应用。

图7 玉木耳多糖的DPPH自由基清除能力
2.4.2 FRAP及ORAC抗氧化试验结果 Fe3+-TPTZ在酸性条件下可被样品中还原物质还原为Fe2+-TPTZ,呈现出蓝色,并于593 nm处具有最大光吸收,根据吸光度大小计算样品抗氧化活性的强弱[30]。氧自由基清除能力法(ORAC)的原理是AAPH自由基破坏荧光素钠,使荧光强度发生改变。而抗氧化剂可以延缓AAPH自由基引起的荧光强度变化,其抑制程度反映了对自由基的清除能力大小,ORAC值越大,表示其抗氧化的能力越强[21]。由表4可知,玉木耳多糖具有有效的铁离子还原能力,且在试验测试浓度下,玉木耳多糖的ORAC值(0.627 mg Trolox mg-1)接近VC的ORAC值(0.710 mg Trolox mg-1),表明玉木耳多糖具有较好的抗氧化能力。

表4 玉木耳多糖的FRAP还原能力与氧自由基清除能力
3 结论
采用超声波辅助法提取了玉木耳多糖,并利用响应面分析法进行优化,得到的最优工艺参数为液料比40∶1 mL/g,超声功率210 W,超声温度62 ℃,超声时间29 min,此工艺条件下玉木耳多糖的得率为7.43%。超声波辅助提取法得到的玉木耳多糖具有多糖类特征吸收峰,为以β-糖苷键为主的吡喃型多糖。三种体外抗氧化试验的结果均显示,玉木耳多糖具有很好的抗氧化活性,可作为潜在的天然抗氧化剂应用于功能性食品、医药、保健食品领域。

