严重钙胁迫下接种AM真菌无益于缓解玉米苗期的钙毒害
冉 琼,钟章成,杜道林
(1.重庆理工大学,重庆 巴南401320;2.绵阳师范学院,四川 绵阳 621000;3.西南大学 三峡库区生态环境教育部重点实验室,重庆 北碚 400715;4.江苏大学 环境与安全工程学院生态环境研究所,江苏 镇江 212013)
0 引 言
丛枝菌根(AM)真菌是一类能与陆地上约80%植物形成共生体的土壤微生物[5],大多数植物的根系可与之形成良好的互惠共生关系,能促使植物吸收营养,促进植物生长,还能增强植物的抗病能力[6-7]、抗旱性[8]、抗盐性[9]、抗温度胁迫[10]及抗重金属胁迫[11]等。但目前关于AM 真菌和钙毒害效应相关性的研究还鲜有报道。种植玉米是解决西南喀斯特山区粮食问题的可行途径,而如何提高玉米的产量和质量是玉米生产发展的关键问题。本研究利用温室盆栽试验,探讨了AM真菌对高钙胁迫下玉米生长、光合及生化特性等的影响,旨在探讨高钙胁迫对玉米的毒害效应及AM真菌对高钙胁迫的缓解作用,研究结果可为评价喀斯特地区AM真菌对高钙土壤中的植物的促生效应及其应用于农业生产的可行性提供理论依据。
1 材料和方法
1.1 试验材料
1.1.1 AM真菌接种体。菌种摩西球囊霉(Glomusmosseae),购买自北京市农林科学院植物营养与资源研究所,接种剂为经白三叶草繁殖后产生的菌根菌孢子、根外菌丝体及根际土壤(含有相应宿主植物根段),约300个孢子· 20g-1。
1.1.2 宿主植物。宿主植物为玉米(ZeamaysL.),种子来自重庆市酉阳县岩溶山区农户提供的自选种,先经10% H2O2消毒10 min,接着用无菌水洗净后置于灭菌后的培养皿(皿底放无菌湿润的三层滤纸),再将培养皿放于25 ℃黑箱里催芽,2天后,挑选状况一致的种芽备用。
1.1.3 培养基质与容器。培养基质为土沙1∶4(W∶W)混合物。土壤为岩溶地段的石灰土(pH值6.81,含有机质26.8 g·kg-1,碱解氮68 mg·kg-1,速效钾108 mg·kg-1,交换性钙2.326 g·kg-1,全钾14.62 g·kg-1,全磷0.46 g·kg-1,全氮1.34 g·kg-1),取自重庆北碚鸡公;土壤经自然风干后,过1 mm筛,在温度124 ℃,压力0.14 MPa高压灭菌锅下连续灭菌2 h,晾干,再与相同方式下灭菌晾干的干净河沙均匀混合备用。培养容器采用高16 cm,上口直径19 cm,下口直径13 cm的塑料盆,先于0.1%的高锰酸钾溶液中浸泡30 min,再清洗干净、晾干。
1.2 试验设计
试验包括两因素,接种处理和钙处理,接种处理为接菌和不接菌,钙处理为对照钙处理和高钙处理。采用两因素完全随机设计,两因素两水平,共4个处理:对照不接菌处理(C);对照接菌处理(C+AMF);高钙不接菌处理(H);高钙接菌处理(H+AMF),每个处理种植7盆,随机摆放于大棚内。
于2015年4月8日在西南大学生态园的大棚内进行播种,为保障植物正常生长,播种前将复合肥200 mg·kg-1(N∶P∶K=26∶12∶10)混入基质中作基础养分。试验分为对照和高钙处理,对照处理为培养基质不加外源钙,高钙处理为培养基质添加外源钙(无水氯化钙以溶液形式添加混匀),达到1.0 g·kg-1[12-13]的钙离子浓度(不含基质中的钙本底值)。钙设置完成后,装盆,预计每盆装2.5 kg基质。先将2.0 kg基质装入培养容器,然后添加灭菌接种物15 g(不接菌处理,同时添加10 ml 15 g接种物的过滤液,保持其它菌群一致)或接种物15 g(接菌处理)于已盆装基质表面,将5粒玉米种芽植入盆装基质中,最后将余下的0.5 kg基质平铺其上,接种剂与土表距离约2 cm。装盆过程完成后浇水,盆中基质含水量达到20%(绝对含水量)为止。试验过程均采用去离子水浇灌,每天称重维持20%的土壤含水量。出苗7天后间苗,每盆留苗2株,试验开始至第6周时测定各指标。
1.3 指标测定
1.3.1 玉米幼苗光合参数及生长指标的测定。于晴朗的上午9:00时,采用便携式光合测定仪Li-6400(LI-COR,USA)测定玉米幼苗第2-3张完全展开叶片的光合参数。测定时光量子通量密度(PED)为1 200 μmol·m-2·s-1,CO2浓度为(470±10)μmol·mol-1,温度为26 ℃,相对湿度为65%,叶室配备LED红蓝光源。测定完成后,用直尺量取植株株高,再将花盆连同植株浸入水中,小心取出植株,先用自来水冲掉根部土壤和沙砾,再用蒸馏水缓缓洗净植株表面,最后用吸水纸吸干植株表面水分,并将其带回实验室。将各处理3-5个植株进行根、茎、叶器官分离,放至105 ℃烘箱内杀青30 min,70 ℃烘干72 h后进行称重,根、茎、叶生物量之和为总生物量,茎、叶生物量之和为地上生物量,根生物量与地上生物量之比即为根冠比。
1.3.2 玉米幼苗根系侵染率的测定。根系侵染率的测定参照Phillips和Hayman的方法[14],将切成1 cm的玉米小根段,用曲利苯蓝0.05%浓度的染色液染色,菌根侵染率为侵染根段长占总根段长的百分比。
1.3.3 玉米幼苗叶生化指标的测定。脯氨酸的测定—磺基水杨酸法,参照章家恩[15]方法进行。
可溶性糖的测定参照张志良等[16]的比色法进行。
丙二醛含量的测定参照章家恩[15]的方法。
1.4 数据分析
采用统计分析软件SPSS16.0对数据进行方差分析,LSD多重比较5%水平下检验不同处理平均值间的差异显著性,采用Microsoft Office Excel 2007和Origin 9.0软件进行数据处理和绘图。
2 结果与分析
2.1 钙胁迫下AM真菌对玉米幼苗生长和光合参数的影响
由表1可知,高钙处理下玉米幼苗的菌根侵染、总生物量、地上生物量、株高及根冠比均显著低于对照处理(P<0.05),表明高钙显著抑制了玉米根系的侵染能力和生长。对照条件下,接菌处理显著增加玉米幼苗总生物量、地上生物量、株高,分别提高了31.8%、40.8%和10.3%(P<0.05);然而,高钙条件下,接菌处理未使玉米幼苗的总生物量、地上生物量、株高及根冠比产生显著变化。
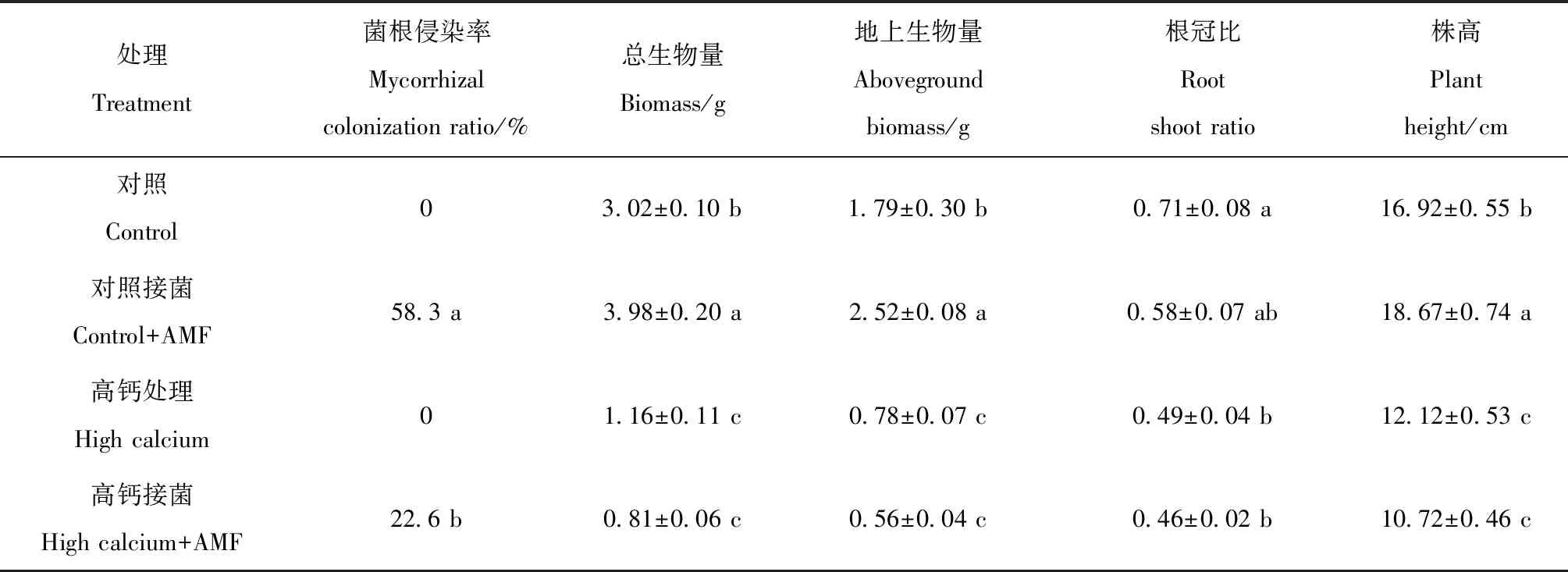
表1 不同处理下玉米幼苗的菌根侵染率和生长特征Table 1 The AMF colonization ratio and growth of maize seedlings under different treatments
由图1可知,与对照处理相比,高钙处理显著降低了玉米幼苗的净光合速率、蒸腾速率以及气孔导度(P<0.05),表明高钙胁迫抑制了玉米幼苗的光合能力。对照条件下,接菌处理分别使玉米幼苗净光合速率、蒸腾速率以及气孔导度显著提高22.3%、15.4%、32.2%(P<0.05);然而,高钙条件下,接菌处理未对玉米幼苗的光合参数产生显著影响。

图1 不同处理下玉米幼苗的光合参数Fig.1 The photosynthetic characteristics of maize seedlings under different treatments
2.2 钙胁迫下AM真菌对玉米幼苗可溶性糖、脯氨酸和丙二醛含量的影响
可溶糖含量是一种重要的渗透调节物质,对照条件下,接菌处理显著提高了玉米幼苗可溶性糖含量(P<0.05);高钙胁迫显著降低了玉米幼苗的可溶性糖含量(P<0.05,图2);高钙条件下,接菌处理未使玉米幼苗的可溶性糖含量产生显著变化。

图2 不同处理下玉米幼苗可溶性糖、脯氨酸和丙二醛含量的影响Fig.2 The soluble sugar,proline and MDA contents of maize seedlings under different treatments
脯氨酸含量大小可以反映植物受害程度的高低,与对照处理相比,高钙处理下玉米幼苗的脯氨酸含量显著增加,表明高钙处理下玉米幼苗的受害程度远高于对照处理(图2)。对照与高钙胁迫下,接菌处理均对脯氨酸含量影响不显著。
丙二醛是膜脂过氧化的产物,其含量越低细胞膜的完整性和稳定性越好。钙浓度增加,丙二醛有降低趋势,钙在一定程度上能稳定细胞膜结构。对照钙处理下,接菌处理较未接菌处理玉米幼苗的丙二醛含量理显著下降(P<0.05)(图2),表明AM真菌能够使植物细胞膜保持更加好的完整性和稳定性;高钙下接菌处理未对丙二含醛含量产生显著影响。
3 讨 论
AM真菌是一类能与绝大部分植物的根系形成互惠共生体的微生物。魏源等[29-30]发现,AM真菌的生态学功能与喀斯特生态系统的限制因子间有良好的耦合关系,AM真菌与宿主植物之间有着双向的选择性,侵染率是彼此间亲和力的体现,亲和力好,则侵染率高;亲和力差,则侵染率低。本研究表明,典型喀斯特土壤,钙含量超过中钙水平钙胁迫的植株相对于高钙胁迫的植株更容易与AM真菌形成共生体。钙浓度增加对AM真菌不规则发育具有负面影响,能显著降低AM真菌不规则生长周期的主要阶段,包括孢子萌发、萌发菌丝伸长、根定植、根外菌丝发育和孢子形成,但不能完全抑制其生长[31]。
AM真菌在盐胁迫下能提高玉米生长和光合能力[32],我们的数据表明,过高钙水平不利于玉米植株的生长,这种效应在菌根中比在非菌根中更强烈,这可能与菌根分配相当一部分碳以维持真菌代谢有关[33-34]。丛枝菌根定植在过高钙情况下不能提供植物更好的生长,这一结果与许多表明丛枝菌根共生在其他几种非生物胁迫下对植物生长有益的研究并不一致[35-37]。Hoffland等[38]和Van Scholl等[39]报道称,菌根内真菌从岩石中吸收钙的能力非常小,由此可能缓解钙毒效应。
高钙会导致矿物质养分生物利用度低,尤其是磷[40]和铁[41],因此,这些缺陷会影响植物根部和叶片的代谢过程[42]。糖是一种重要的代谢产物,植物在各种应激因子的作用下,利用糖进行防御反应,环境压力诱导可使可溶性糖含量变化,本研究结果显示,高钙显著降低了可溶性糖含量。对照钙处理下AM真菌促进了可溶性糖的积累,AM真菌需要从宿主植物获得糖分来促进自身生长[43],也会促进植株体内淀粉的分解[44],因此能使宿主植物可溶性糖含量增加,但高钙胁迫下,AM真菌未对可溶性糖含量产生显著影响。
脯氨酸是植物体内一种重要的渗透调节物,许多植物在盐胁迫的条件下积累脯氨酸可作为无毒和保护性的渗透物来维持渗透平衡[45-47],因此其积累量的高低可以反映植物抗逆性的强弱。AM真菌还可通过增加宿主植物体内脯氨酸的积累量,提高植物的耐盐性[48]。本研究结果显示,钙浓度增加促使脯氨酸含量显著提高,但AM真菌对脯氨酸含量的积累无显著影响。
MDA含量是评估氧化膜损伤的有效手段[49-50],脂质过氧化作用被认为是植物抗非生物胁迫的关键过程之一。本研究发现,对照钙处理下,丛枝菌根可以减轻膜脂过氧化。菌根定植对根系保护可能与诱导活性氧清除系统减少活性氧生成有关,在应激反应中最常见的解毒ROS合成器的机制中,POD诱导已经在几项研究中得到报道[51]。
综上所述,过高钙含量土壤基质抑制了植物的生长和光合生理等过程,AM真菌在部分喀斯特土壤中仍能促进植物的生长、光合及代谢过程,钙过高环境下,AM真菌不能促进植物的生长生理过程,一方面与高钙胁迫抑制了菌根真菌的生长和生理过程,菌根真菌没有参与钙的吸收、对钙毒效应的缓解效应不显著有关,另外,不同土壤环境和菌种会导致不同的接种效应,且不同菌种与寄主间侵染时期及亲和性也使接种效应具有差异性,玉米根际AM真菌丰富多样[52],种类不同,促进植物生长发育的效果有差异[53]。
本研究探究了土壤高钙对AM真菌和寄主植物之间的相互作用的影响,过高钙浓度抑制了植物的生长及光合等生理过程,也对AM真菌的定植产生了影响,AM真菌定植未显著缓解过高钙毒效应。由于目前高钙胁迫下的菌根效应关注比较少,有关AM 真菌减缓钙离子对植物毒害作用的机制,目前尚无定论,对于喀斯特地区钙与土壤AM植物系统相互作用的因果关系仍有许多未解之谜。异质性是岩溶生境中土壤的重要特点,多重胁迫往往在该生境中共同存在,因此探讨异质生境与多重胁迫下植物的适应性及菌根效应,是今后研究需努力的方向。

