EETs对高脂饮食诱导的小鼠肥胖和胰岛素抵抗的作用及其机制
陈方圆,强 华,田 刚,白晓君,李娟利,袁祖贻(西安交通大学第一附属医院心血管内科,西安 710061;通信作者,E-mail:chenfy-608@163.com)
胰岛素抵抗是指各种原因导致胰岛素促进葡萄糖摄取和利用的效率下降,机体代偿性地分泌过多胰岛素产生高胰岛素血症,以维持血糖稳定的一种病症[1]。而胰岛素抵抗易导致代谢综合征和2型糖尿病,严重影响患者生活[2]。遗传、肥胖、疾病等均可导致胰岛素抵抗的发生[3]。随着生活水平的提高及生活节奏的变快,肥胖成为导致胰岛素抵抗最常见的原因,肥胖诱导的脂肪组织慢性低级别炎症及巨噬细胞聚集和极化在胰岛素抵抗的发生及发展起到了重要作用[4]。肥胖机体营养过剩和代谢紊乱将脂肪组织巨噬细胞置于复杂的代谢微环境中,而脂肪细胞胰岛素抵抗还可促使脂肪组织持续释放大量的饱和脂肪酸,进而激活脂肪组织巨噬细胞,引起进一步的代谢紊乱。因此,调节脂肪组织巨噬细胞炎性聚集及极化成为医学界学者研究防治胰岛素抵抗方法的重点。环氧-二十碳三烯酸(epoxy eicosapentaenoic acid,EETS)是花生四烯酸细胞色素P450表氧化酶代谢花生四烯酸产生的一种内源性心血管活性物质,可抗心肌缺血、抗炎症反应、改善内皮功能、抗血小板黏附与聚集[5]。近年研究发现,EETS可调节巨噬细胞极化,抑制单核细胞的激活,对胰岛素抵抗有一定的抑制作用,但未明确其相关机制,有研究认为,其分子机制与参与能量代谢的cAMP-EPAC信号通路关系密切[6]。本实验旨在分析EETS对高脂饮食诱导的小鼠肥胖和胰岛素抵抗的作用及与cAMP-EPAC信号通路、巨噬细胞炎性聚集和极化的关系。
1 资料与方法
1.1 一般资料
随机选择80只雄性野生C57BL/6J小鼠,购于华中科技大学实验动物中心,实验动物合格证号:SCXK(鄂)2010-0007,小鼠平均周龄为(5.00±1.00)周,平均体质量为(25.25±4.50)g,给予22-24 ℃的室温,40%-60%的相对湿度,噪音≤45 dB,给予正常饮水,给予相应标准的动物饲料,适应性喂养1周。
1.2 分组及处理
将所有小鼠随机分为4组,即对照组、模型组、11,12-EET组及14,15-EET组,每组20只。对照组小鼠给予普通饮食,其他三组小鼠均建立高脂饮食诱导的小鼠胰岛素抵抗模型,四组小鼠均喂养3个月。11,12-EET组小鼠运用微量泵于餐前注射11,12-EET剂量为15 μg/kg,1次/d,与高脂饮食一起持续1个月;14,15-EET组小鼠运用微量泵于餐前注射14,15-EET,剂量为15 μg/kg,1次/d,与高脂饮食一起持续1个月。持续喂养普通饮食及高脂饮食至实验结束,喂养过程中均无小鼠死亡。
1.3 指标检测
实验结束前称取并记录小鼠的体质量,行胰岛素耐量试验及葡萄糖耐量试验。用戊巴比妥麻醉,杀死小鼠,留取血标本,将肝脏、骨骼肌、心脏及腹腔脂肪组织等放入4%甲醛溶液中固定,随后脱水、浸蜡、包埋,于室温备用。
1.3.1 胰岛素耐量试验(insulin tolerance test,ITT) 每组随机选择10只小鼠,禁食6 h,提前6 h放入动物房内,于下午2:00称取小鼠体质量,于尾静脉测定其血糖。根据小鼠体质量以1 U/kg的剂量腹腔注射胰岛素溶液,分别于注射后15,30,45,60 min测定小鼠血糖并给予记录。
1.3.2 葡萄糖耐量试验(glucose tolerance test,GTT) 每组选择另外10只小鼠,禁食16 h,提前15 h放入动物房内,于早8:00称取小鼠体质量,尾静脉测定其血糖。根据小鼠体质量以1.5 g/kg的剂量腹腔注射葡萄糖溶液,分别于注射后15,30,45,60,90,120 min测定小鼠血糖并给予记录。
1.3.3 血清检测 将血标本于室温静置20 min,以3 000 r/min的转速离心10 min,小心分离血清,放入-80 ℃环境冷藏备用,避免反复冻融。运用葡萄糖氧化酶法检测各组小鼠血糖,采用酶比浊法检测甘油三酯(triglyceride,TG)及总胆固醇(total cholesterol,TC)水平,采用ELISA法检测各组小鼠白介素-6(interleukin-6,IL-6)、白介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)及单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)水平。
1.3.4 HE染色 将石蜡切片放置于60 ℃烤箱烘烤12 h,常规脱蜡后苏木素染色,进行离子水洗、脱水至蜡,用中性树胶封片,镜下观察并拍照各组小鼠脂肪组织形态变化情况(包括脂肪细胞大小及脂肪组织周围巨噬细胞聚集)。
1.3.5 real time PCR检测Rapgef3 mRNA水平 提取各组小鼠腹腔脂肪组织的细胞RNA,RNA逆转录合成cDNA,运用real time PCR得出Rapgef3(Rap guanine nucleotide exchange factor 3)mRNA水平。引物序列见表1。
1.3.6 Western blot检测EPAC蛋白 将各组小鼠腹腔脂肪组织剪碎,加入PIPA裂解液,置于冰上裂解30 min,于4 ℃环境下离心15 min,得到总蛋白。运用BCA法测定蛋白浓度。将得到的蛋白质最低浓度为20 μl体系,按比例加入缓冲液,充分混匀后以沸水煮5 min,冰上骤冷。10% SDS-PAGE分离蛋白,半干转膜仪转膜。一抗浓度:EPAC(1 ∶500),β-actin(1 ∶5 000),以β-actin作为内参;二抗浓度(1 ∶5 000)。化学发光法检测,图像采集,Image J软件进行图像分析。

表1 引物序列
1.4 统计学方法
2 结果
2.1 各组小鼠肥胖指标比较
模型组小鼠的体质量、皮下脂肪质量、内脏脂肪质量、血糖、胰岛素、TG及TC水平明显高于对照组(P<0.05),11,12-EET组及14,15-EET组小鼠的体质量、皮下脂肪、内脏脂肪质量、血糖、胰岛素、TG及TC水平明显低于模型组,差异有统计学意义(P<0.05,见表2)。结果显示,EETs持续微量泵入可缓解高脂喂养小鼠的肥胖及高脂血症情况。
表2 各组小鼠肥胖指标比较
2.2 各组小鼠胰岛素抵抗指标比较
葡萄糖耐量试验各组小鼠血糖水平差异有统计学意义(F分组=3.001,P分组=0.048;F时间=15.935,P时间=0.001;F分组×时间=4.152,P分组×时间=0.001);各组随时间呈先上升后下降的趋势,于15 min达到顶峰,除0 min外其他各时间点模型组小鼠的血糖均高于对照组,11,12-EET组及14,15-EET组小鼠血糖均低于模型组(见表3)。胰岛素耐量实验各组小鼠血糖水平差异有统计学意义(F分组=6.152,P分组=0.025;F时间=10.268,P时间=0.018;F分组×时间=6.325,P分组×时间=0.001);各组随时间呈先下降后上升的趋势,且同时点模型组小鼠的血糖均高于对照组,11,12-EET组及14,15-EET组小鼠血糖均低于模型组(见表4)。

表3 各组小鼠葡萄糖耐量实验各时点血糖变化
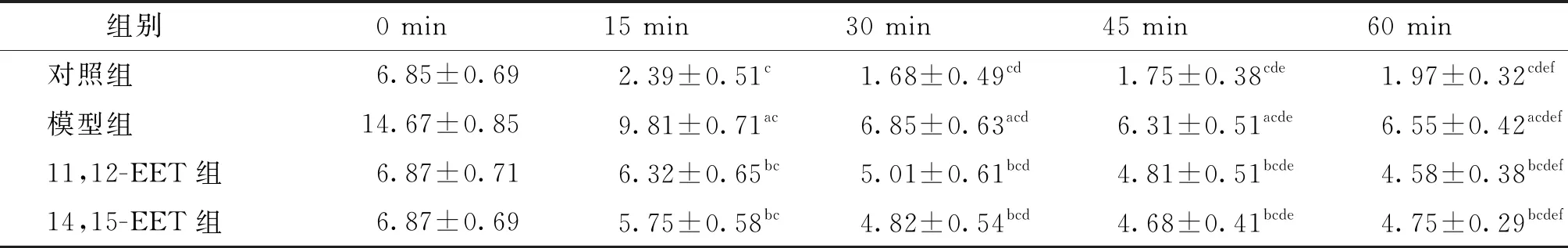
表4 各组小鼠胰岛素耐量实验各时点血糖变化
2.3 各组小鼠炎症反应及巨噬细胞炎性聚集比较
HE染色在普通的光学显微镜下观察:对照组小鼠脂肪细胞大小一致;模型组小鼠脂肪细胞大小不一,且平均面积较对照组明显增大;11,12-EET组及14,15-EET组小鼠脂肪细胞的增大及大小不一等情况出现明显改善(见图1,2)。模型组小鼠巨噬细胞聚集在脂肪细胞周围形成的冠状结构数量明显高于对照组,11,12-EET组及14,15-EET组小鼠巨噬细胞聚集在脂肪细胞周围形成的冠状结构数量明显低于模型组,差异有统计学意义(P<0.05,见图3)。模型组小鼠血清IL-6、IL-1β、TNF-α及MCP-1水平明显高于对照组,11,12-EET组及14,15-EET组小鼠的IL-6、IL-1β、TNF-α及MCP-1水平明显低于模型组,差异有统计学意义(P<0.05,见表5)。
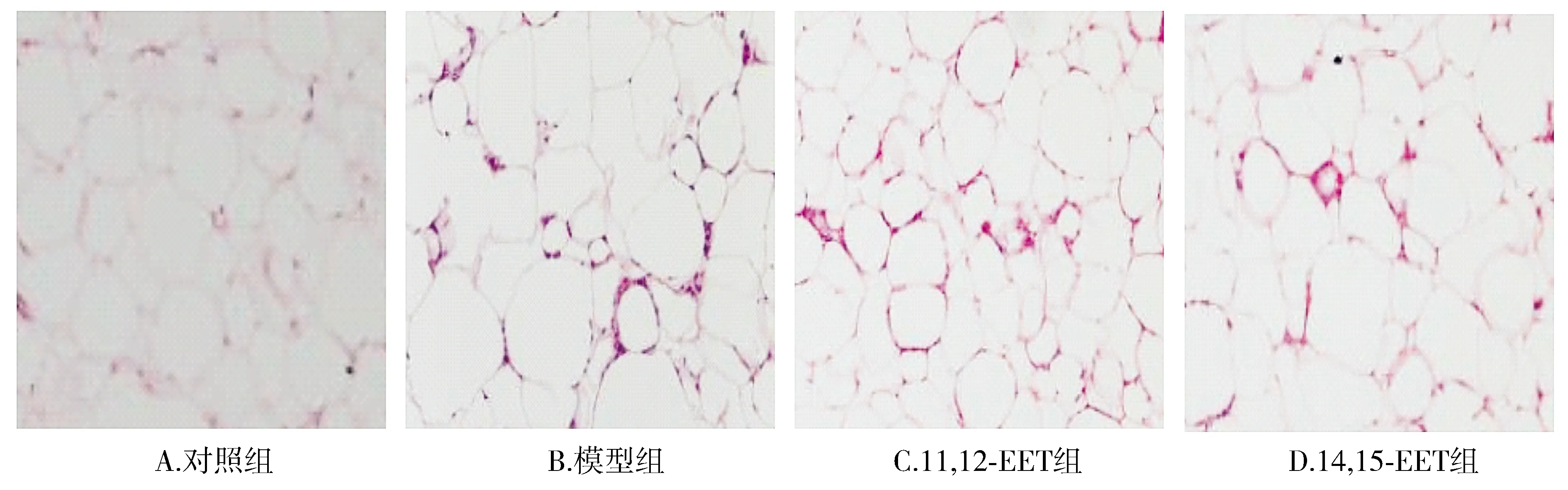
图1 各组小鼠脂肪组织形态变化情况 (HE染色,×20)Figure 1 Morphological changes of adipose tissue of mice in each group (HE staining,×20)
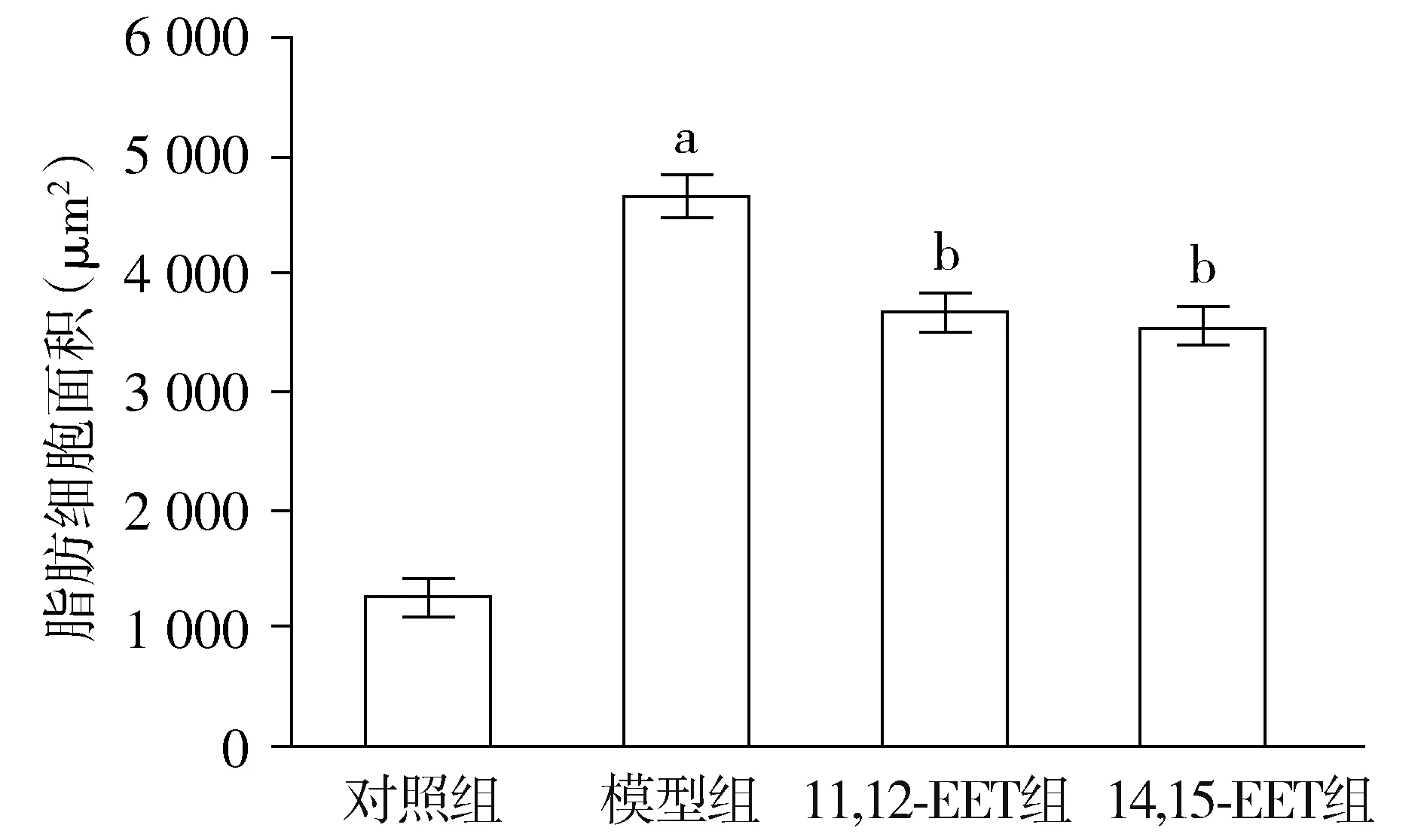
与对照组相比,aP<0.05;与模型组相比,bP<0.05图2 各组小鼠脂肪面积比较Figure 2 Comparison of fat area of mice among four groups

与对照组相比,aP<0.05;与模型组相比,bP<0.05图3 各组小鼠巨噬细胞聚集在脂肪细胞周围形成的冠状结构数量 (n=20)Figure 3 Number of coronal structures formed around adipocytes by macrophages in each group (n=20)
表5 各组小鼠炎症指标比较
2.4 各组小鼠cAMP-EPAC信号通路水平比较
模型组小鼠的Rapgef3 mRNA及EPAC蛋白水平高于对照组,11,12-EET组及14,15-EET组小鼠的Rapgef3 mRNA及EPAC蛋白水平低于模型组,差异有统计学意义(P<0.05,见图4)。
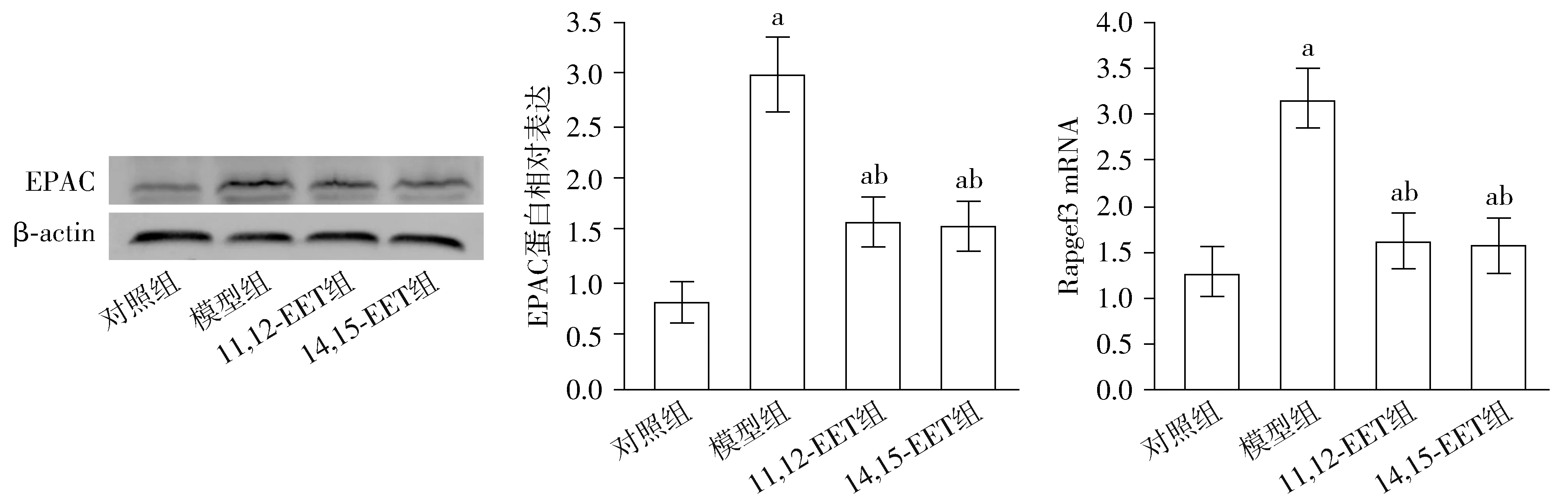
与对照组相比,aP<0.05;与模型组相比,bP<0.05图4 各组小鼠cAMP-EPAC信号通路比较 (n=20)Figure 4 Comparison of cAMP-EPAC pathway among four groups (n=20)
3 讨论
正常情况下,机体摄入的能量与消耗的能量维持在相对平衡的状态[7]。近年来,人们多摄入高能量食物及久坐不起的生活方式导致机体摄入量明显高于消耗量,最终引起脂质异常堆积引发肥胖[8]。肥胖不仅影响人们体型的美感,还可导致2型糖尿病、癌症及心血管疾病等代谢性疾病,严重影响人们的健康[9]。如何改善肥胖、减轻胰岛素抵抗成为医学界学者研究的重点。
脂肪组织是构成人体的重要组成部分,于全身广泛分布,是细胞内良好的储能物质[10]。主要提供热能可保护内脏、维持体温、协助脂溶性维生素的吸收、参与机体各方面的代谢活动等[11]。但脂肪组织的堆积是胰岛素抵抗、血脂异常的最重要危险因素[12]。本研究中,模型组小鼠的体质量、皮下脂肪质量、内脏脂肪质量、血糖、胰岛素、TG及TC水平明显高于对照组,11,12-EET组及14,15-EET组小鼠的体质量、皮下脂肪质量、内脏脂肪质量、血糖、胰岛素、TG及TC水平明显低于模型组。葡萄糖耐量试验中,各组小鼠血糖水平随时间呈先上升后下降的趋势,于15 min达到顶峰,且除0 min外,同时点模型组小鼠的血糖均高于对照组,11,12-EET组及14,15-EET组小鼠血糖均低于模型组。胰岛素耐量实验中,各组小鼠血糖水平随时间呈先下降后上升的趋势,且同时点模型组小鼠的血糖均高于对照组,11,12-EET组及14,15-EET组小鼠血糖均低于模型组。提示,EETs对高脂饮食诱导的小鼠肥胖和胰岛素抵抗有一定的缓解作用。
巨噬细胞是机体免疫系统的重要组成部分,在机体炎症反应中发挥重要作用[13]。但肥胖可导致机体维持持续性、低级别的炎症反应,导致机体巨噬细胞大量聚集,加重机体的炎症反应[14]。本研究以小鼠血清中IL-6、IL-1β、TNF-α及MCP-1等炎症因子水平变化间接评估小鼠炎症反映情况及脂肪组织巨噬细胞极化情况。对照组小鼠脂肪细胞大小一致;模型组小鼠脂肪细胞大小不一,且平均面积较对照组明显增大;11,12-EET组及14,15-EET组小鼠脂肪细胞的增大及大小不一等情况出现明显改善。模型组小鼠巨噬细胞聚集在脂肪细胞周围形成的冠状结构数量明显高于对照组,11,12-EET组及14,15-EET组小鼠巨噬细胞聚集在脂肪细胞周围形成的冠状结构数量明显低于模型组。模型组小鼠的IL-6、IL-1β、TNF-α及MCP-1水平明显高于对照组,11,12-EET组及14,15-EET组小鼠的IL-6、IL-1β、TNF-α及MCP-1水平明显低于模型组。提示,EETs可改善小鼠巨噬细胞炎症聚集和极化情况,减轻炎症反应及调节巨噬细胞极化。
本研究证明,EETs可控制小鼠脂肪组织中的巨噬细胞炎症聚集和极化情况,但尚不清楚其机制。Rapgef3基因编码EPAC蛋白,EPAC蛋白是由cPAC活化后并直接与其结合的鸟嘌呤核苷酸交换因子,主要参与机体能量代谢、慢性疼痛、肿瘤及感染等病理生理过程[15]。模型组小鼠的Rapgef3 mRNA及EPAC蛋白水平明显高于对照组,11,12-EET组及14,15-EET组小鼠的Rapgef3 mRNA及EPAC蛋白水平明显低于模型组。提示,EETs缓解小鼠肥胖和胰岛素抵抗情况,可能与抑制cAMP-EPAC信号通路有关。
综上所述,EETs对高脂饮食诱导的小鼠肥胖和胰岛素抵抗有一定的缓解作用,可能与抑制cAMP-EPAC信号通路,减轻巨噬细胞炎性聚集和极化有关。本实验运用EETs微量泵提高小鼠体内EETs水平,可明显改善高脂饮食诱导的胰岛素抵抗,并证实EETs应用的安全性和有效性,但未在在体水平进行基因芯片的筛选和验证cAMP-EPAC信号通路的重要作用,这有待后续进一步研究。

