禁食对驴屠宰性能与肌肉能量代谢的影响
格日乐其木格 邢敬亚 种肖玉 赵一萍 张心壮 芒来 刘桂芹


摘要:为了研究不同禁食时间处理对德州驴屠宰性能和肌肉能量代谢的影响,选用15头同一性较好的德州公驴,宰前称取空腹活质量,宰后立即称量胴体质量、骨质量等计算屠宰指标,同时取肝脏和肌肉各20 g置于液氮中备用,宰后24 h取背最长肌测定各种能量指标。结果表明,不同禁食组之间各屠宰指标差异不大;禁食组的能源物质含量低于未禁食组,禁食24 h组的极限pH值、ADP含量与肌酸激酶、丙酮酸激酶活性显著高于其他2组,磷酸腺苷(AMP)、肌苷酸(IMP)及乳酸含量又显著低于其他2组。综上所述,长时间禁食(禁食24 h)会减少驴的能量储备,提高极限pH值,降低能量消耗,最终对驴肉品质造成影响。
关键词:禁食;驴;屠宰性能;肌肉;能量代谢
中图分类号:S822.5 文献标志码: A
文章编号:1002-1302(2020)19-0200-06
收稿日期:2019-10-21
基金项目:内蒙古农业大学高层次人才引进科研启动项目(编号:NDYB2016-01);山东省现代农业产业技术体系驴产业创新团队项目(编号:SDAIT-27);山东省高等学校科技计划(编号:J16LF10)。
作者简介:格日乐其木格(1984—),女,内蒙古东乌珠穆沁旗人,博士,副教授,主要从事马属动物种质资源创新与遗传育种研究。E-mail:gerelchimeg@126.com。
通信作者:刘桂芹,硕士,副教授,主要从事马属动物营养与屠宰加工研究,E-mail:guiqinliu@lcu.edu.cn;芒来,博士,教授,主要从事马属动物种质资源创新与遗传育种研究,E-mail:dmanglai@163.com。
随着人们生活水平提高及消费结构变化,驴肉由于其优良的品质特性越来越受到人们的追捧。驴肉相关研究起步较晚,缺乏对其品质影响因素的相关研究。宰前禁食是影响肉品质的主要因素,动物禁食时间过长会降低其屠宰性能,对肉品生产造成经济损失[1-2],这主要是由长时间禁食使动物胃肠道内容物减少及体内能量消耗过多导致能量储备降低引起的[3]。禁食处理还可以通过影响能量代谢,引起肉品极限pH值的变化从而影响肉品质[4]。动物宰后早期的能量代谢对动物肌肉向肉品的转化具有重要影响,对动物宰后肉品质的影响更是不可忽视[5]。供能所需的能量物质(肌糖原、蛋白、脂肪)及其分解产物[乳酸、三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、磷酸腺苷(AMP)、肌苷酸(IMP)、磷酸肌酸(CP)、肌酸(Cr)],还有所涉及到的关键酶[肌酸激酶(CK)、丙酮酸激酶(PK)、乳酸脱氢酶(LDH)、己糖激酶(HK)]都是反映动物能量代谢的重要指标。前人通过大量研究已经证实了宰前禁食管理会对动物宰后能量物质及其分解产物和糖酵解过程中的关键限速酶活性产生影响,间接或直接影响鸡、鸭、猪、牛、羊等畜禽宰后屠宰性能及肉品质[6-7]。有关禁食对驴屠宰性能及能量代谢的研究还是空白。本试验研究不同禁食处理对驴屠宰性能及能量代谢的影响,旨在为阐明禁食对驴肉的作用机制和选择驴的最佳禁食时间提供科学依据。
1 材料与方法
1.1 试验时间与地点
试验于2018年1月20—22日在山东天龙食品有限公司完成。
1.2 试验材料
试验驴由国家黑毛驴繁育中心提供。试验选用同一性较好的2岁左右德州公驴15头[(225±3) kg)],分为未禁食组(对照组)、禁食12 h组(12 h 组)、禁食24 h组(24 h组)3个处理,每个处理组5头。放血完成后开始计时,准确记录宰后成熟时间。屠宰前称量活体空腹质量;屠宰后立即称量胴体热质量、脏器质量、皮质量、骨质量。宰后45 min 内前、后二分体吊挂方式于4 ℃成熟室成熟24 h,成熟期间连续测定驴背最长肌早期pH值变化,宰后24 h取20 g右侧背最长肌(LTL)(第9~18肋骨之间),用生理盐水冲洗干净,滤纸吸干后分装于2个10 mL冻存管中,立即放入液氮中冷冻,然后储存在-80 ℃直至测定驴肉能量代谢指标。屠宰后立即从肝叶中部取20 g肝脏样品,分装于2个10 mL 冻存管中,随即投入液氮中冷冻,然后储存在-80 ℃直至测定肝糖原含量。
1.3 主要试剂、试验仪器与设备
肌酸標准品购自德国DRE公司;核苷酸标准品购自上海甄准生物科技有限公司;BCA蛋白检测试剂盒、肝/肌糖原检测试剂盒、乳酸(LD)检测试剂盒、肌酸激酶(CK)检测试剂盒、己糖激酶(HK)检测试剂盒、乳酸酸脱氢酶(LDH)检测试剂盒、丙酮酸激酶(PK)检测试剂盒,均购自南京建成生物工程研究所;马磷酸化腺苷酸活化蛋白激酶(pAMPK)酶联免疫分析试剂盒,购自上海信裕生物科技有限公司。
便携式pH计(F2-Food,梅特勒)、超高压液相色谱仪(UltiMate3000RSLC,美国Thermo)、隔水式电热恒温培养箱(GNP-9080BS-III,上海新苗)、数显式电热恒温水浴锅(SY-2-6,天津欧诺)、高速冷冻离心机(5804R,德国Eppendorf)、紫外分光光度计(S-3100,韩国Scinco)、组织破碎匀浆机(F6/10,上海FLUKO)、多功能酶标仪(Synergy H1,美国BioTek)、微型漩祸混合仪(WH-Z,上海庐西)、纯水机(Milli-Q A10,美国密理博)、脂肪测定仪(SOX406,济南海能)。
1.4 试验方法
pH值的测定参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》;脂肪含量的测定参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中提供的索氏抽提法进行;蛋白质、肝糖原、肌糖原、乳酸含量的测定以及肌酸激酶(CK)、己糖激酶(HK)、乳酸脱氢酶(LDH)、丙酮酸激酶(PK)、腺苷酸活化蛋白激酶(AMPK)等活性的测定根据试剂盒说明进行;肌肉ATP、ADP、AMP、IMP、CP、Cr含量的测定参照Wang等的高效液相色谱法(HPLC)[8]并作出一定更改进行。
1.6 数据处理
本试验使用SPSS 22.0统计软件进行数据分析,其中各个指标作为因变量,禁食处理作为自变量。试验数据以“平均值±标准差”表示,采用One-Way ANOVA程序对结果进行差异显著性分析,当差异有统计学意义时,再用最小显著差值法(LSD)进行两两比较,P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05表示各组之间指标差异不显著。
2 结果与分析
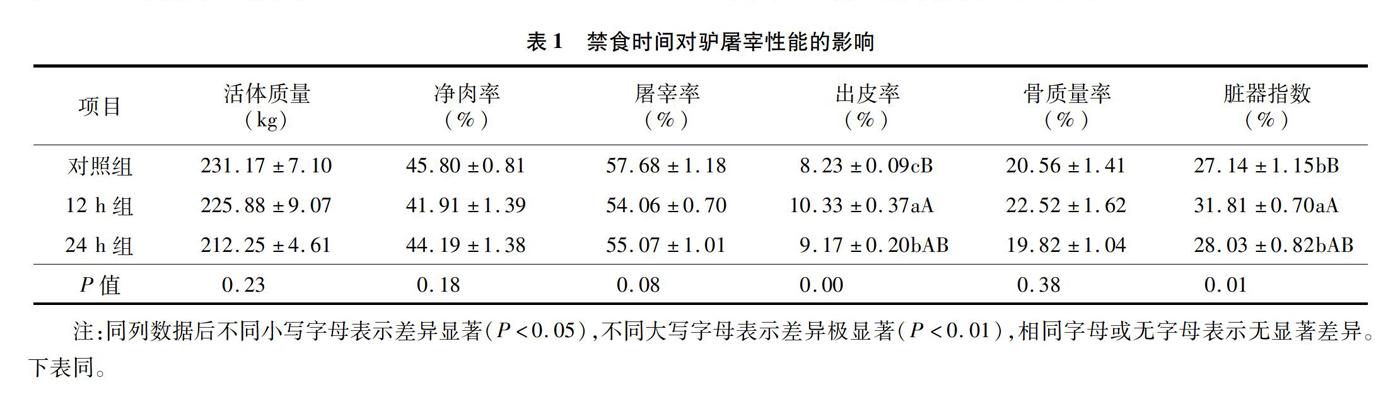
2.1 禁食时间对驴屠宰性能的影响
如表1所示,禁食12 h出皮率与脏器指数均极显著大于未禁食组(P<0.01),显著大于禁食24 h处理组(P<0.05)。禁食24 h组的出皮率显著大于未禁食组(P<0.05)。3组之间的活体质量、净肉率和骨质量率差异不显著。
2.2 禁食时间对驴肉极限pH值的影响
如图1所示,禁食24 h组的极限pH值极显著高于未禁食组(P<0.01),禁食12 h组的显著高于未禁食组(P<0.05),2个禁食组之间差异不显著。
2.3 禁食时间对驴肉能量储备的影响
如表2所示,驴肉中粗脂肪、蛋白质、肝糖原和肌糖原含量随禁食时间的延长而降低。其中禁食24 h组的粗脂肪和肝糖原含量极显著低于未禁食组(P<0.01),蛋白质与肌糖原含量显著低于未禁食组(P<0.05)。禁食12 h组的粗脂肪和肝糖原含量均显著低于未禁食组(P<0.05),蛋白质与肌糖原含量与未禁食组无显著差异。2个禁食组之间的粗脂肪、蛋白质、肝糖原和肌糖原的含量无显著差异。这说明禁食处理会降低驴肉能量储备,禁食时间越长,驴肉宰后糖原、蛋白质和脂肪含量就越低。
2.4 禁食时间对驴肉能量消耗的影响
如表3所示,驴肉中LD、ATP、AMP、IMP和CP的含量均随禁食时间的延长而减小,驴肉中ADP和Cr的含量随禁食时间的延长而增加。禁食24 h组的LD、AMP和IMP含量极显著低于未禁食组(P<0.01),而ADP含量极显著高于未禁食组(P<0.01)。禁食12 h组的LD和IMP含量显著低于未禁食组(P<0.05),AMP含量极显著低于未禁食组(P<0.01),而ADP含量显著高于未禁食组(P<0.05)。
2.5 禁食时间对驴肉糖酵解酶活性的影响
如表4所示,驴肉中肌酸激酶与丙酮酸激酶活性均随禁食时间的延长而增大,己糖激酶活性随禁食时间的延长而降低。禁食24 h组的丙酮酸激酶活性极显著大于未禁食组(P<0.01),显著大于禁食12 h组(P<0.05),肌酸激酶活性极显著大于禁食12 h组与未禁食组(P<0.01)。3组之间的AMPK、己糖激酶和乳酸脱氢酶活性无显著性差异,说明禁食24 h对驴宰后糖酵解酶活性的影响较大。
3 讨论与结论
本研究发现,禁食24 h组的内脏质量低于未禁食组与禁食12 h组,这一结果与Kephart等的报道[9]一致,这主要是因为长时间禁食使得胃肠内容物减少和肝脏质量下降[10],Warriss等研究发现,禁食超过24 h肝脏质量迅速下降,最后稳定在初始质量的80%[3],肝脏质量的下降与长时间禁食引起的肝脏脱水和肝糖原含量降低有关,但内脏质量的降低没有影响到活体质量[10]。本研究中,活体质量、屠宰率和净肉率在3组之间没有显著差异,本研究结果与Karaca等的研究结果[11]相符,但与Warriss等的研究结果[3]相反,其研究表示禁食时间在18~48 h之间,活体质量损失率为0.21%/h,胴体质量的损失率为0.11%/h,这一结果也得到了Panella-Riera等[12]的支持。这可能是因为动物物种不同,其本身的能量代谢有所差异,对禁食的耐受力也不同。本研究中,禁食处理对骨质量和骨质量率没有产生显著影响,但禁食12 h组的皮质量和皮质量率显著高于未禁食组与禁食24 h组。Karaca等的研究结果则表示禁食组的皮质量、头质量和蹄质量均较低[11],造成这一结果的原因还有待进一步探究。但综合驴的屠宰性能研究结果可知,驴的禁食时间在12 h左右为宜,最好不要超过24 h。Panella-Riera也指出,建议宰前禁食时间控制在12~18 h,否则会降低宰后胴体质量[12]。
本研究中,禁食处理对驴肉宰后初始pH值未产生显著性影响,但驴肉的极限pH值随禁食时间的延长而延迟出现并增大,这与Partanen等的研究结果[13]一致,Jones等也表示,长时间禁食会降低糖酵解潜力,提高极限pH值[14-15]。这主要是因为禁食降低了肌糖原储备,使得宰后肌肉中乳酸积累量变少,最终得到较高极限pH值[16-17]。但禁食组与未禁食组的极限pH值均在正常范围之内(5.6~5.8),这与Zimerman等的研究结果[18]相似,即宰前禁食24~96 h处理对动物极限pH值的影响有限。Cavitt等研究指出,禁食可以通过提高极限pH值而影响动物宰后的僵直和嫩化,最终获得较好的肉品质量[19]。
本研究结果表明,禁食处理降低了驴肉粗脂肪、蛋白、肝糖原和肌糖原含量,禁食24 h組与对照组相比能量储备物质含量显著或极显著降低,这与Karaca等的研究结果[11,20]一致。蛋白质、脂肪和糖是动物体内三大供能物质,活体动物供能顺序为肝糖原、脂肪、蛋白质、肌糖原,当然不会严格按照这样的顺序供能,之间会有交叉。在禁食18 h时肝糖原被全部调动起来,而在禁食9 h时脂肪就开始氧化分解供能,禁食超过24 h蛋白质分解产生氨基酸供能[21]。Mahgoub等也表示,宰前较低的能量供给会导致较低的蛋白质和脂肪含量,肌糖原水平一般不会受禁食因素影响太大[22]。本研究中禁食24 h组肌糖原含量显著低于未禁食组,可能是因为长时间禁食增大了驴的宰前应激,从而加速肌糖原的消耗[23-24]。
本研究结果表明,禁食组的乳酸含量显著低于未禁食组,这与pH值24 h的研究结果相吻合,主要与禁食导致肌糖原含量与糖酵解潜力降低有关。本研究中,禁食组ADP含量显著高于未禁食组,AMP和IMP含量则显著低于未禁食组,这说明禁食处理降低了肌肉中ADP的进一步分解消耗,McVeigh等也表示禁食处理显著影响了能量消耗并降低了ADP的分解速率[24]。但本研究结果还表明,禁食处理对ATP、CP和Cr的含量无显著性影响,这与王思丹的研究结果[25]一致。从pH值的变化规律来看,宰后24 h时3个处理组的肌肉均处于僵直后期ATP消耗殆尽,含量稳定,这可能是ATP含量未表现出显著差异的原因。而磷酸肌酸是在宰后前2 h起到供能的作用,故在宰后24 h 3组的CP含量均较少且稳定,无显著性差异,而肌酸作为磷酸肌酸的分解产物,同样在宰后24 h含量稳定,3组之间无显著性差异。本研究结果与Partanen等的研究结果[13,16,26]相似。这可能是动物适应外部条件变化的结果,长时间的禁食处理使得驴通过调节自身能耗,以维持正常生命活动。这证实了Silanikove等的研究结果[27-28],在禁食期间动物会降低自身能量代谢能力,维持密集的细胞体积以应对禁食。
丙酮酸激酶是糖酵解中的关键限速酶,其作用是催化磷酸烯醇丙酮酸(PEP)向丙酮酸转化[29]。本研究中禁食24 h组的丙酮酸激酶活性高于未禁食组与禁食12 h组,表明长期禁食导致驴背最长肌的丙酮酸激酶的活性增加。而徐昶等的研究结果[30-31]与之相反,禁食处理会降低丙酮酸激酶活性。ATP是丙酮酸激酶的活性抑制剂,当ATP/AMP比例降低时丙酮酸激酶被激活[32]。本研究中禁食24 h组的ATP/AMP比值最大,故丙酮酸激酶活性最高。
肌酸激酶可以快速将高能磷酸键转移到ADP并产生ATP[33],其主要存在于骨骼肌、心肌和脑组织中[34]。Bekhit等指出肌酸激酶是屠宰后肌肉能量代谢的主要因素,对肉的食用品质具有重要影响[35-36]。较高活性的肌酸激酶能够维持宰后肌肉中的ATP水平,从而降低宰后肌肉的糖酵解速率和延迟pH值下降[37],与本试验中pH值的研究结果相符。本试验研究结果表明,禁食24 h组的肌酸激酶活性高于未禁食组与禁食12 h组,这与鲁耀彬的研究结果[31]一致,原因可能是禁食24 h组的ADP含量相对较高,从而促进肌酸激酶催化ADP和Pi结合产生ATP反应的进行。
己糖激酶作为糖酵解途径的一种限速酶,对肌肉细胞消耗葡萄糖的能力具有重要影响[38-40]。己糖激酶控制糖酵解和葡萄糖磷酸化的第一步,反应不可逆[41]。在细胞质中葡萄糖浓度增加的情况下,己糖激酶易被激活;当6-磷酸葡萄糖的浓度增加时,己糖激酶活性易被抑制[42]。本研究表明,3组之间己糖激酶活性没有显著性差异。不同的是,鲁耀彬的研究则表示,禁食9 h组樱桃谷肉鸭的己糖激酶活力显著大于未禁食组与禁食3 h组[31],这可能与研究对象的物种差异有关。
乳酸脱氢酶是影响动物肌肉中糖酵解水平的關键指标[43-44],主要存在于骨骼肌中,能够确保肌肉在短暂缺氧期间获取ATP,其活性反映了糖酵解系统提供能量的能力[45]。本研究结果显示,3个禁食处理组之间乳酸脱氢酶活力差异不显著,这可能与3组之间的ATP含量无显著差异有关,鲁耀彬的研究[32]也得出同样的结果。
Du等研究发现,与正常大鼠相比,AMPK突变大鼠的最终肌肉pH值更高,这意味着AMPK活性在决定最终肌肉pH值方面起主要作用[46]。不同的是,Lindholm-Perry等的研究则表明,在饮食中更高的能量消耗导致肌肉中更高的AMPK活性水平[47]。而在本研究中,禁食处理未影响AMPK活性。Apaoblaza等研究发现,高pH值(pH>5.9)组与正常pH值(pH<5.8)组的背最长肌中AMPK的活性分别为5.8%、20.1%[48]。所以,在本研究中,3种处理pH值24 h均<5.8,这可能是3组之间的AMPK活性没有显著性差异的原因。
综上表明,禁食处理会通过降低驴的能量储备和能量消耗速率,以维持驴肉中的能量水平;禁食处理会显著增大驴肉极限pH值,以禁食24 h处理组较为显著,且禁食24 h处理会显著降低驴内脏质量。该试验结果可为制定合理的屠宰工艺提供理论基础。
参考文献:
[1]Faucitano L,Chevillon P,Ellis M. Effects of feed withdrawal prior to slaughter and nutrition on stomach weight,and carcass and meat quality in pigs[J]. Livestock Science,2010,127(2/3):110-114.
[2]Castroverde K B V,Olarve J P,Cruzana B C,et al. Effects of feed withdrawal prior to slaughter on broilers carcass characteristics and meat quality[J]. Philippine Journal of Veterinary Medicine,2010,47(2):98-102.
[3]Warriss P D,Brown S N. The influence of preslaughter fasting on carcass and liver yield in pigs[J]. Livestock Production Science,1983,10(3):273-282.
[4]贾小翠. 禁食对鸡肉宰后僵直及其品质影响研究[D]. 南京:南京农业大学,2011.
[5]Sterten H,Oksbjerg N,Frystein T,et al. Effects of fasting prior to slaughter on pH development and energy metabolism post-mortem in M. longissimus dorsi of pigs[J]. Meat Science,2010,84(1):93-100.
[6]Greenwood P L,Finn J A,May T J,et al. Management of young goats during prolonged fasting affects carcass characteristics but not pre-slaughter liveweight or cortisol[J]. Animal Production Science,2010,50(6):533-540.
[7]吳学壮,李晓娟,凌清露,等. 屠宰前禁食时间对肉鸡体重损失、屠宰性能和血脂指标的影响[J]. 中国畜牧杂志,2019,55(1):110-113.
[8]Wang S D,Li C B,Xu X L,et al. Effect of fasting on energy metabolism and tenderizing enzymes in chicken breast muscle early postmortem[J]. Meat Science,2013,93(4):865-872.
[9]Kephart K B,Mills E W. Effect of withholding feed from swine before slaughter on carcass and viscera weights and meat quality[J]. Journal of Animal Science,2005,83(3):715-721.
[10]Vasconcelos J T,Sawyer J E,Tedeschi L O,et al. Effects of different growing diets on performance,carcass characteristics,insulin sensitivity,and accretion of intramuscular and subcutaneous adipose tissue of feedlot cattle[J]. Journal of Animal Science,2009,87(4):1 540-1 547.
[11]Karaca S,Erdogˇan S,Kor D,et al. Effects of pre-slaughter diet/management system and fasting period on physiological indicators and meat quality traits of lambs[J]. Meat Science,2016,116:67-77.
[12]Panella-Riera N,Gispert M,Gil M,et al. Effect of feed deprivation and lairage time on carcass and meat quality traits on pigs under minimal stressful conditions[J]. Livestock Science,2012,146(1):29-37.
[13]Partanen K,Siljander-Rasi H,Honkavaara M. Effects of finishing diet and pre-slaughter fasting time on meat quality in crossbred pigs[J]. Agricultural and Food Science,2008,16(3):245-258.
[14]Jones S D M,Rompala R E,Haworth C R. Effects of fasting and water restriction on carcass shrink and pork quality[J]. Canadian Journal of Animal Science,1985,65(3):613-618.
[15]Eikelenboom G,Bolink A H,Sybesma W. Effects of feed withdrawal before delivery on pork quality and carcass yield[J]. Meat Science,1991,29(1):25-30.
[16]Wittmann W,Ecolan P,Levasseur P,et al. Fasting-induced glycogen depletion in different fibre types of red and white pig muscles—Relationship with ultimate pH[J]. Journal of the Science of Food and Agriculture,1994,66(2):257-266.
[17]Grey T C,Jones J M,Robinson D S. The influence of death struggle on the rate of glycolysis in chicken breast muscle[J]. Journal of the Science of Food and Agriculture,1974,25(1):57-66.
[34]Wu Z,Liu X H,Zhang J,et al. Determination of serum CK and LDH in rabbits after posterior neck muscles under went long-term stress[J]. China Journal of Orthopaedics & Traumatology,2007,20:61-62.
[35]Bekhit A E D,Farouk M M,Cassidy L,et al. Effects of rigor temperature and electrical stimulation on venison quality[J]. Meat Science,2007,75(4):564-574.
[36]Hou M D,Zeng S Y. Biochemical methods to appraise meat quality[J]. Food Science,2000,21:121-123.
[37]Li X,Yang X,Shan B,et al. Meat quality is associated with muscle metabolic status but not contractile myofiber type composition in premature pigs[J]. Meat Science,2009,81(1):218-223.
[38]Kashiwaya Y,Sato K,Tsuchiya N,et al. Control of glucose utilization in working perfused rat heart[J]. Journal of Biological Chemistry,1994,269(41):25502-25514.
[39]Manchester J,Kong X,Nerbonne J,et al. Glucose transport and phosphorylation in single cardiac myocytes:rate-limiting steps in glucose metabolism[J]. American Journal of Physiology,1994,266(1):326-333.
[40]程鎮燕,范泽,张植元,等. 注射葡萄糖对鲤鱼糖代谢关键酶和相关激素的影响[J]. 江苏农业科学,2018,46(4):163-167.
[41]王广宇,刘 波,谢 骏,等. 鱼类糖代谢几种关键酶的研究进展[J]. 上海水产大学学报,2008,17(3):377-383.
[42]King L M,Opie L H. Glucose and glycogen utilisation in myocardial ischemia—Changes in metabolism and consequences for the myocyte[J]. Molecular and Cellular Biochemistry,1998,180(1/2):3-26.
[43]李 望,胡盛寿,魏英杰,等. 心肌梗死对大鼠心肌能量代谢途径中关键酶的影响及意义[J]. 中国分子心脏病学杂志,2008,8(5):277-280.
[44]Lebret B,Le Roy P,Monin G,et al. Influence of the three RN genotypes on chemical composition,enzyme activities,and myofiber characteristics of porcine skeletal muscle[J]. Journal of Animal Science,1999,77(6):1482-1489.
[45]王 勇. 不同海拔地区人血清乳酸脱氢酶同工酶的研究[J]. 高原医学杂志,2005,15(4):59-60.
[46]Du M,Shen Q W,Zhu M J. Role of beta-adrenoceptor signaling and AMP-activated protein kinase in glycolysis of postmortem skeletal muscle[J]. Journal of Agricultural and Food Chemistry,2005,53(8):3235-3239.
[47]Lindholm-Perry A K,Kuehn L A,Oliver W T,et al. DNA polymorphisms and transcript abundance of PRKAG2 and phosphorylated AMP-activated protein kinase in the rumen are associated with gain and feed intake in beef steers[J]. Animal Genetics,2014,45(4):461-472.
[48]Apaoblaza A,Galaz A,Strobel P,et al. Glycolytic potential and activity of adenosine monophosphate kinase (AMPK),glycogen phosphorylase (GP) and glycogen debranching enzyme (GDE) in steer carcasses with normal (<5.8) or high (>5.9) 24h pH determined in M. longissimus dorsi[J]. Meat Science,2015,101:83-89.

