渥丹组织培养技术研究
李艳敏 张晶 王朝阳 徐梦岚 蒋卉 符真珠 张和臣
摘要:为了保护渥丹野生资源,加快其繁殖速度,开展以渥丹鳞茎为外植体的组织培养技术研究,筛选不定芽诱导、增殖及生根的最佳培养基,并进行移栽试验。结果表明,渥丹鳞茎的中部鳞茎片适宜不定芽诱导,采用先预处理鳞茎再整体灭菌的方法,中部鳞片的污染率为10.0%,诱导和增殖培养基均为MS+0.1 mg/L KT+1.0 mg/L NAA+30 g/L 蔗糖+6 g/L琼脂,诱导率为100%,增殖系数为2.78;渥丹试管苗诱导生根培养基为1/2MS+0.5 mg/L NAA+1.0 g/L AC+20 g/L蔗糖+6 g/L琼脂,生根率为100.0%,平均根数4.1条,平均根长为3.69 cm,同时该处理的生根试管苗移栽成活率为100.0%。
关键词:渥丹;鳞茎;增殖;生根;移栽
中图分类号:S682.2+65.04+3 文献标志码: A
文章编号:1002-1302(2020)19-0052-04
收稿日期:2020-05-12
基金项目:河南省科技攻关计划(编号:192102110148)。
作者简介:李艳敏(1978—),女,河南汤阴人,硕士,副研究员,主要从事园林植物组培快繁技术研究。E-mail:minzili@126.com。
通信作者:张和臣,博士,副研究员,主要从事园林植物遗传育种及分子生物学相关研究。E-mail:zhc5128@126.com。
渥丹是百合科(Liliaceae)百合屬(Lilium)多年生草本球根植物,产于河南、河北、山东、山西、陕西和吉林,花深红色,有香味,可观赏,亦可提取芳香油作香料;鳞茎含淀粉,可食用或酿酒,也可入药,具有滋补强壮、止咳之功效[1]。渥丹是红花百合育种的重要亲本材料[2],也是百合科生物多样性重要资源,具有良好的发展和应用前景。为了保护渥丹种质资源,同时又能够开发利用这一重要资源,开展了其繁殖技术研究。目前关于渥丹的研究主要有不同居群形态多样性、核型和花粉多样性等[2-4],其繁殖以扦插为主[5],关于渥丹的离体培养技术研究报道很少[6-7],研究者主要筛选了不同部位鳞片灭菌的适宜时间和培养基对增殖培养的影响,缺少对生根培养及移栽的系统研究,研究中存在外植体污染率高的问题,以中部鳞片为外植体,污染率为595%[6]。因此,本研究选择渥丹地下鳞茎为外植体,采用先对鳞茎进行预处理再将鳞茎整体灭菌的方式进行消毒,降低渥丹外部和中部鳞片的污染率,同时对影响生根的激素种类和浓度进行筛选,并研究活性炭对渥丹试管苗生根的影响,对不同来源的生根苗分别进行移栽,根据试管苗生根率和移栽成活率确定最佳的生根培养基,完善其组织培养技术,为渥丹的综合利用提供技术支撑。
1 材料与方法
1.1 材料
2018年在河南省南阳市宝天曼山中发现渥丹野生植株,取1株苗带回郑州,于2018年5月至2019年5月在河南省农业科学院园艺研究所园艺植物组织培养室,开展其组织培养技术研究。
1.2 方法
将取下的小鳞茎用自来水冲洗干净,用洗洁精、多菌灵和羧苄溶液进行预处理,然后拿到超净工作台上进一步消毒灭菌,具体方法是用75%乙醇灭菌30 s,然后用0.1% HgCl2灭菌8 min,用无菌水冲洗1遍,再用0.1% HgCl2灭菌8 min,无菌水冲洗3遍,然后进行接种。接种时,将鳞茎按照从外到内的包裹顺序分别切割,分为外部鳞片(W)、中间鳞片(Z)和内部鳞片(N) 3种,观察这3种外植体的污染情况、诱导出芽情况以及诱导出不定芽数量。
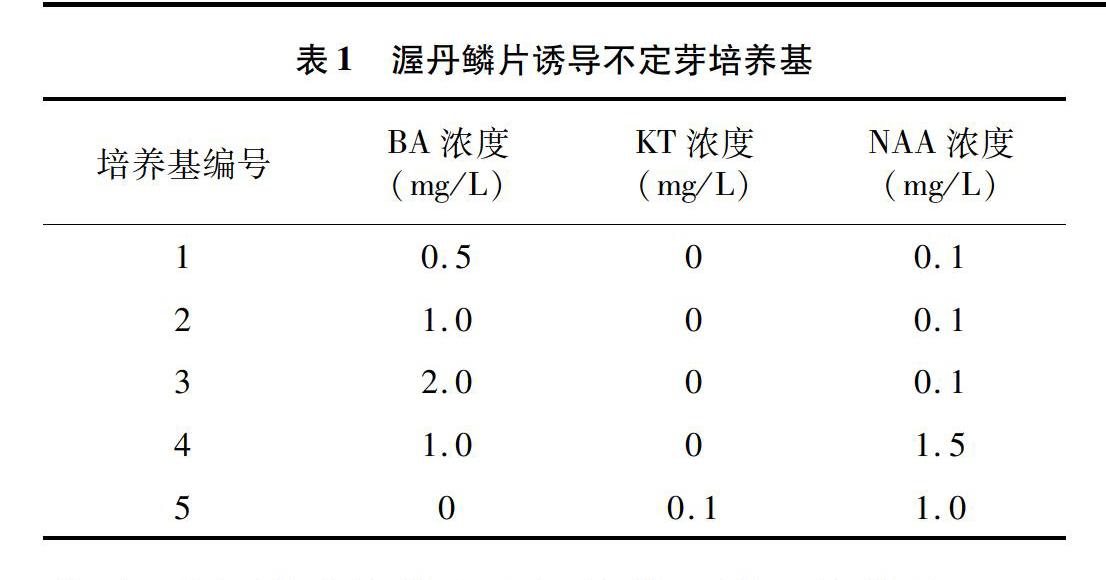
渥丹鳞片诱导不定芽的培养基以MS为基本培养基,附加的植物生长调节物质有BA、KT以及NAA,具体的使用浓度及配比见表1。以中部鳞片为研究材料,观察不同诱导培养基对不定芽诱导率及不定芽个数的影响。
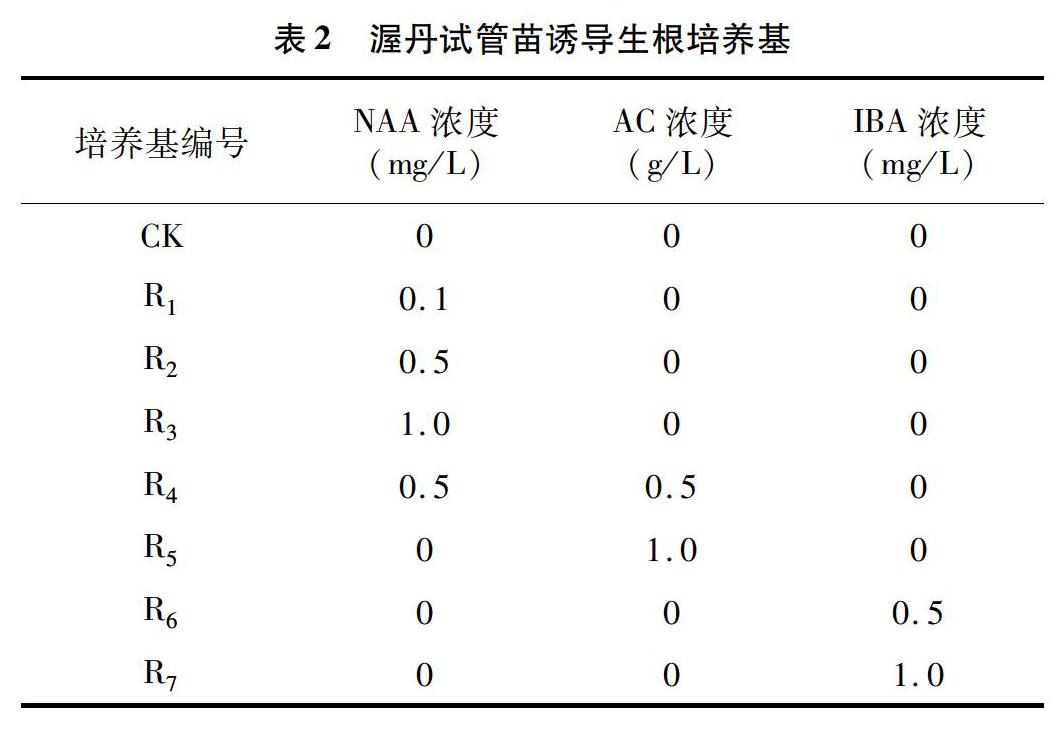
将诱导出来的不定芽在MS+1.0 mg/L NAA+0.1 mg/L KT+30 g/L蔗糖+6 g/L琼脂培养基上继代培养3代, 然后获得足够多的生长一致的无菌苗后,进行增殖培养和生根培养。增殖培养基以MS培养基为基本培养基,附加1.0 mg/L NAA、30 g/L蔗糖、6 g/L琼脂,KT的浓度分别为0、0.1、0.5、10 mg/L,观察不定芽的增殖情况;生根培养基同样以MS为基本培养基,其中大量元素减半,附加的激素种类及浓度见表2。
以上培养均以30 d为周期,增殖和生根培养时,每个处理接种9瓶,每瓶4株苗,重复3次。培养条件为(25±2) ℃,光照度2 000 lx,光照周期为12 h/d。
将不同生根诱导培养基来源的渥丹生根苗分别进行移栽,移栽基质均为珍珠岩与草炭(1 ∶1)的混合基质,栽后放在育苗室,温度为(23±2) ℃,并盖膜保湿,移栽1周后通风,移栽1个月后统计各处理生根苗的移栽成活情况。
增殖培养和生根培养以及移栽均采用单因素完全随机设计,所得数据用DPS 6.55软件进行统计分析。
2 结果与分析
2.1 不同部位鳞片消毒及出芽效果
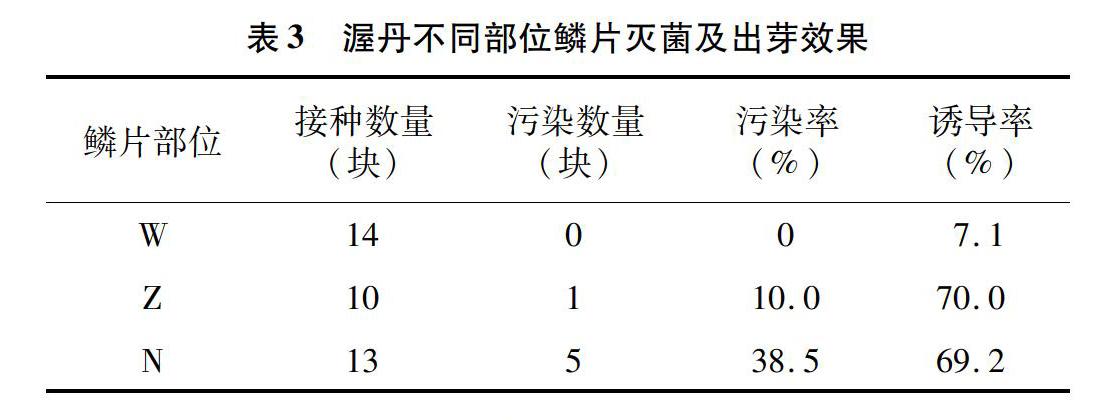
渥丹不同部位鳞片,其消毒效果也不相同。从表3中可以看出,外部鳞片(W)的污染率最低,为0,其次是中部鳞片(Z),污染率为10.0%,内部鳞片(N)出现都是白色的细菌污染,污染率最高,为385%,应该是由于鳞片在内部,灭菌液无法充分对其消毒造成,因此选择中外部鳞片作为外植体,污染率低。
不同部位鳞片诱导出芽的能力有差别,从表3中可以看出,W的诱导率仅7.1%,而Z和N的诱导率分别为70.0%、69.2%,是W诱导率的10倍左右,说明Z和N作为渥丹外植体,诱导效率最好。结合污染率和诱导率,中部鳞片适宜作为渥丹组织培养的外植体。
2.2 不同培养基对中部鳞片诱导效果的影响
将中部鳞片接种到不同的诱导培养基上,观察诱导培养基对其不定芽诱导的影响。从表4可以看出,在培养基2和培养基5中,鳞片的诱导率均为100%,诱导出来的不定芽数量分别为2、4个,其他3种培养基诱导率均为50%,诱导出来的不定芽均为1个,说明培养基2和5适合中部鳞片不定芽诱导,以培养基5最为合适,即0.1 mg/L KT+10 mg/L NAA的组合能够用于鳞片不定芽诱导。
2.3 增殖培养基筛选
从表5以看出,仅添加1.0 mg/L NAA的对照,其增殖系数为2.28,苗鳞茎片大,叶片多,同时伴有玻璃化现象发生。添加不同浓度的KT后,试管苗的增殖系数和生长状况有不同变化,添加0.1 mg/L KT的B1处理,其增殖系数为2.78,与对照差异不显著,但试管苗分化的鳞茎多,有生根现象;当KT浓度进一步增加到0.5 mg/L(B2处理)和 1.0 mg/L(B3处理)时,增殖系数开始下降,其中B2处理增殖系数为1.97,与CK、B1处理差异不显著,B3处理增殖系数为1.55,显著低于B1处理,但是与CK和B2处理差异不显著,并且渥丹试管苗鳞茎片大,叶片少,生长势弱。因此,渥丹增殖的适宜培养基为MS附加1.0 mg/L NAA和0.1 mg/L KT。
2.4 不同生根培养基对渥丹试管苗生根及移栽的影响
从表6可以看出,渥丹试管苗在不添加激素的空白培养基中,可以达到100.0%的生根率,但是平均根数少,仅2.9条;添加不同浓度和种类的生长素以及AC后,生根率和平均根数及平均根长均呈现不同的变化。单添加不同浓度的NAA(处理号T1~T3)后,与对照相比,生根率和平均根长显著下降,但是T1和T2处理的平均根数显著增加,以T2处理的平均根数最多,为5.0条;将NAA和AC配合使用(处理号T4~T5)时,生根率和对照相比差异不显著,但是平均根数显著高于对照,并且T5处理的生根率为100.0%,平均根数为4.1条,平均根长 3.69 cm,显著高于对照;将NAA和IBA配合使用(处理号T6~T7时),T7处理的生根率与对照无差异,平均根数显著高于对照,但是平均根长显著低于对照。因此,与对照相比,添加适宜浓度的NAA和IBA后,可以促进渥丹试管苗平均根数的增加,但是会抑制根长生长;添加适宜浓度的AC后,可以促进渥丹试管苗平均根数和平均根长,提高生根苗质量。
将不同来源的渥丹生根试管苗经过相同的炼苗方式,移栽到相同基质后,移栽成活率可以达到89.4%及以上,不同处理的植株移栽成活率稍有差异,来源于T5的生根苗,移栽成活率最高,为1000%,与CK差异不显著;在移栽苗生长势方面,来源于CK、T1、T4、T5处理的植株挺立,生长势良好,这些处理的试管苗平均根长均在1.0 cm以上,来源于T2、T3、T6处理的植株生长势弱,植株不挺立,这3个处理的试管苗平均根长均低于1 cm,说明平均根长对试管苗移栽后的生长影响较大。
综上,渥丹试管苗在T5处理中生根率和生根质量最好,并且移栽成活率也最高,为渥丹试管苗的最佳生根培养基。
3 结论与讨论
外植体灭菌技术是植物组织培养研究中的一项重要内容,鳞茎由于生长在土壤中,带菌较多,灭菌较困难,污染率较高[8],在以往的渥丹离体培养报道中,对鳞茎的灭菌方式是冲洗鳞茎,剥下鳞片,按不同部位进行洗洁精刷洗,流水冲洗,再用0.1% HgCl2溶液2次灭菌,污染率得到了良好的控制,但是对外部鳞片和中部鳞片而言,污染率依然分别在43.33%、28.33%以上[2]。在本研究中,对渥丹地下鳞茎的灭菌方法进行了改良,首先在预处理环节,对鳞茎进行整体处理,并采用头孢和羧苄溶液初步消毒,然后再在超净台上用75%乙醇和0.1% HgCl2进行消毒,无菌水冲洗结束后,再开始剥下鳞片接种。采用此方法灭菌,有效地降低了污染率,尤其降低了外部鳞片和中部鳞片的污染率,但是由于鳞茎整体灭菌,灭菌液不能很好地渗透到内部鳞片,出现内部鳞片灭菌不彻底,均为细菌污染,污染率高。不同部位的鳞片,其诱导率有差异,诱导能力从强到弱依次为中部鳞片>内部鳞片>外部鳞片,这与赵静等的研究结果[9]一致,与杨伟茹等的研究结果[6,10]不一致,这可能与灭菌方式不同有关。鲁润龙以百合鳞片进行组织培养时发现,芽原基来源于鳞片表皮细胞及其邻近皮层细胞分裂加快,撕去表皮细胞时,则无法形成芽原基,不能形成鳞茎[11]。在本研究中,外部鳞片的诱导率很低,可能是因为外部鳞片与灭菌液接触时间长,灭菌液对鳞片表皮损伤严重,从而降低了其诱导分化能力。
植物生长调节剂在试管苗不定根形成过程中起决定性作用,适宜浓度的生长调节剂不仅有利于诱导根原基,还有利于不定根的生长,但过高浓度的生长调节剂会抑制根原基的生长,进而影响根伸长[12]。在百合的组织培养研究中,药用百合生根时,幼苗生根时采用1/2MS附加NAA时,诱导出的根短且粗壮,有根毛,移栽易成活[13];南川百合无根苗生根的最佳培养基为1/2MS+0.5 mg/L NAA,生根率为86.7%[9];野百合试管苗以不加任何激素的1/2MS生根最好,添加0.2 mg/L NAA时对生根有抑制作用[14];活性炭具有吸附作用,同时能够提供一种黑暗环境,有利于植物生根[15],百合生根时培养基中添加活性炭后生根时间早,不定根浓密粗壮[12]。本研究结果表明,渥丹试管苗生根培养时,培养基中添加0.1~0.5 mg/L生长素可以提高生根数量,NAA的浓度达到1.0 mg/L时,生根率、平均根数和平均根长都显著降低;将NAA和IBA配合使用,对试管苗生根率和根数有促进,但是显著抑制根生长。在不添加任何激素的空白培养基中,生根率可以达到100.0%,但是生根质量一般,主要表现在根数和根长方面,平均根數为2.9条,平均根长为2.26 cm;在生根培养基中添加0.5 mg/L NAA和10 g/L AC的T5处理中,生根率为100.0%,平均根数为4.1条,平均根长为3.69 cm,显著高于对照处理,并且在对生根试管苗进行移栽后发现,T5处理的移栽成活率为100.0%,对照处理的移栽成活率为98.5%,说明活性炭可以促进渥丹试管苗生根,提高生根率和生根质量,有利于移栽,这与张俊秀的研究结果[12]一致。
综上,以渥丹鳞茎为外植体进行组织培养,采用预处理后再将鳞茎整体消毒的方法,可以降低污染率,中部鳞茎片适宜不定芽诱导,诱导和增殖培养基均为MS+0.1 mg/L KT+1.0 mg/L NAA+30 g/L 蔗糖+6 g/L琼脂,诱导率为100%,增殖系数为2.78;渥丹试管苗诱导生根培养基为1/2MS+0.5 mg/L NAA+1.0 g/L AC+20 g/L蔗糖+6 g/L琼脂,生根率为100.0%,平均根数4.1条,平均根长为3.69 cm,同时该处理的生根试管苗移栽,其成活率为100.0%。
参考文献:
[1]汪发缵,唐 进. 中国植物志第14卷:百合科[M]. 北京:科学出版社,1980.
[2]王 欣,雷家军,张丽娜,等. 渥丹百合种内居群形态多样性研究[J]. 沈阳农业大学学报,2007,38(6):796-800.
[3]王 欣,雷家军,李明旭. 渥丹百合不同居群核型研究[J]. 中国农学通报,2006,22(10):281-284.
[4]王 欣,雷家军,关婧竹. 渥丹百合种内花粉多样性研究[J]. 黑龙江农业科学,2007(1):47-49.
[5]张雅倩,王宇婷,曾 慧,等. 不同激素处理对有斑渥丹扦插繁殖的影响[J]. 贵州农业科学,2018,46(9):108-111.
[6]杨炜茹,孙 明,刘 鹏,等. 野生渥丹离体培养再生体系的研究[J]. 安徽农业科学,2009,37(2):533-534.
[7]朱星樽,滕孝花,顾地周. 基于均匀设计法优化渥丹鳞茎发生及高效快繁体系[J]. 通化师范学院学报,2008,29(10):42-44.
[8]周春華,尤 超,陈凝华. 百合组织培养研究进展[J]. 北方园艺,2013(14):193-195.
[9]赵 静,帅明蓉,赵玉飞,等. 南川百合组织培养与快繁技术体系研究[J]. 西南师范大学学报(自然科学版),2012,37(6):109-115.
[10]蔡宣梅,方少忠,林 真. 药用百合组织培养与试管苗假植技术研究[J]. 西北农业学报,2004,13(4):152-155.
[11]鲁润龙. 百合组织培养中不同发育途径的激素调节[J]. 中国科学技术大学学报,1989,19(1):137-140.
[12]张俊秀. 百合组培苗生根培养基配方的筛选[J]. 安徽农业科学,2017,45(12):124-125.
[13]金亚征,俞凤芳,车瑞香,等. 药用百合组织培养快繁技术研究[J]. 经济林研究,2013,31(1):124-128.
[14]余朝秀,关文灵. 野百合组织培养的研究[J]. 西部林业科学,2005,34(2):76-78.
[15]孙占育,孙志强,曹 斌. 活性炭在促进组培苗植物生根中的作用[J]. 湖南农业科学,2010(7):3-5.

