牛呼吸道合胞体病毒实时荧光定量PCR检测方法的建立
韦佳塔,侯广争,伍钢,张玉雪,陈海兰*,刘琪琦*
(1. 广西大学动物科学技术学院,广西 南宁 530005;2. 军事医学研究院辐射医学研究所,北京 100850)
牛呼吸道合胞体病是由牛呼吸道合胞体病毒(bovine respiratory syncytial virus,BRSV)感染引起的养牛业面临的严重疾病,可造成巨大的经济损失[1]。病毒、细菌和支原体感染,以及应激和环境因素,如断奶、温度、放养密度、粉尘、湿度、运输和营养不良都可以引起牛呼吸道合胞体病的发生和发展[2-3]。BRSV感染后可导致永久性肺损伤,使病畜更容易出现呼吸道症状,还可以促进机会性继发性病原体的侵袭,如溶血性链球菌、多杀性巴氏杆菌、流感嗜血杆菌和一些支原体物种,对动物的生产性能造成长期的影响,严重损害动物的生长速度和养殖户的经济回报[4]。因此,在感染BRSV的养殖场,由于死亡损失、生产和生长性能下降以及疫苗和治疗的费用,每年所造成的经济损失接近10亿美元[5]。
BRSV是一种有囊膜的单股负链RNA病毒,属于副黏病毒科肺病毒属,在世界范围内流行,是牛呼吸道疾病的主要病原体之一。牛呼吸道合胞体病曾在比利时、荷兰和比利时等国发生暴发,抗体阳性率可达80%,死亡率超过20%;美国、丹麦、墨西哥等国的BRSV抗体阳性率均高于50%。我国养牛省份BRSV抗体平均阳性率则高达69.6%,其中内蒙古抗体阳性率最高可达92.8%,位居国内各省首位,吉林、山西、河南、辽宁和广西等省份抗体阳性率也高达70%以上,就连抗体阳性率最低的江西省也达到了41.28%[6-7]。BRSV的检测方法主要包括牛胚胎肾细胞(bovine embryonic kidney cells,BEK)分离培养[4]、酶联免疫吸附试验[8]和普通PCR方法[9],实时荧光定量PCR(RT-qPCR)对生物安全性要求低,可实现BRSV快速检测,目前已逐步成为BRSV感染快速检测的主要方法之一[10]。为规范RT-qPCR的试验操作流程,确保检测结果准确有效,本研究参考标准物质的研制方法[11],根据BRSV核酸检测的全基因组保守序列N基因片段,采用克隆技术和体外转录的方法,制备出BRSV核酸检测的参考品,并借助数字PCR进行联合定值和不确定度分析。此外,使用该参考品作为模板,设计并筛选了引物和探针,通过对扩增体系各项条件进行优化,建立了BRSV RT-qPCR快速检测方法,并对其特异性、敏感性及准确性进行评价。
1 材料与方法
1.1 病毒来源
牛呼吸道合胞体病毒VR-1485株、牛副流感病毒3型(bovine para influenza virus 3,BPIV 3)购自美国标准生物品收藏中心,牛病毒性腹泻病毒1型(bovine viral diarrhea virus 1, BVDV1)购自北京华威特生物科技有限公司,口蹄疫病毒(foot-and-mouth disease virus,FMDV)O型没活疫苗购自中牧实业股份有限公司,小反刍兽疫病毒(pestedes petits ruminants virus,PPRV)弱毒疫苗购自新疆天康畜牧生物技术股份有限公司,牛传染性鼻气管炎病毒(infectious bovine rhinotracheitis virus,IBRV)Bartha-Nu/67株、丝状支原体丝状亚种SC型(mycoplasma mycoides subsp mycoides SC, MmmSC)PG1标准株均购自中国兽医药品监察所,蓝舌病毒(bluetongue virus,BTV)血清型10、水泡性口炎病毒(vesicular stomatitis virus,VSV)印第安纳株由本实验室保提供和保存。
1.2 主要试剂
核酸提取试剂盒购自Invitrogen公司,体外转录试剂盒Ribo MAXTM Large Scale RNA Production System-T7购自Promega公司,Neoscript RT Premix(Probe qRT-PCR)购自珠海宝锐生物科技有限公司,Premix Ex TaqTM、pBM20S Toposmart克隆试剂盒、Prime ScriptTM One Step RT-PCR Kit反转录试剂盒、Mini BEST Plasmid Purification、DNA Fragment Purification Kit均购自TaKaRa公司。
1.3 核酸提取
利用核酸自动提取仪对疫苗及样品的病毒核酸进行提取。在1.5 mL无RNase离心管中加入10 μL Proteinase K、4 μL Acryl Carrier、300 μL Lysis Buffer、20 μL磁珠,将疫苗、病毒或菌株样品稀释处理后,取200 μL加入上述核酸提取体系,震荡混匀离心管,室温下颠倒混匀10 min,使磁珠和核酸充分结合。将离心管放在磁力架上1 min,待磁珠被吸附到底部后,弃去管内液体。取下离心管,加入500 μL Wash Buffer Ⅰ,使磁珠重新悬浮,并将离心管置于磁力架上,吸磁1 min后弃去管内液体。然后取下离心管,加入500 μL Wash Buffer Ⅱ,使磁珠重新悬浮,将离心管放在磁力架上,吸磁1 min后,弃去管内液体,离心管仍置于磁力架上,使磁珠继续被吸附。接着将550 μL Wash Buffer Ⅲ加入离心管,尽量不要冲起磁珠,1 min后弃去管内液体。取下离心管,加入80 μL Elution Buffer,磁珠重新悬浮,55 ℃水浴5 min,其间轻轻晃动离心管2次,充分洗脱核酸。最后,将离心管放在磁力架上,1 min后将液体转移至新的1.5 mL无RNase离心管,并置于-20 ℃保存备用。
1.4 BRSV核衣壳(N)蛋白基因的扩增、克隆和序列分析
对BRSV-N基因序列进行多重比对,设计并筛选出一对引物(表1)用于特异性扩增BRSV-N基因序列,预期片段长度为224 bp。提取BRSV的完整基因组核酸,再以其作为模板,采取RT-PCR扩增N基因的保守序列。扩增程序参数为50 ℃ 20 min,95 ℃ 3 min,95 ℃ 15 s、55 ℃ 30 s、72 ℃ 10 s,35 个循环。将回收纯化后的BRSV目的片段克隆于pGEM-T载体,并转入大肠杆菌DH5α感受态细胞,构建重组质粒DH5α-N,测序鉴定。
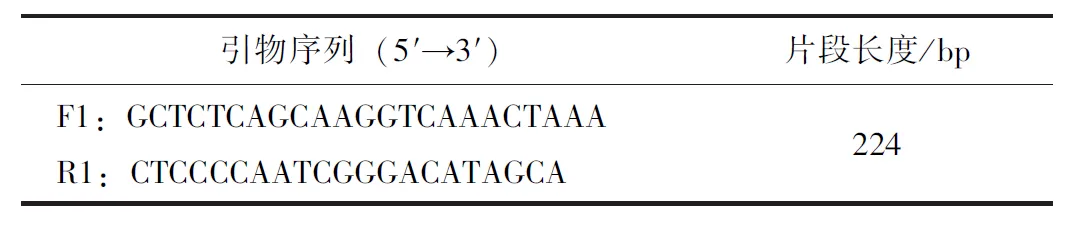
表1 引物序列
1.5 体外转录病毒RNA制备BRSV参考品
利用限制性内切酶SmalⅠ对DH5α-N重组质粒线性化,通过T7反转录试剂盒对线性化的质粒进行体外转录,用DNA酶消除体系中的DNA模板,再重新用TRIzol提取体系中RNA,以去除溶液中的各种杂蛋白和离子,即获得RNA纯品。将RNA纯品稀释500倍,通过超微量光谱仪测量其OD260和OD280,再将RNA纯品梯度稀释10-6~10-9,最后将10-9对半稀释至5-10,利用筛选好的引物探针结合伯乐QX-200数字PCR仪,计算RNA拷贝数。利用RNA稳定储存液将cRNA稀释至1011拷贝数/mL,然后分装保存。
1.6 BRSV RT-qPCR方法的建立和优化
根据GenBank上收录的牛呼吸道合胞体病毒完整基因组(MG947594.1)中最保守的N基因,通过DNA star软件进行多重比对分析,选取保守序列利用Primer Express 3.0.1设计和筛选出一对特异性引物探针(表2),建立BRSV的RT-qPCR快速检测方法。引物和探针均由北京擎科生物科技有限公司合成。再以制备的BRSV参考品cRNA当作模板,通过上述引物探针进行RT-qPCR方法的优化,找到最佳扩增条件及扩增体系,主要有Buffer浓度、引物探针浓度以及反应程序参数等。
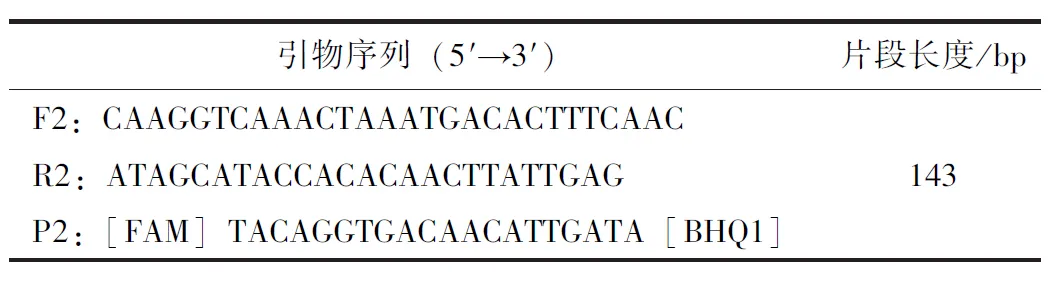
表2 引物序列
1.7 特异性试验
利用建立的方法对BRSV、BPIV、PPRV、IBRV、BTV、CBPP、VSV、FMDV和BVDV等病毒核酸同时进行检测,以验证该方法的特异性。
1.8 灵敏度试验
将纯化后的BRSV-N cRNA参考品梯度稀释至103~108拷贝数/mL后,通过上述优化好的BRSV RT-qPCR体系进行检测,并以无菌水当作阴性对照,根据试验结果,来确定该方法的最低检测限,并绘制相应的标准曲线。
1.9 重复性试验
随机抽取同一批次3个不同梯度的BRSV-N cRNA参考品各3管,同时采取BRSV RT-qPCR快速检测方法进行检测,计算组内变异系数;再随机抽取不同批次3个不同梯度的BRSV-N cRNA参考品当作模板,利用建立的BRSV RT-qPCR快速检测方法重复检测3次,计算组间变异系数,以评价该方法的重复性和稳定性。
1.10 临床样本检测验证
利用建立的RT-qPCR方法和普通PCR方法对实验室之前收集的已知背景的35份牛鼻拭子临床样本进行检测,比较两种方法的检测结果。并将判定为阳性的样本测序结果进行BLAST分析。
2 结果
2.1 BRSV-N基因的扩增、克隆和测序
提取储存在实验室的BRSV基因组,并逆转录制备其cDNA当作模板使用,利用F1/R1引物通过PCR扩增BRSV-N基因。琼脂电泳图显示,PCR扩增的基因片段大小约224 bp,与预期符合(图1)。将扩增产物进行回收纯化后,克隆到DH5α感受态细胞中,构建重组质粒DH5α-N,将测序结果在NCBI上与参考序列进行同源性比对。结果显示,两者同源性为100%,进一步表明BRSV的目标片段序列与克隆载体pGEM-T已成功连接,可将该重组质粒作为TaqMan荧光PCR的模板。

M. Marker; 1. BRSV-N基因的cDNA模板PCR产物
2.2 BRSVcRNA参考品的制备与定值
重组质粒DH5α-N经SmalⅠ酶切后,通过T7反转录试剂盒对线性化的质粒进行体外转录获得cRNA,再将cRNA用无RNA酶灭菌水500倍稀释,测量其OD260和OD280。结果显示,OD260和OD280的比值均在1.9~2.0之间,说明RNA纯度高。再将RNA纯品梯度稀释10-6~10-9倍,最后将稀释度10-9RNA对半稀释至5-10,利用筛选好的引物探针,经伯乐QX-200数字PCR仪联合定值后,计算得到参考品浓度为(1.11±0.04)×1011拷贝数/mL(图2),利用RNA稳定储存液将cRNA稀释至1011拷贝数/mL,最后分装成0.5 mL/管,并置于-80 ℃冰箱中保存。
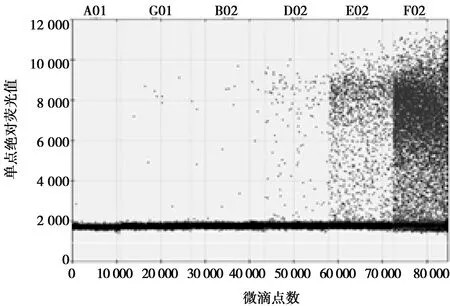
A01. 阴性对照;G01. BRSV(5-10);B02. BRSV(10-9);D02. BRSV(10-8);E02. BRSV(10-7);F02. BRSV(10-6)
2.3 BRSV RT-qPCR检测方法的建立和反应条件优化
用已制备的BRSV-N参考品cRNA为扩增模板,优化RT-qPCR的各项扩增条件。经过重复性试验,确定BRSV RT-qPCR的最佳反应体积为25 μL,其中RNA模板3 μL;上下游引物的最佳浓度均为0.8 μmol/L,探针浓度为0.12 μmol/L,Mg2+浓度为3 mmol/L;最适反应条件为50 ℃ 20 min、95 ℃ 3 min、95 ℃ 15 s、50 ℃ 30 s,40个循环;每个循环50 ℃结束时采集荧光。
2.4 特异性试验
采用建立的BRSV RT-qPCR方法,对BRSV核酸以及上述8种反刍动物病原核酸进行检测。结果显示,所建立的方法能够快速准确地检测出BRSV的核酸,而不与另外8种反刍动物病原核酸发生非特异性扩增(图3),表明该方法特异性高、通用性好。
2.5 灵敏度试验
将已制备的BRSV-N cRNA参考品梯度稀释至103~108拷贝数/mL后,通过上述优化好的BRSV RT-qPCR体系进行检测,并将无菌水作为阴性对照,得到的最低检测限可达104拷贝数/mL(图4)。
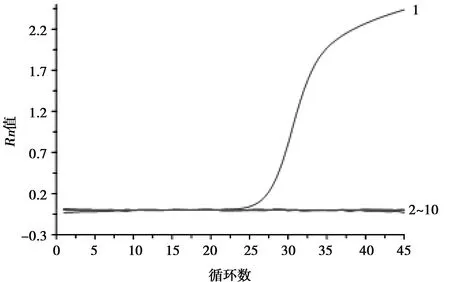
1. BRSV;2~9. BPIV, IBRV, BVDV, BTV, CBPP, VSV, PPRV, FMDV;10. 阴性对照

1~6. BRSV-N cRNA 103~108倍稀释后的荧光扩增曲线;7. 阴性对照
依据图4检测极限的结果,利用宏石qPCR仪自带的分析软件对循环阈值(Ct值)和参考品中cRNA浓度进行线性回归分析,绘制标准曲线(图5)。结果显示,参考品cRNA浓度与试验所得Ct值呈良好线性关系,y=44.154-3.912x,R2>0.999,表明所建方法可用于BRSV核酸的定量。
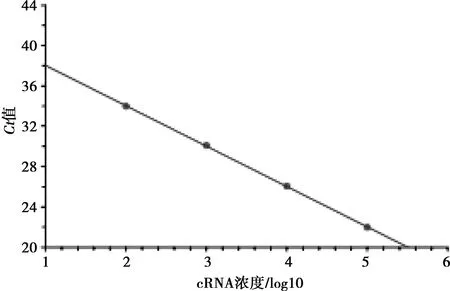
图5 BRSV RT-qPCR标准曲线
2.6 重复性试验
组内变异系数和组间变异系数结果表明,两者变异系数都小于2%(表3),说明制备的参考品重复性和稳定性较好。
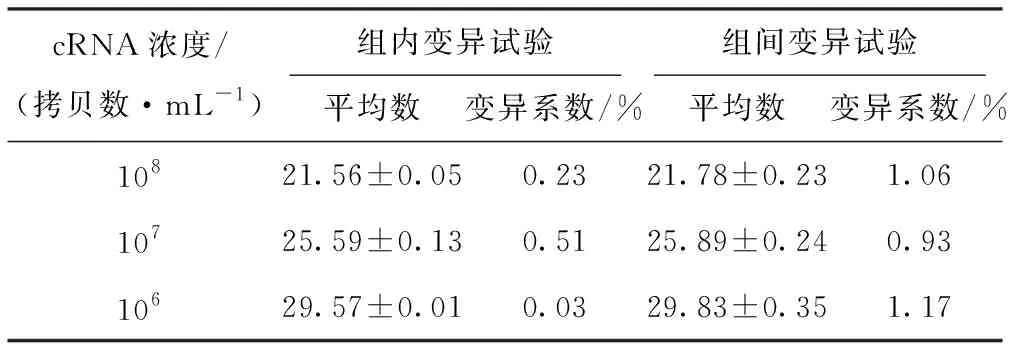
表3 RT-qPCR重复性试验结果
2.7 临床样本的检测
收集实验室保存的已知背景的病料共计35份临床样本,分别使用上述建立的RT-qPCR快速检测方法与普通PCR方法进行检测。结果显示,普通PCR能够检出11份临床样本为阳性,而本方法能够检测出12份临床样本为阳性,并且与基因测序的检测结果一致(表4)。将上步判定为阳性的临床样本测序结果进行BLAST分析,结果表明,测序结果与参考序列(MG947594.1)一致,确定为BRSV-N基因序列。
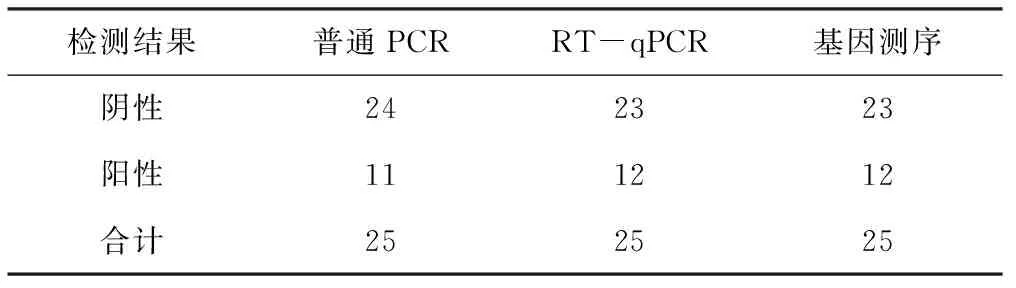
表4 临床样本的检测结果 份
3 讨论
BRSV在世界范围内引起多种牛呼吸道疾病,特别是在犊牛肺炎的发生和发展中起到重要作用。此外,BRSV感染可使犊牛容易受到溶血性链球菌、多杀性巴氏杆菌和嗜血杆菌等微生物的继发性感染,从而增加牛呼吸道疾病的复杂性,是导致饲育牛高发病率和死亡率的重要因素[12]。即使在动物没有死于牛呼吸道疾病的情况下,对生产性能也会有长期的损害。因此,建立一种快速、高效、特异性强的检测方法对我国BRSV感染的防治具有重要的意义。
目前,尽管病毒分离被认为是鉴定BRSV的金标准测试,但该检测方法所需时间较长,通常为3~4周[13]。运输过程中病料内的病毒不稳定,引起感染程度下降和感染力减弱,常导致检出率低于实际水平。另外,该方法对实验室的标准要求非常严格,不适合样本量大且复杂的基层使用[14]。酶联免疫吸附试验是一种快速、灵敏、高效的血清学诊断技术,因而被广泛应用于该病的诊断[15]。虽然该检测方法可以快速得到结果,但目前少有直接检测病原的ELISA试剂,在某些情况下无法达到检测要求,作为常规诊断适用性有限[16]。传统PCR多为定性试验,产物经电泳后才能在紫外凝胶成像仪中观察到目的条带,结果无法定量且实验时间较长[17]。RT-qPCR是以传统PCR为基础发展起来的一种新型核酸检测技术,能快速鉴定感染动物及其产品中的BRSV,目前已被逐渐作为该病的快速诊断和检测的主要手段[18]。但是现有的大部分BRSV核酸检测产品中缺少核酸参考品,对样本中病毒的相对定量也缺乏准确依据。因此,我们首先通过反转录方法制备了BRSV的cRNA参考品,并对参考品的稳定性和重复性进行了验证,采用数字PCR方法对参考品的浓度进行了定量,在进行临床样本检测时,可利用该参考品绘制的标准曲线对样本中的BRSV含量进行准确定量,为制定个性化的治疗方案和防控策略提供依据。
N基因是BRSV最保守的序列[19],本研究以其作为BRSV核酸检测的目标基因,通过基因克隆和体外转录制备了含有N基因片段的cRNA参考品,该参考品不具有感染性。组内和组间重复性的检测结果变异系数均小于2%,定值结果为(1.11±0.04)×1011拷贝数/mL,可用作阳性参考品。此外,应用本研究制备的BRSV RNA参考品为模板,同时利用设计合成的BRSV引物探针,通过优化RT-qPCR的各项扩增条件,建立了BRSV RT-qPCR快速检测方法。应用优化后的方法对制备的BRSV参考品进行检测,检测极限可达104拷贝数/mL病毒核酸。采用建立的方法和普通PCR方法对35份临床样本及其他相关病毒核酸进行检测,结果显示普通PCR能够检出11份临床样本为阳性,而本方法能够检测出12份临床样本为阳性,且与基因测序结果一致,表明本研究所建立的RT-qPCR方法比普通PCR方法更为灵敏,能够满足BRSV临床检测的要求,可有效避免在临床检测中由于病毒载量低而发生的漏检。同时,本研究建立的RT-qPCR方法,检测不到另外8种反刍动物病原核酸,说明该方法具有较高特异性。总之,本研究方法的建立为我国BRSV的快速检测提供了物质基础。

