上海地区犬细小病毒病流行情况调查与病毒的分离鉴定
沈海潇, 李鑫,杨德全,鞠厚斌,刘健,龚国华,赵洪进
(上海市动物疫病预防控制中心,上海 201103)
犬细小病毒(canine parvovirus,CPV)属于细小病毒科细小病毒属,是危害犬类的最主要的烈性传染病之一,从发现至今已在世界各地均有流行。该病毒传播速度快、对幼犬有很高的致病性和致死率,给世界养犬业带来巨大的灾难。CPV 可感染犬科动物包括犬、猫和其他易感动物,且具有发病急、病程短、传染性强、死亡率高的特点。CPV-2存在3种亚型,即 CPV-2a、CPV-2b、CPV-2c,近些年来又进化为 new CPV-2a、CPV-2c(a)、CPV-2c(b)[1-2]。虽然犬细小病毒是DNA病毒,但却有着与 RNA 病毒类似的高突变率,值得引起我们的重视。
犬细小病毒病发病具有明显的季节性,即冬季高发,夏季发病较少,其原因可能是寒冷季节导致犬的抵抗力下降,发病率明显增加[4-5]。CPV所致的临床症状表现取决于病毒的毒力、感染程度和宿主抵抗力,按临床症状可分为肠炎型和心肌炎型[6]。本病最初 24~48 h内一般不出现腹泻,若发生腹泻也很少出现便血。炎症会继发肠道蛋白质减少,造成低蛋白血症。呕吐是常见症状,严重时可引起食管炎,还会引起骨髓干细胞破坏,导致暂时性或长期性中性粒细胞减少,使动物发生严重的细菌感染,尤其是肠道损伤使得细菌易于进入机体。病情严重的犬可见体温升高、全身炎性反应综合征。幼犬可经子宫感染本病,在 8 周龄前的幼犬常常表现为心肌炎[7-10]。
本研究初步调查了2019年上海地区家养犬及流浪犬CPV感染的流行情况并对流行毒株进行分离培养、进化分析、以及形态学鉴定,以阐明上海地区CPV感染的流行率,病原遗传变异及分子特征等,为该病的防控提供参考依据。
1 材料与方法
1.1 病料采集与处理
定期收集来自上海犬类留验场以及各宠物免疫点犬的粪便。采集的新鲜粪便样本第一时间送回实验室处理。
处理过程:取阳性病料0.5 g,用DMEM细胞营养液10倍稀释,振荡器充分混匀,5 000 r/min离心10 min,取上清,经0.22 μm微孔滤膜过滤后,4 ℃保存备用或-80 ℃保存。
1.2 细胞系
猫肾传代细胞(F81)购自中国科学院细胞库;细胞按常规消化传代,37 ℃静置培养。
1.3 主要试剂
TaqDNA聚合酶购自宝生物工程(大连)有限公司;MagPure Viral RNA Kit购自Magen公司;DMEM、胎牛血清购自Gibco公司;犬细小病毒荧光定量试剂盒购自书扁科技有限公司;PEG 8000购自Scientan公司。
1.4 犬细小病毒的检测
1.4.1 核酸提取
取0.25 g的粪便样品加入含1 mL PBS的EP管中,溶解混匀后,按MagPure Viral RNA Kit说明书进行核酸提取。
1.4.2 荧光定量PCR
根据犬细小病毒荧光PCR检测试剂盒说明书进行操作,对于每一个反应体系:PCR预混液20 μL,Taq酶0.25 μL,DNA 5 μL。程序设置如下:94 ℃ 3 min;94 ℃ 5 s;60 ℃ 30 s(收集荧光),40个循环。
1.5 病毒的分离与鉴定
1.5.1 病毒的分离
取阳性病料0.5 g,用DMEM细胞营养液10倍稀释,振荡器充分混匀,5 000 r/min离心10 min,取上清,经0.22 μm微孔滤膜过滤后,置-30 ℃冻存备用。选择刚刚长满单层的F81细胞,倒掉培养液,用PBS浸洗,加入600 μL病毒悬液,置于5% CO2,37 ℃培养箱中吸附 60 min,之后取出培养瓶,用无血清培养基清洗细胞,然后加入 10 mL 含2%胎牛血清的DMEM培养基,置温箱中继续培养3~5 d,每日观察细胞生长状态是否出现细胞病变;对不同代次培养物进行荧光定量PCR检测,连续3代未检出阳性且没有细胞病变者,判为阴性。将接毒细胞液置于-80 ℃冰箱中保存备用。利用Reed-Muench法计算病毒的TCID50。
1.5.2 病毒的鉴定
将分离到的病毒使用PEG 8000进行浓缩后,在透射电镜下进行病毒形态的观察。
1.6 基因片段的cDNA克隆、鉴定和测序
根据GenBank上已发表的犬细小病毒VP2基因序列,进行引物的设计及合成,提取病毒基因,具体步骤按照说明书进行。得到片段大小相符的PCR产物送桑尼生物有限公司测序。
1.7 绘制系统发育树
借助MEGA6软件,确定这4株犬细小病毒VP2基因的遗传分类情况。参考菌株信息见表1。

表1 参考毒株背景信息

续表1
2 结果
2.1 上海地区犬细小病毒病流行情况
对上海地区犬类留验场、养殖场以及各免疫点采取定期的集中监测,共采集粪便样品796份,阳性率为30.65%。其中,流浪犬的粪便样品675份,阳性率为34.52%;家养犬的粪便样品121份,阳性率为9.10%。不同月份的犬细小抗原阳性率见图1。

图1 上海地区犬细小病毒病流行情况
2.2 病毒分离和细胞病变
将检测阳性的犬粪便样品处理后,接种F81细胞,其中4个组在接毒细胞的前2代没有出现明显病变,但是经过荧光定量PCR检测发现Ct值明显下降,传至第3代细胞出现脱落、崩解和破碎及肿胀圆缩、拉网等细小病毒特有的细胞病变(CPE)。在细胞培养96 h时出现明显的CPE,阴性对照未出现CPE(图2)。选择其中一株继续传代,传至第17代后测定其滴浓度为107.0TCID50/mL。

图2 CPV在F81细胞中产生的CPE(200×)
2.3 病毒形态
在电子显微镜下观察,病毒呈现二十面体立体对称,无囊膜,直径为20 nm左右的典型细小病毒样粒子(图3)。
2.4 绘制系统发育树以及氨基酸序列分析比较
将CPV/CHINA/SH-1进行了全基因测序, GenBank登录号为:MN840830。使用MEGA6对分离到4株CPV VP2基因进行遗传演化分析(图4),表明分离到的毒株既有2c型,也存在2b型。通过分析可以看出,本次分离到的毒株与同一亚型的在我国分离到的毒株亲源关系较近。此外,在2c亚型中,我国国内分离的CPV-2c已经与国外分离得到的CPV-2c形成了明显的两个分支,说明我国的CPV在进化过程中呈现出一定的地域特性。另外,从结果上看犬细小病毒的疫苗株与本次分离到的毒株亲缘性较远,提示现有疫苗对目前所流行的犬细小病毒的保护效果需要进行新的评估。

图3 分离到的CPV电镜形态学观察
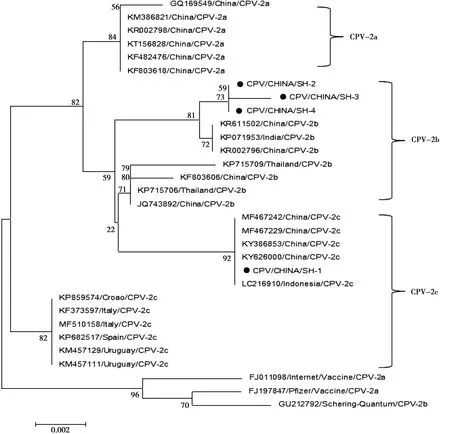
● 本研究中得到的分离株
3 讨论
犬细小病毒病是临床上最常见的犬类疾病之一,我国曾经主要流行的是CPV-2a亚型[11],但在2010年以后,开始陆续报道CPV-2c的出现[12]。目前世界各地许多地区均报道了CPV-2c的出现,韩国也于最近首次报道了感染CPV-2c的病例[13]。这说明犬细小病毒不仅在持续变异,同时还以很快的速度传播,并具有跨区传播的能力。在临床上普遍认可的治疗方法是对症治疗,在最近的几项临床研究中发现,用重组猫干扰素治疗,可以降低死亡率,更快地改善临床症状[14]。而在预防方面,CPV由于可以在环境中长期存在,且能够在很长的一段时间内保持感染性[15],因此定期的疫苗接种格外重要。现有的针对CPV的疫苗类型有弱毒苗、亚单位疫苗、灭活苗以及核酸疫苗。市面上流行的CPV疫苗以弱毒苗为主,其在防控犬细小病毒病的过程中起到了重要的作用。只是目前在全世界范围内,对于疫苗的接种还并未有一个明确、科学的标准,而幼犬由于受母源抗体的干扰,在疫苗接种的时间上也存在争议。研究表明,幼犬在初次免疫后隔5周或6周应当重新接种一次疫苗,其原因是,加强免疫有助于高水平抗体保持较长时间并减少母源抗体的干扰,从而起到较好的保护效果[16];而成年犬则至少应该每3年接种一次疫苗[17]。
在CPV的持续变异的压力下,对区域内犬细小病毒的持续监测,仍是第一时间对其进行有效防控的前提。本研究对2019年上海地区犬类留验场以及各宠物免疫点进行了CPV的定期集中监测,结果表明,CPV在流浪犬中的阳性率明显高于家养犬(分别为34.52%和9.10%),此外不同月份CPV的阳性率也存在一定差异,这提示我们,气候、温度等环境因素也是防控过程中需要注意的。
对阳性粪便样品进行了CPV的分离,成功获得4株CPV毒株,随后对4株毒株的VP2基因进行测序,并绘制基因进化树。结果显示,本次分离到的犬细小病毒中,1株属于CPV-2c型,其余3株属于CPV-2b型,而且CPV的疫苗株与本次分离到的毒株亲缘性较远,提示现有疫苗对上海地区所流行的CPV的保护效果需要进行重新评估。
本次研究结果提示,上海地区CPV呈现出多亚型的混合流行,并且在长期进化和免疫压力下正在发生持续的变异,从而导致了防控难度进一步加大,这可能也是目前临床上CPV感染病例逐渐增多和免疫犬发病的重要原因之一[18]。对CPV的长期持续监测,不仅能够第一时间了解目前上海地区CPV的流行与变异情况,还能够以此来实时调整防控手段,改进防控技术,对上海地区养犬业有着重大意义。

