应用守恒法解决化学计算问题
◇ 江苏 徐 磊
化学是以实验为基础的自然学科.实验分为定性实验和定量实验,所以化学计算是化学的一个重要方面,它体现了学生对实验数据的分析和处理能力.高考化学中每年都有一些定量运算类试题,这些试题一般来说都可以根据化学方程式及反应的过程,筛选数据并应用数据进行计算,但这样的运算过程会比较繁杂,其实可以用守恒法解决问题.通过化学中的三个定量守恒法则,即原子数目守恒、电荷守恒以及氧化还原反应中的电子得失数目守恒,找到反应中的守恒关系即可正确解决相关问题.
例单质硫在Na OH的热溶液中发生歧化反应:3S+6Na OH=2 Na2S+Na2SO3+3 H2O,若硫过量,进一步反应生成 Na2Sx(x≤5)和 Na2S2O3.将2.56 g S与含0.06 mol Na OH的热溶液充分反应恰好生成amol Na2Sx和bmol Na2S2O3,再加入足量的NaCl O与Na OH的混合溶液,硫元素全部转化为Na2SO4,转移电子nmol,则以下各选项正确的是( ).
A.a=2bB.x=2
C.n=0.48 D.b=0.02
解析
本题是一个关于氧化还原反应计算的选择题,涉及的氧化还原反应比较多,我们可以将试题进行抽象描述如图1所示.
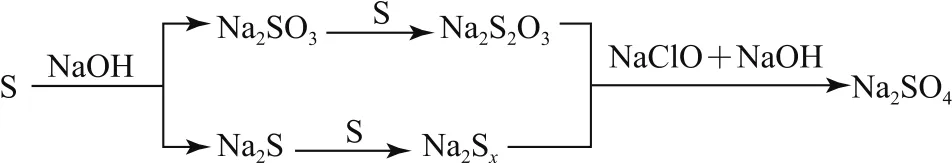
图1
由图示表征我们可以看出在该题中发生的氧化还原反应有5个(这里就不一一写出),如果根据氧化还原反应的方程式计算,则计算的过程过于繁杂.氧化还原反应中不仅存在反应前后的原子数目守恒,同时还存在着氧化还原反应的电子得失数目守恒,因此可通过守恒法简化解决问题的过程.
根据题中所给的已知条件可以把题中反应分为两个阶段:第一阶段,硫与氢氧化钠反应生成的产物是硫代硫酸钠(Na2S2O3)和多硫化钠(Na2Sx);第二阶段,在所得的硫代硫酸钠和多硫化钠溶液中加入足量的Na Cl O和Na OH混合溶液,将所有价态的硫元素都氧化为Na2SO4中的+6价硫元素.
根据钠原子数目守恒,Na OH溶液中钠原子物质的量等于amol Na2Sx和bmol Na2S2O3中的钠原子的物质的量,所以可得方程

根据硫原子数目守恒,可得方程

再根据氧化还原反应中得失电子数目相等寻找第三个方程:得电子的变化是从硫变为多硫化钠(Na2Sx),这里我们可以用整体法即将S2-x看成整体为-2价,也可以根据化合价代数和为零,标出单个硫原子的化合价为,在应用时是一样的,因此我们可以得出生成amol Na2Sx时得到的电子数为2amol;同样发生氧化反应失去电子的过程是从硫变为硫代硫酸钠(Na2S2O3),其中硫元素的化合价为+2价,则得到生成bmol Na2S2O3时失电子数为4bmol,从而就可以根据电子得失数目守恒得到第三个方程

同样,由于nmol电子是在第二阶段氧化还原中发生的电子转移,所以我们可以根据第二阶段发生的氧化还原反应的电子得失数目守恒解决问题.在此变化中由于加入的是足量的氧化剂,无法计算氧化剂得电子数,但还原剂多硫化钠和硫代硫酸钠的物质的量已知,所以我们可以根据氧化还原反应中电子转移数等于氧化剂总的得电子数也等于还原剂总的失电子数进行计算,即根据amol Na2Sx转化为Na2SO4失电子数为(6xa+2a)mol,而bmol Na2S2O3转化为Na2SO4失电子数为8bmol,从而可以得到如下方程

将以上①②③④4个方程式联立,就可以解得a=0.02,b=0.01,x=3,n=0.48.
我们再来看一看n的求算,其实虽然从表面看是在求第二个阶段的电子得失数目或者说转移数目,但实际上同样可认为是硫元素由0价最终变成了+6价,所以可得转移的电子数即为n=0.08×6=0.48.
由以上典例的问题解决我们可以看到,应用反应中的原子守恒、氧化还原反应中得失电子数目守恒以及离子反应中的电荷守恒,可以将动态的反应过程简化,根据守恒的法则就可以更为简便地解决问题.
——硫代硫酸钠

