Musashi-1下调在抑制神经胶质瘤细胞恶性表型中的意义
毛中臣 孙永 赵燕 陈卡佳 付志新 (开封市中心医院神内重症,河南 开封 475000)
神经胶质瘤(胶质瘤)是起源于中枢神经系统的恶性肿瘤,占颅内原发肿瘤的50%,手术治疗、放射治疗、化学治疗等是目前胶质瘤治疗的主要途径,随着胶质瘤发病机制研究的不断深入,寻找有效的靶基因治疗胶质瘤是研究的重点〔1〕。Musashi-1参与细胞的自我更新和分化过程,其是一个进化极为保守的RNA结合蛋白。研究显示Musashi-1可能是一种致癌基因,能够刺激肿瘤细胞的生长,增加肿瘤细胞致瘤能力〔2〕。对结肠癌和肺腺癌的体外研究显示,Musashi-1下调可以诱导肿瘤细胞的凋亡〔3~5〕。本实验通过构建下调Musashi-1的胶质瘤细胞,探讨其在胶质瘤细胞凋亡、侵袭等中的作用,为靶向Musashi-1治疗胶质瘤提供理论依据。
1 材料与方法
1.1材料 胶质瘤细胞U251和U87为赛业(苏州)生物公司产品。细胞于含有10%胎牛血清的DMEM培养液,在37℃,饱和湿度,5%CO2培养箱中培养。
兔抗活化型含半胱氨酸的天冬氨酸蛋白水解酶(cleaved caspase)-3抗体、兔抗基质金属蛋白酶(MMP)-9抗体、兔抗波形蛋白(vimentin)抗体为美国R&D Systems公司产品;兔抗MMP-2抗体、兔抗上皮性钙黏附素(E-cadherin)抗体为美国Santa Cruz公司产品;Musashi-1 siRNA慢病毒和阴性对照慢病毒载体由深圳中洪博元生物公司构建;Musashi-1为美国Abcam公司产品;Realtime PCR试剂为德国QIAGEN公司产品;Line Gene 9600 Plus荧光定量PCR检测系统为杭州博日科技公司产品;Thermo Multiskan FC 酶标仪为美国Thermo产品;Biosciences FACSAria Ⅲ流式细胞仪为美国BD产品。
1.2方法
1.2.1慢病毒感染 胶质瘤细胞U251和U87培养至对数期以后,分别种植到6孔板中,细胞接种密度为5×105个/孔,细胞密度为40%时,进行感染。病毒感染复数(MOI)=20,向细胞中加入病毒液(病毒液滴度为1×108tu/ml),同时在细胞中添加聚凝胺(polyberne),polyberne终浓度为5 μg/ml。培养8 h后,观察细胞生长状态,把原来的培养液吸弃,加入新鲜的细胞培养液,继续培养3 d以后,用1 μg/ml的嘌呤霉素筛选,筛选稳定感染的细胞株用Realtime PCR和Western印迹检测干扰效果。
1.2.2实验分组 把感染Musashi-1 siRNA慢病毒后的细胞记为si-Musashi-1组,把感染阴性对照慢病毒后的细胞记为si-NC组。把没有感染的细胞记为Control组。
1.2.3Realtime PCR测定干扰效果 Control组、si-NC组、si-Musashi-1组细胞中添加Trizol(每个25 mm2的培养瓶中加入1 ml的Trizol),将细胞置于冰上混合裂解以后,在裂解液中添加200 μl三氯甲烷溶液,并置于室温条件孵育3 min,在4℃,10 000 r/min离心10 min后,吸取上层溶液约500 μl(RNA存在上层水相中)。添加等体积的异丙醇后,放在4℃条件下结合孵育30 min。离心后,添加75%乙醇将沉淀的RNA洗涤后,在室温中干燥,添加焦碳酸二乙酯(DEPC)水溶解,保存至-70℃。按照逆转录合成试剂盒合成cDNA,设置逆转录条件为37℃ 15 min、85℃ 5 s,4℃ 10 min。再进行Realtime PCR,PCR的程序为:95℃ 15 s;58℃ 60 s,一共40个循环。PCR结束后,用2-△△Ct方法计算目的基因Musashi-1的mRNA表达情况,以β-actin作为内参。引物由南京金斯瑞合成。Musashi-1的上游引物序列为5′-CCTATTTCCCATGATTCCTTCATA-3′,下游引物序列为5′-GTAATACGGT TATCCACGCG-3′;β-actin的上游引物序列为5′-GGACCTGACTGACTACCTC-3′,下游引物序列为5′-TACTCCTGCTTGCTGAT-3′。
1.2.4Western印迹测定干扰效果 向Control、si-NC、si-Musashi-1各组细胞中添加裂解液,并放置在冰上反应20 min,4℃,10 000 r/min高速离心。蛋白样品与等体积的上样缓冲液中混合后,煮沸5 min。按照每个泳道加入40 μg蛋白样品,浓缩胶中80 V电压,分离胶中100 V电压进行电泳。电泳结束后,进行转膜,转膜置于4℃中进行,转膜电流设置为200 mA,转膜时长为2 h。取出转膜后的聚偏氟乙烯(PVDF)膜,置于封闭液(5%脱脂奶)中室温孵育2 h,用TBST洗涤后,再将PVDF膜放在1∶200稀释的抗Musashi-1抗体中室温孵育2 h。PVDF膜经TBST洗涤后,置于1∶5 000稀释的Ⅱ抗中室温结合2 h。用电化学发光(ECL)试剂盒显色以后,以软件Image J分析灰度值,以每组的β-actin灰度值为内参,分析并计算Musashi-1/β-actin灰度值的比值,以此比值作为Musashi-1的蛋白表达水平。
1.2.5噻唑蓝(MTT)检测细胞活力 Control、si-NC、si-Musashi-1各组细胞用细胞培养液悬浮,制成浓度为4×104个/ml的单细胞悬浮液,每个孔中加入100 μl种植到96孔板内,把培养板置于37℃,5% CO2培养箱内,分别在24 h、48 h、72 h、96 h取出培养板,每组设置4个复孔,添加10 μl的MTT溶液(浓度为5 mg/ml)显色以后,加入二甲基亚砜(DMSO)孵育10 min。置于酶联免疫吸附试验检测仪上检测492 nm波长处的吸光度(A值),以空白孔调零 。
1.2.6流式细胞术检测细胞凋亡 Control、si-NC、si-Musashi-1各组细胞用0.25%的胰蛋白酶常规消化后,用磷酸盐缓冲液(PBS)将细胞悬浮,制成浓度为1×106个/ml的细胞悬浮液。吸取1 ml的细胞悬浮液至5 ml的培养管内,加入膜联蛋白(Annexin)V-FITC和碘化丙啶(PI)染液,在避光条件下孵育15 min。添加400 μl的结合缓冲液混合以后,上流式细胞仪检测。
1.2.7划痕愈合实验检测细胞迁移 Control、si-NC、si-Musashi-1各组细胞用0.25%的胰蛋白酶常规消化后,用细胞培养液将细胞悬浮,制成浓度为1×104个/ml的细胞悬浮液,种植到培养瓶中,细胞密度为80%时,在细胞中划出一条划痕,继续置于37℃,5% CO2培养箱培养24 h。分别测定0 h和24 h时划痕的宽度,计算细胞迁移率变化。细胞迁移率=100%×(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度。
1.2.8Transwell小室检测细胞侵袭 基质胶湿化transwell小室2 h。Control、si-NC、si-Musashi-1各组细胞用不含血清的培养液悬浮以后,在上室中添加200 μl的细胞悬浮液(约含有105个细胞),在下室内加入600 μl的含血清的细胞培养液。24 h后取出transwell小室,用棉签将小室内没有穿膜的细胞擦掉,4%多聚甲醛固定后,用结晶紫染色。显微镜下选取至少5个视野观察细胞侵袭数目。
1.2.9Western印迹检测细胞中cleaved caspase-3、MMP-2、MMP-9、E-cadherin、vimentin蛋白水平 取Control、si-NC、si-Musashi-1各组细胞,用Western印迹方法检测细胞中cleaved caspase-3(抗体以1∶100稀释)、MMP-2(抗体以1∶400稀释)、MMP-9(抗体以1∶400稀释)、E-cadherin(抗体以1∶600稀释)、vimentin(抗体以1∶600稀释)蛋白水平,步骤同1.2.4。
1.3统计学分析 采用SPSS21.0软件进行单因素方差分析、SNK-q检验。
2 结 果
2.1Musashi-1 siRNA慢病毒下调胶质瘤U251和U87细胞中Musashi-1的表达 胶质瘤U251和U87细胞感染Musashi-1 siRNA慢病毒后,细胞中的Musashi-1蛋白和mRNA水平均降低,说明成功构建了下调Musashi-1的胶质瘤细胞。见表1、图1、图2。

图1 Western印迹检测U251细胞Musashi-1蛋白表达

图2 Western印迹检测U87细胞Musashi-1蛋白表达

表1 下调Musashi-1后的胶质瘤细胞中Musashi-1 mRNA和蛋白表达水平比较
2.2下调Musashi-1降低胶质瘤U251和U87细胞活力 下调Musashi-1后的胶质瘤细胞A值明显降低,说明下调Musashi-1降低胶质瘤细胞活力。见表2。

表2 敲减Musashi-1表达后胶质瘤U251和U87细胞A值的比较
2.3敲减Musashi-1表达诱导胶质瘤U251和U87细胞凋亡 敲减Musashi-1表达后胶质瘤细胞的凋亡率和细胞中cleaved caspase-3的蛋白水平显著升高(P<0.05),说明下调Musashi-1可在体外诱导胶质瘤细胞凋亡。见表3、图3~5。

表3 下调Musashi-1后胶质瘤细胞凋亡率和cleaved caspase-3水平比较

图3 流式细胞术检测细胞凋亡

图4 Western印迹检测U251细胞cleaved caspase-3蛋白表达

图5 Western印迹检测U87细胞中cleaved caspase-3蛋白表达
2.4下调Musashi-1抑制胶质瘤U251和U87细胞侵袭和迁移 下调Musashi-1后的胶质瘤细胞侵袭数目及迁移率均显著降低,胶质瘤细胞中的MMP-2和MMP-9蛋白表达均显著减少(P<0.05),说明下调Musashi-1抑制胶质瘤细胞侵袭和迁移能力。见表4、图6、图7。

表4 下调Musashi-1后胶质瘤U251和U87细胞迁移率、侵袭数目和MMP-2、MMP-9蛋白水平比较
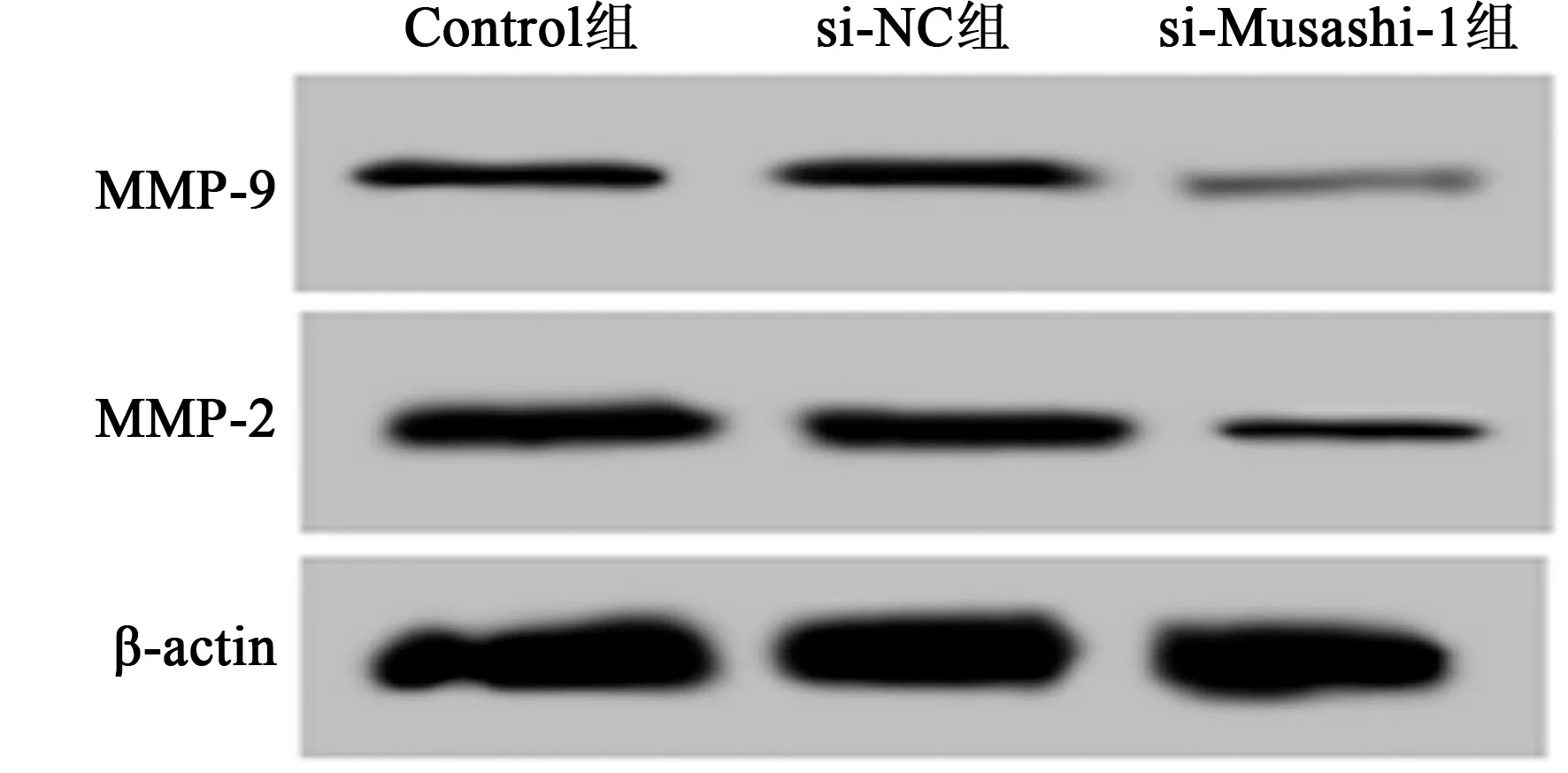
图6 Western印迹检测U251细胞中MMP-2、MMP-9蛋白表达

图7 Western印迹检测U87细胞中MMP-2、MMP-9蛋白
2.5下调Musashi-1抑制胶质瘤细胞上皮-间质转化(EMT) 下调Musashi-1后的胶质瘤细胞中E-cadherin表达水平显著升高,细胞中vimentin表达水平显著下降(P<0.05),说明下调Musashi-1抑制胶质瘤细胞EMT。见图8、图9、表5。

图8 Western印迹检测U251细胞E-cadherin、vimentin蛋白表达

图9 Western印迹检测U87细胞E-cadherin、vimentin蛋白表达

表5 下调Musashi-1后的胶质瘤细胞中E-cadherin、vimentin蛋白表达水平比较
3 讨 论
基因转录后调控与RNA结合蛋白有关,在人类的体内已经发现有800多种的RNA结合蛋白,在这些RNA结合蛋白中有的与转录因子功能相似,参与癌变过程,在肿瘤发生中具有促进或者抑制作用〔6〕。Musashi-1属于RNA结合蛋白,具有维持自我更新和分化等的作用,是多种细胞的干细胞标志物,是结肠癌等多种癌症发生的调节剂〔7〕。人类的Musashi-1基因含有两个RNA结构域,这两个结构域中含有α-螺旋和β折叠,能够与目的RNA结合,参与基因的表达调控过程〔8〕。很多研究显示,Musashi-1在肿瘤中表达上调,例如肝细胞肝癌、结肠癌、胶质瘤等,沉默其表达可以抑制结肠癌、肝癌等癌细胞的生长,其在肿瘤细胞生长中发挥促进作用〔9~11〕。本实验表明,下调Musashi-1后胶质瘤细胞活力降低,说明Musashi-1在胶质瘤中可能发挥癌基因的作用。
肿瘤细胞凋亡减少肿瘤发生的重要原因之一,其受到细胞内Caspase蛋白家族成员的调控,Caspase蛋白家族也是目前为止研究最为透彻的细胞凋亡调控因子,其蛋白成员活化后可以诱导细胞凋亡的发生〔12〕。Caspase蛋白家族包括10个以上的蛋白成员,这些蛋白成员在活化之前没有促凋亡作用,只有受到凋亡信号刺激以后可以诱导细胞凋亡的发生,Caspase-3是凋亡发生的下游执行子,其活化水平升高后是不可逆细胞凋亡发生的标志〔13〕。本实验的结果表明,下调Musashi-1后胶质瘤细胞凋亡水平升高,细胞中Caspase-3活化水平升高,提示下调Musashi-1具有激活Caspase级联反应诱导细胞凋亡发生的作用。
EMT是肿瘤细胞迁移和侵袭的早期标志,EMT发生促进肿瘤细胞与相邻细胞分开,其上皮标志物E-cadherin等表达水平下调,间质标志物vimentin等表达水平升高〔14〕。MMP-2和MMP-9均属于MMPs成员,二者在肿瘤转移中发挥促进作用〔15〕。在肝癌中的研究显示,过表达Musashi-1后的肿瘤细胞侵袭能力增加,下调Musashi-1可以下调癌细胞的迁移能力〔16〕。本实验显示,下调Musashi-1后的胶质瘤细胞24 h的迁移、侵袭能力降低,细胞中MMP-2和MMP-9蛋白水平下降,同时细胞间质标志物vimentin表达水平降低,上皮标志物E-cadherin表达水平升高,提示下调Musashi-1可能降低胶质瘤细胞EMT和侵袭迁移能力。
Musashi-1在胶质瘤中可能发挥促进作用,下调其表达后的胶质瘤细胞U251和U87活力、侵袭、迁移能力降低,细胞凋亡增多,而对于其具体的作用机制尚未研究。本实验结果明确了Musashi-1在胶质瘤细胞凋亡、侵袭等生物学特性发挥中的作用,这对于研究Musashi-1在胶质瘤发生中的作用机制具有重要意义,为靶向基因治疗胶质瘤提供了新思路。

