miR-142-5p通过直接靶向ELK1调控动脉粥样硬化内皮细胞凋亡
羌玲玉 汤小星 孙晓晖
(1南通大学医学院人体解剖学教研室,江苏 南通 226019;2南通市中医院介入科;3南通市老年康复医院心内科)
研究显示内皮细胞损伤、氧化应激及炎症反应等均与动脉粥样硬化发病机制有关〔1,2〕。因而探寻动脉粥样硬化内皮细胞损伤机制可为动脉粥样硬化防治提供新方向。微小RNA(miRNA)作为内源性非编码RNA分子,其可通过调控基因或信号通路进而参与心脑血管疾病发生及发展过程〔3〕。微小RNA-142-5p(miR-142-5p)在动脉粥样硬化斑块中呈高表达并可促进氧化型密度脂蛋白(ox-LDL)诱导的巨噬细胞凋亡,但关于miR-142-5p在动脉粥样硬化斑块形成过程中的具体作用机制尚未完全阐明〔4〕。通过靶基因预测网站发现包含转录激活因子ETS样蛋白(ELK)1可能是miR-142-5p的靶基因,研究显示miR-150可靶向ELK1而调节ox-LDL诱导的内皮细胞凋亡〔5〕。相关研究表明ELK1可保护皮质神经元免受缺氧葡萄糖损伤,还可通过调控Wnt/β-catenin信号通路进而影响细胞增殖及迁移过程〔6,7〕。ox-LDL诱导主动脉内皮细胞HAECs中miR-142-5p表达及其是否通过靶向ELK1影响内皮细胞凋亡还有待验证。本研究通过探讨miR-142-5p在ox-LDL诱导的主动脉内皮细胞损伤中的调控作用及其可能作用机制。
1 材料与方法
1.1细胞与主要试剂 人主动脉内皮细胞(HAEC)购自美国ATCC细胞库。ox-LDL购自北京索莱宝科技有限公司。RPMI1640培养基购自上海博升生物科技有限公司;胎牛血清(FBS)、胰酶均购自美国Gibco公司;细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司;荧光素酶检测试剂盒购自美国Gene Copoeia公司;LipofectamineTM2000、TRIzol均购自美国Invitrogen公司;miR-142-5p mimic及阴性转染质粒、miR-142-5p抑制剂(anti-miR-142-5p)、anti-miR-NC均购自上海吉玛制药技术有限公司;ELK1 siRNA(si-ELK1)与阴性对照siRNA(si-NC)均购自德国Qiagen公司;实时荧光定量PCR与反转录试剂盒均购自北京宝日医生物技术有限公司;活化的含半胱氨酸的天冬氨酸蛋白水解酶(Cleaved Caspase)-3、B淋巴细胞瘤-2相关蛋白(Bax)、B淋巴细胞瘤(Bcl)-2、磷酸化糖原合成酶激酶(pGSK-3β)、总GSK-3β与β-catenin抗体均购自美国CST公司;c-myc抗体购自美国Origene公司;辣根过氧化物酶(HRP)标记的IgG二抗(IgG-HRP)购自美国Santa Cruz公司。
1.2方法
1.2.1细胞培养及转染 -80℃超低温冰箱保存的HAECs经恒温水浴锅溶解后,放入含有10%FBS的RPMI1640培养液中培养,离心后(800 r/min)接种于细胞培养瓶,置于恒温培养箱内培养(37℃、体积分数5%CO2),0.25%胰酶消化后进行传代培养。转染前1 d收集生长良好的HAECs接种于96孔板,待细胞融合至80%左右时进行转染,应用Lipofectamine2000转染试剂分别将anti-miR-142-5p、anti-miR-con、pcDNA、pcDNA-ELK1转染到HAECs中,转染后6 h更换新鲜培养基,继续培养48 h收集细胞。
1.2.2ox-LDL处理及分组 用100 μg/ml的ox-LDL刺激HAECs,分别于0、12、24、48 h 时收集细胞〔8〕。收集“1.2.1”中转染12 h后的HAECs,用100 μg/ml的ox-LDL分别处理HAECs 24 h,实验将ox-LDL刺激HAECs分为anti-miR-con+ox-LDL组、anti-miR-142-5p+ox-LDL组、pcDNA+ox-LDL组、pcDNA-ELK1+ox-LDL组。为进一步验证miR-142-5p与ELK1对ox-LDL刺激HAECs凋亡的影响,在HAECs中共转染si-ELK1与anti-miR-142-5p,作用12 h后经ox-LDL作用24 h,分别为anti-miR-142-5p+si-con+ox-LDL组、anti-miR-142-5p+si-ELK1+ox-LDL组。
1.2.3实时荧光定量聚合酶链反应(qRT-PCR)检测miR-142-5p、ELK1 mRNA表达水平 TRIzol法提取各组HAECs总RNA,应用紫外分光光度计检测RNA浓度,取1 μg RNA进行反转录得到cDNA,miR-142-5p、ELK1引物均由美国Invitrogen公司合成,miR-142-5p以U6为内参基因,ELK1以β-actin为内参基因,PCR条件为95℃ 5 min,95℃ 40 s,60℃ 40 s,72℃ 1 min(循环40次),72℃终延伸10 min,根据qRT-PCR仪自带软件分析各孔阈值Ct值,采用2-ΔΔCt法分析miR-142-5p、ELK1 mRNA相对表达量。实验设置3次重复。
1.2.4Western印迹法检测ELK1及Wnt信号通路相关蛋白表达水平 收集处理后的HAECs,分别加入放射免疫沉淀(RIPA)裂解液以此提取总蛋白,二喹啉甲酸(BCA)测定蛋白浓度,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,反应结束后将分离的蛋白凝胶转移至聚偏氟乙烯(PVDF)膜,脱脂牛奶封闭2 h,分别加入ELK1、Cleaved Caspase-3、Bax、Bcl-2 及Wnt信号通路相关蛋白一抗(1∶1 000),孵育过夜后分别加入二抗(1∶5 000),增强型化学发光试剂(ECL)进行显影,蛋白均以β-actin为内参,置于凝胶成像分析系统分析蛋白相对表达量。
1.2.5流式细胞术检测细胞凋亡 收集各组HAECs,放入离心机(转速1 000 r/min)离心10 min,弃上清,分别加入200 μl结合缓冲液,混匀后分别加入5 μl(Annexin V-FITC)和碘化丙啶(PI),室温避光孵育20 min,置于流式细胞仪检测细胞凋亡。
1.2.6双荧光素酶报告实验 根据生物学信息网站预测miR-142-5p的靶基因,发现miR-142-5p的靶基因可能是ELK1,分别构建野生型ELK1荧光素酶报告基因载体(WT-ELK1)与突变型ELK1荧光素酶报告基因载体(MUT-ELK1),将两种载体分别与miR-142-5p mimic、miR-con混合后共同转染到HAECs中,继续培养48 h后收集细胞,磷酸盐缓冲液(PBS)洗涤细胞后检测细胞荧光素酶活性。
1.3统计学处理 采用SPSS21.0软件进行t检验,方差分析,χ2检验。
2 结 果
2.1ox-LDL处理时间对HAECs凋亡、miR-142-5p和ELK1表达的影响 与0 h组比较,随着ox-LDL处理时间的延长HAECs凋亡率明显升高(P<0.05)。HAECs细胞经ox-LDL刺激后miR-142-5p的表达水平与0 h相比明显升高,而ELK1 mRNA及蛋白表达均明显降低(均P<0.05)。Western印迹实验结果显示HAECs经ox-LDL刺激后 Cleaved Caspase-3、Bax蛋白表达均明显升高(P<0.05),Bcl-2蛋白表达明显降低(P<0.05),见表1、图1、图2。
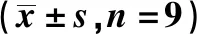
表1 ox-LDL不同时间处理HAECs凋亡及相关蛋白表达比较
图1 流式检测HAECs凋亡率
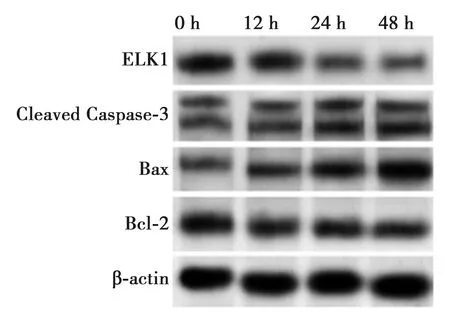
图2 Western印迹检测ELK1蛋白表达
2.2anti-miR-142-5p抑制ox-LDL处理HAECs凋亡 用miR-142-5p抑制剂(anti-miR-142-5p)转染HAECs细胞,经ox-LDL处理后采用流式细胞术检测HAECs凋亡情况,结果显示anti-miR-142-5p+ox-LDL组HAECs细胞凋亡率显著低于anti-miR-con+ox-LDL组(P<0.05),Western印迹检测结果显示,与anti-miR-con+ox-LDL组相比,anti-miR-142-5p+ox-LDL组HAECs细胞中Cleaved Caspase-3、Bax蛋白表达明显降低(P<0.05),而Bcl-2蛋白表达明显升高(P<0.05),见表2、图3。
表2 anti-miR-142-5p抑制ox-LDL处理HAECs凋亡和抑制凋亡蛋白的表达
2.3miR-142-5p靶向ELK1 双荧光素酶报告基因实验验证miR-142-5p与ELK1的靶向关系,结果显示miR-142-5p mimic与WT-ELK1共转染后HAECs细胞相对荧光素酶活性相较于miR-con与WT-ELK1共转染后HAECs细胞相对荧光素酶活性明显降低(P<0.05),而miR-con、miR-142-5p mimic与MUT-ELK1共转染后HAECs细胞相对荧光素酶活性无明显变化(P>0.05),见图4A、表3。为了验证miR-142-5p与ELK1之间的调控关系,采用Western印迹法分别检测抑制miR-142-5p表达及miR-142-5p过表达后ELK1蛋白表达变化,结果发现抑制miR-142-5p表达HAECs细胞中ELK1蛋白表达明显升高(anti-miR-142-5p组:0.72±0.05、anti-miR-con组:0.58±0.09,P<0.05),miR-142-5p过表达HAECs细胞中ELK1蛋白表达明显降低(miR-142-5p组:0.32±0.04、miR-con组:0.61±0.06,P<0.05),见图4B。
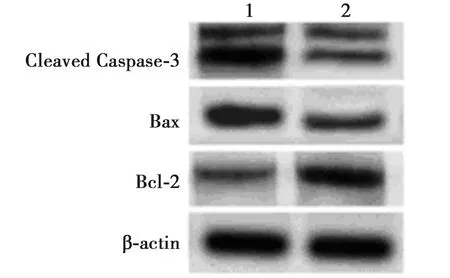
1~2:anti-miR-con+ox-LDL组,anti-miR-142-5p+tox-LDL组图3 Western印迹检测HAECs中凋亡相关蛋白表达
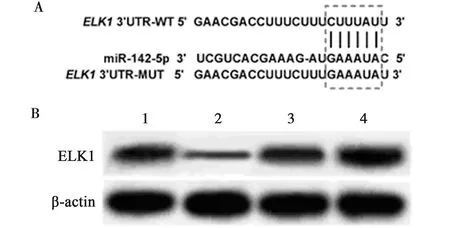
A:miR-142-5p靶向ELK1 3′UTR的序列信息;B:miR-142-5p靶向调控ELK1蛋白表达;1~4:miR-con组,miR-142-5p组,anti-miR-con组,anti-miR-142-5p组图4 miR-142-5p靶向调控ELK1蛋白表达
表3 双荧光素酶报告实验
2.4过表达ELK1抑制ox-LDL处理HAECs凋亡 pcDNA-ELK1+ox-LDL组HAECs细胞中ELK1蛋白表达明显高于pcDNA+ox-LDL组(P<0.05)。pcDNA-ELK1+ox-LDL组HAECs细胞凋亡率明显低于pcDNA+ox-LDL组(P<0.05);与pcDNA+ox-LDL组相比,pcDNA-ELK1+ox-LDL组HAECs细胞中Cleaved Caspase-3、Bax蛋白表达明显下调(P<0.05),而Bcl-2蛋白表达明显上调(P<0.05),见图5、表5。
表5 过表达ELK1抑制ox-LDL处理HAECs凋亡
2.5沉默ELK1逆转anti-miR-142-5p对ox-LDL处理HAECs抑制凋亡作用 双抑制ELK1与miR-142-5p表达后HAECs细胞中ELK1蛋白表达明显降低(P<0.05)。与anti-miR-142-5p+si-con+ox-LDL组相比,anti-miR-142-5p+si-ELK1+ox-LDL组HAECs细胞凋亡率显著升高,Bcl-2蛋白表达水平均显著降低,而Cleaved Caspase-3、Bax蛋白表达水平均显著升高(均P<0.05),见表6、图6。
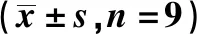
表6 沉默ELK1逆转anti-miR-142-5p对ox-LDL处理HAECs抑制凋亡作用
2.6ELK1和miR-142-5p表达对ox-LDL处理HAECs中Wnt信号通路的影响 与anti-miR-con+ox-LDL组相比,anti-miR-142-5p+ox-LDL组HAECs细胞中p-GSK-3β、β-catenin、c-myc蛋白表达水平均明显降低(P<0.05)。进一步分析显示anti-miR-142-5p与si-ELK1共同转染后HAECs中p-GSK-3β、β-catenin、c-myc蛋白表达水平均明显升高(P<0.05),见图7、表7。
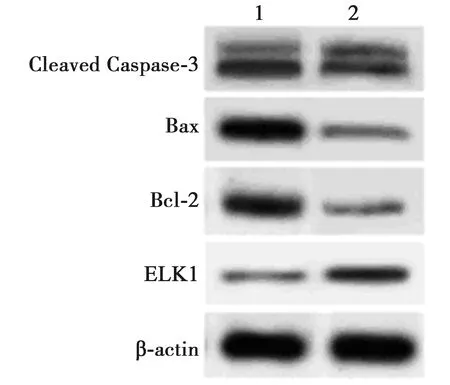
1~2:pcDNA+ox-LDL组,pcDNA-ELK1+ox-LDL组图5 Western印迹检测HAECs中ELK1蛋白和凋亡相关蛋白表达
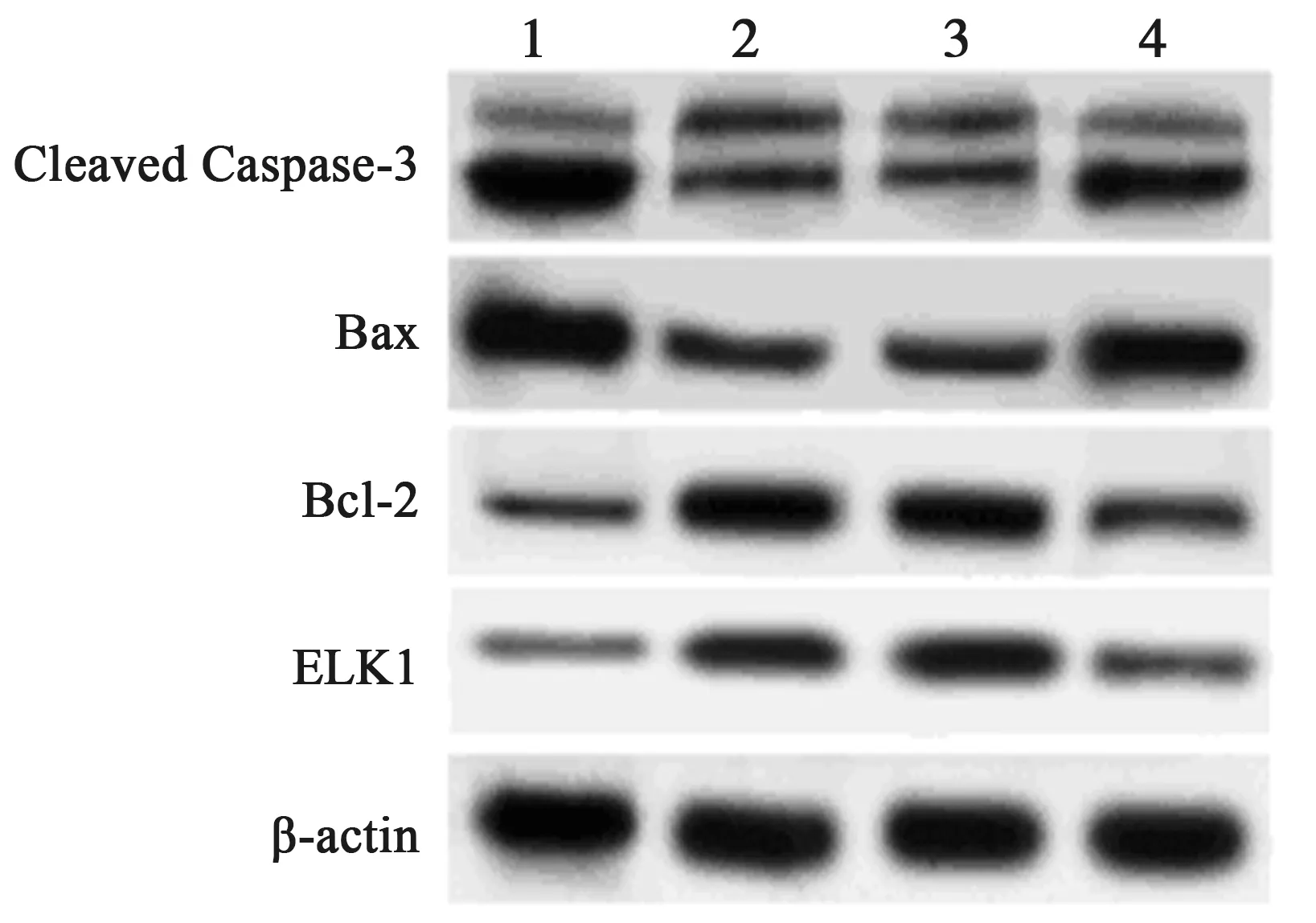
1~4:anti-miR-con+ox-LDL组、anti-miR-142-5p+ox-LDL组、anti-miR-142-5p+si-con+ox-LDL组、anti-miR-142-5p+si-ELK1+ox-LDL组;图7同图6 Western印迹检测HAECs中ELK1蛋白和凋亡相关蛋白表达
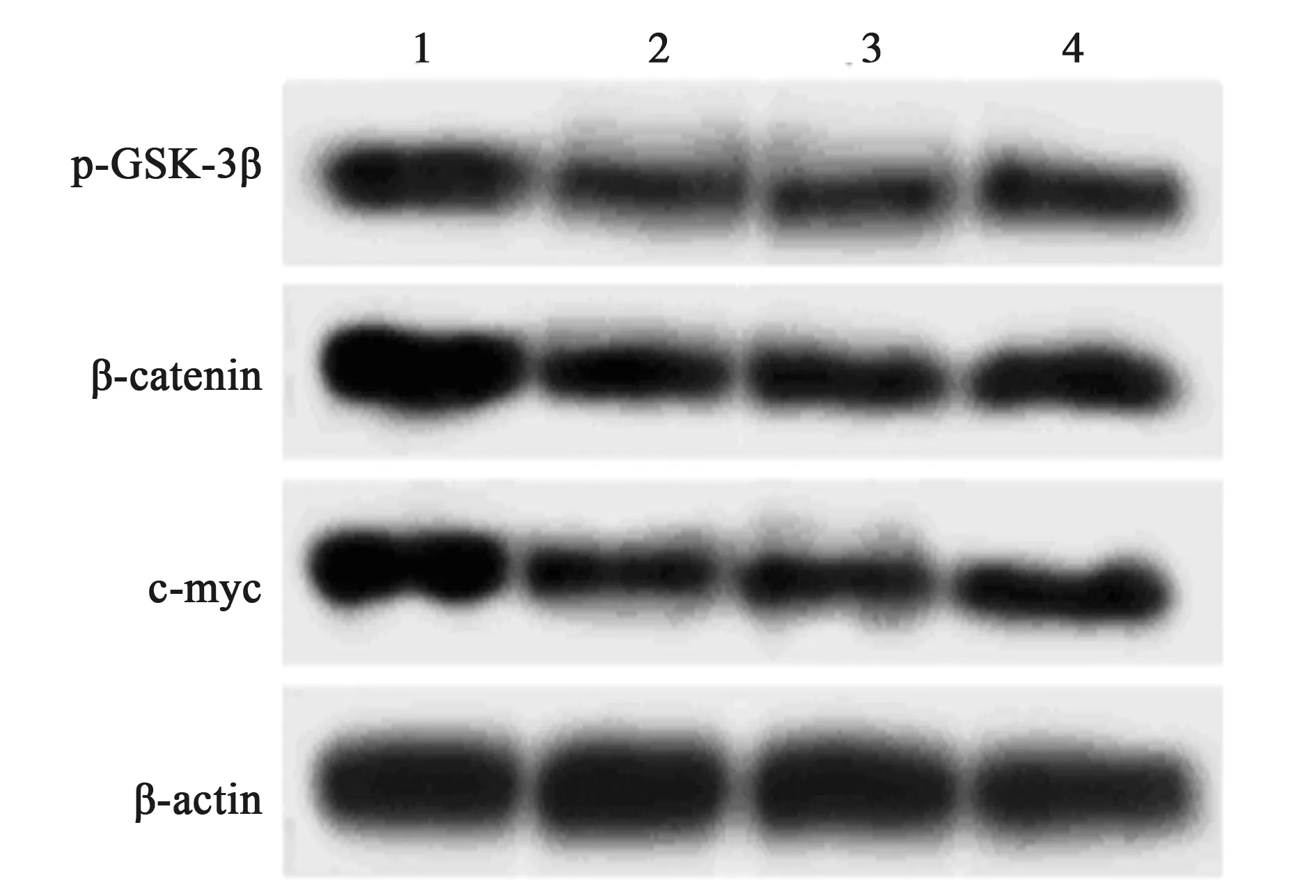
图7 Western印迹检测HAECs中Wnt信号通路相关蛋白表达
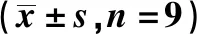
表7 ELK1和miR-142-5p表达对ox-LDL处理HAECs中Wnt信号通路的影响
3 讨 论
动脉粥样硬化发病机制尚未完全阐明,研究显示内皮细胞损伤是动脉粥样硬化形成的主要因素〔9〕。ox-LDL是引发血管内皮细胞损伤的重要作用因子,其可促使单核细胞转化形成巨噬细胞进而形成脂质斑块〔10〕。研究表明miRNA可通过调控靶基因表达进而参与细胞增殖及凋亡等病理过程〔11〕。
miR-142-5p表达异常与肿瘤发生及发展密切相关,研究显示冠心病患者血清中miR-142-5p表达水平升高并可能参与动脉硬化及斑块形成过程〔12,13〕。徐测梁等〔14〕研究表明急性冠脉综合征患者血清中miR-142-5p表达水平升高且与患者心肌炎症反应及心肌损伤密切相关。李玉东等〔15〕通过构建动脉粥样硬化大鼠模型发现动脉粥样硬化组织中miR-142-5p呈高表达并可通过抑制靶基因表达进而促进巨噬细胞凋亡。然而,miR-142-5p对动脉粥样硬化内皮细胞凋亡的影响及其可能作用机制仍未可知,本研究结果显示随着ox-LDL处理时间的延长HAECs凋亡率明显升高,miR-142-5p表达上调,而ELK1表达下调,Cleaved Caspase-3、Bax蛋白表达明显升高,而Bcl-2蛋白表达明显降低,研究显示Bcl-2作为抗细胞凋亡蛋白可参与氧化应激所致的血管内皮细胞凋亡等过程,Bax可拮抗Bcl-2抗凋亡作用,若Bax同源二聚体增多可促使细胞凋亡,Bcl-2/Bax失衡可促使线粒体释放Caspase进而引发Caspase级联反应,最终激活Caspase-3导致细胞凋亡,通过检测Caspase-3表达可反应细胞凋亡程度〔16〕。说明ox-LDL可能通过促使内皮细胞凋亡进而引发动脉粥样硬化。本研究结果说明抑制miR-142-5p可通过促进Bcl-2表达,抑制Caspase-3、Bax表达进而抑制内皮细胞凋亡。提示抑制miR-142-5p表达可避免内皮细胞损伤。
ELK1表达下调可通过介导MAPK途径进-而促进骨髓瘤细胞增殖,Ohguchi等〔17〕、Zeng等〔18〕研究表明慢性心房颤动患者心肌组织中ELK1表达下调。Yan等〔19〕研究表明ELK1表达异常与小鼠动脉粥样硬化形成有关。本研究结果提示上调ELK1表达可抑制ox-LDL诱导的HAECs凋亡,抑制ELK1可逆转anti-miR-142-5p对ox-LDL处理HAECs抑制凋亡作用,miR-142-5p可靶向调节ELK1表达进而参与动脉粥样硬化内皮细胞凋亡过程。但miR-142-5p又是通过调控哪些相关信号通路而发挥作用,研究显示Wnt/β-catenin信号通路激活后可通过促使内皮细胞、巨噬细胞等功能发生障碍进而促进动脉粥样硬化发生及发展〔20〕。细胞处于异常状态时GSK-3β发生磷酸化形成p-GSK-3β,而p-GSK-3β不能促使β-catenin发生磷酸化而降解,β-catenin大量聚集可从细胞质转移至细胞核中进而激活c-myc,促使细胞凋亡〔21〕。本研究结果说明抑制miR-142-5p表达可抑制Wnt/β-catenin信号通路活化。miR-142-5p可通过下调ELK1表达而激活Wnt/β-catenin信号通路进而促使内皮细胞凋亡。
综上所述,miR-142-5p在ox-LDL诱导的HAECs中呈高表达,而ELK1表达降低,miR-142-5p可能通过激活Wnt/β-catenin信号通路进而促进HAECs凋亡,为进一步研究动脉粥样硬化发病机制奠定基础。

