类风湿关节炎动物模型研究进展
夏 晴,纪羽婷,刘海亮,宋武琦
(哈尔滨医科大学微生物学教研室,伍连德研究所,黑龙江省免疫与感染重点实验室, 黑龙江省普通高校病原生物学重点实验室,哈尔滨 150081)
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性炎症性关节疾病,表现为持续性滑膜炎、全身性炎症,伴有骨骼和软骨侵蚀,最终可导致关节强直和畸形[1]。我国RA患病率约为0.32%~0.36%,在自然病程中,10年致残率可超过60%[2]。类风湿关节炎动物模型被广泛用于发病机制和治疗方法的研究。目前已经建立多种动物模型用于研究RA的病因、发病机制、影响因素以及新的治疗靶点的研究和新疗法的评估,包括佐剂诱导关节炎模型(adjuvent induced arthritis,AA)、II型胶原诱导的关节炎模型(collagen induced arhritis,CIA)、链球菌细胞壁诱导的关节炎模型、软骨寡聚基质蛋白(cartilage oligomeric matrix proteins,COMP)诱导关节炎、降植烷诱导关节炎(pristane induced arthritis,PIA)以及转基因动物的关节炎模型。这些模型各有优缺点,但CIA一直是RA研究最广泛的模型。将上述中因诱导产生的模型称为诱导型关节炎模型,另一类为基因工程型动物模型,按照这两大类来进行介绍。
1 诱导型关节炎模型
佐剂诱导的关节炎动物模型最初由细菌学家Freund于五十年代创立,又称弗氏佐剂性关节炎。使用弗氏佐剂单次皮下注射可诱导Wistar大鼠发生关节炎,并且多次注射发病率高于单次注射[3]。发病快,在很短的时间内就可观察到病变,可观察到脚踝、爪子、尾巴的肿胀,累及单个或多个关节;组织学可观察到血管翳的形成、中性粒细胞和单核细胞浸润,有软骨和软骨下骨侵蚀,随后伴有关节强直,病变多持续14~45 d,观察不到慢性活动期。随后,Trentham等[4]在1977年提出,通过背部皮下注射II型胶原与完全或不完全弗氏佐剂混合物,可诱导10~24周龄大的远系杂交Wistar 雌鼠、SD大鼠、近交系Wistar-Lewis大鼠发生关节炎。病变主要累及远端踝关节、跗关节和趾间关节;严重程度峰值出现在发病后4 d内,肿胀维持5~8周,最终导致关节变形。无论是异源或同源型II型胶原作为免疫原,还是采用完全弗氏佐剂(complete freund’s adjuvant,CFA)或不完全弗氏佐剂(incomplete freund’s adjuvant,ICFA)作为免疫原,胶原诱导的关节炎的临床特征是相似的,大鼠对同源或异源的II型胶原具有同样的易感性[4]。1980年Courtenay等[5]提出使用II型胶原诱导小鼠关节炎模型。通过背部皮下注射牛II型胶原在近交系8~15周龄DBA/1小鼠中诱导关节炎,多在免疫后23 d后发病,早期观察到滑膜及其周围组织水肿,接着伴随滑膜增生,单核细胞浸润;病变后期,细胞浸润和水肿减轻,有关节强直,可见滑膜和关节软骨破坏,椎体很少受累,少数动物的耳朵或尾巴偶见小的炎性病灶[5]。在刺激前后给予小鼠脂多糖(lipopolysaccharide,LPS),可诱导疾病发生得更快,起病变异性更小[6]。II型胶原诱导的大小鼠关节炎的主要病变相似,且均与人类RA有许多相似之处。但二者免疫不同,DBA/1小鼠初次免疫必须使用完全弗氏佐剂而不是不完全弗氏佐剂,CIA诱导小鼠关节炎起病慢,病程长[7]。近年来,CIA模型在基于生物学的新疗法的测试和开发中发挥了重要作用,如针对TNF-α的治疗[8]。
胶原诱导关节炎动物模型的易感性与主要组织相容复合物(major histocompatibility complex,MHC)的特定II类分子如H-2r 和 H-2q有关,同样,人RA的易感性也与MHC II类分子H-2r 和 H-2q相关。在这两种疾病中,都有针对CII和类风湿的自身抗体产生的因素,有证据表明,RA患者的抗体针对的是与CIA相同的CII分子区域[9-10]。
大鼠对佐剂诱导关节炎异常敏感,除了使用弗氏佐剂以外,非免疫原性佐剂如降植烷、角鲨烯均可以在大鼠品系中诱发严重的关节炎,且符合RA的标准[11]。大鼠单次皮下注射降植烷可以诱导PIA,小鼠需要注射两次降植烷,时间间隔为50 d,然后是慢性复发期,该炎症为T细胞依赖型,表现为关节炎症的一个延长、延迟的临床时间过程;组织学变现为滑膜增生、软骨和骨糜烂、炎性细胞浸润、血管翳形成;可以检测到类风湿因子,热休克蛋白和I、II型胶原抗体也被检测到。非免疫原性佐剂关节炎表明,非特异性的免疫系统刺激可以引发关节炎。DA系大鼠对PIA最敏感,发病率可达100%,E3系最不敏感,发病率为0[12]。降植烷诱导的关节炎模型对TNF-α抑制剂疗法不敏感,因此该模型可用于研究除TNF-α抑制剂疗法以外的新方法,对于研究对TNF-α抑制剂疗法无效的患者的相关治疗方法是有重要意义的[13]。
COMP是一种软骨特异性分子,可在几种大鼠以及小鼠品系中诱发急性和自限性关节炎[14-15],天然和变性COMP均可在大鼠中诱发严重关节炎,病变变现为滑膜中度增生、肥大,伴血管翳形成。虽然骨和软骨的破坏是明显存在的,但它们仅限于边缘区,而整个关节结构只是偶尔被重塑。多数情况下,关节炎是逐渐愈合的,免疫后43 d没有炎症或畸形的迹象。疾病具有自限性,很容易在对CIA以及佐剂模型具有抗性的E3品系中诱导,这种差异不仅与RT1u单倍型有关,也与非MHC基因有关,表明,COMP依赖于独特的疾病途径。与天然COMP免疫诱导的关节炎类似,变性COMP免疫诱导的关节炎,但它往往更持久,特别是在E3品系。
研究发现[16],II型胶原诱导大鼠关节炎,其血清经50%硫酸铵分级浓缩后,转移至正常受体内,在18~72 h后可诱发关节炎,并且可以表现出早期炎症病变的所有病理组织学特征,如巨噬细胞和中性粒细胞浸润,但是炎症短暂、不严重。转移的血清中含有活性的IgG抗胶原蛋白抗体。该种方法所致关节炎为快速发病,疾病高峰期在8 d以内,而且具有高度的同步性,而CIA,在疾病的发生率、同步性和分布方面存在很大的个体差异。该方法还适用于免疫一些不适合进行CIA免疫的小鼠品系。
在诱导型关节炎模型的多种方法中(见图1),AA操作方法简单,但是缺乏慢性病过程,病变具有一定的自限性,在病理生理学特点上存在较大差距;CIA诱导的关节炎发病时间与临床表现不一,虽然与人类RA有很多相似之处,但是无病情波动和复发情况,没有类风湿因子及抗核抗体,但它已经是目前公认的研究RA最佳模型,特别是在治疗机制及免疫反应有关的研究中;降植烷诱导的关节炎模型耗时久,该模型主要依赖T细胞激活,主要用来药物验证;COMP诱导的关节炎发病较AA要快,起病急,病程短,虽然其外周关节病变在临床上与RA相似,但不产生永久的关节破坏[17]。
重点介绍AA、CIA、PIA以及COMP诱导的关节炎其发病机制和主要病变可见表1[18-29]。
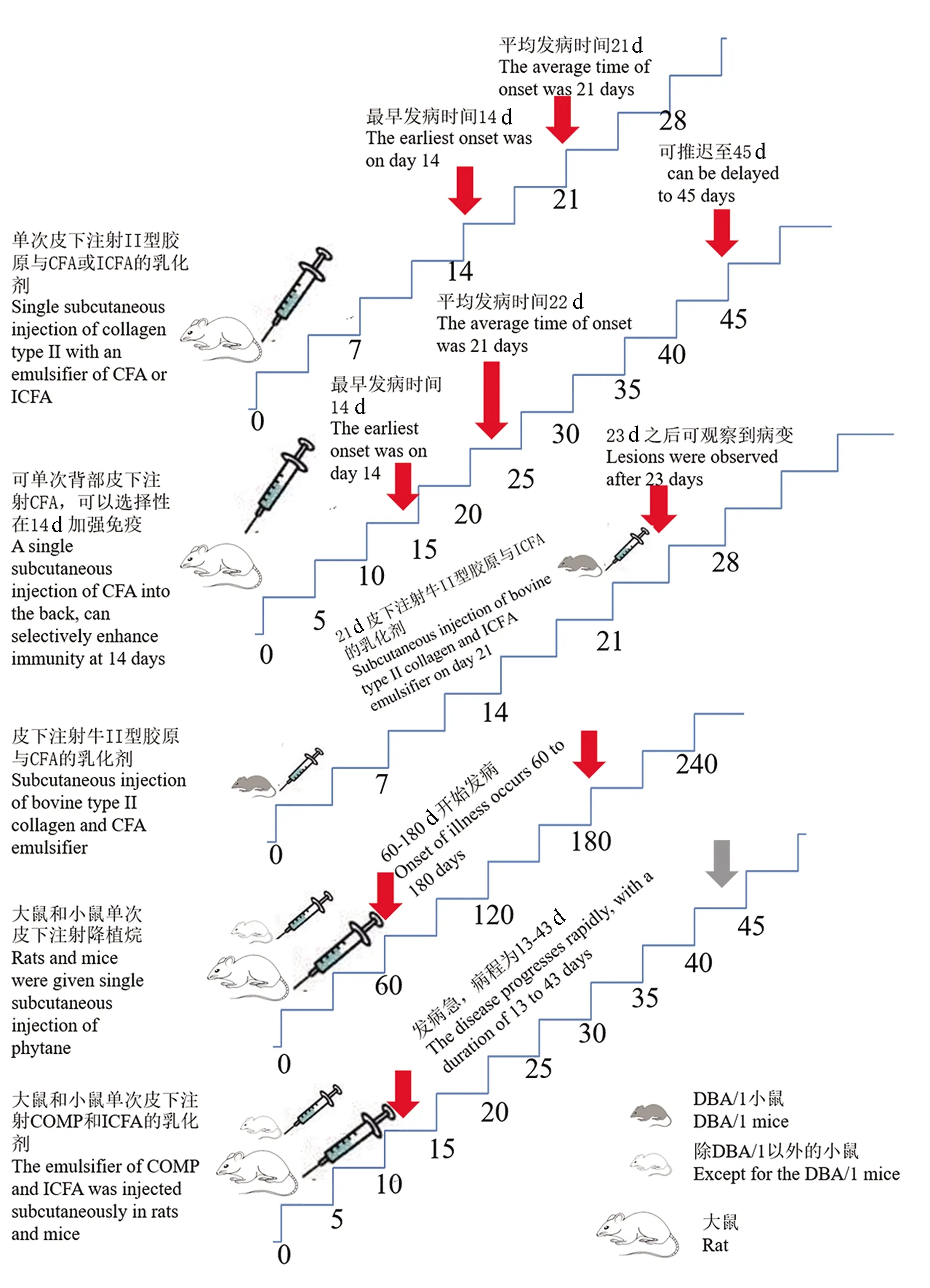
图1 关节炎诱导流程图Figure 1 Arthritis induction flow chart
2 基因工程型关节炎模型
小鼠在经过一定的基因修饰后可以自发形成关节炎,与依赖多基因性状相比,靶向基因工程使自发性疾病模型的定义更狭窄,更简单,也可进一步了解细胞因子在RA发展中的作用,下面介绍几种基因修饰后的自发关节炎动物模型,如表 2所示。
通过RA患者分离的滑膜细胞进行体外研究,发现单核细胞/巨噬细胞产物肿瘤坏死因子(TNF-α)通过诱导促炎细胞因子级联,在关节炎症中起中心作用[30-32]。1991年构建人类TNF转基因小鼠[33],表现出人类TNF基因表达的失调模式,可发展为慢性炎性多关节炎,并且观察到与人类RA相一致的组织学特征,滑膜增生,炎性细胞浸润在不同的发育阶段都很明显;血管翳形成,关节软骨破坏和大量纤维组织产生,与人类RA相一致的组织学特征,在疾病晚期被观察到。该研究也证明了在转基因小鼠中可以建立正确的、内毒素应答的和巨噬细胞特异性的人类TNF基因表达,并证明了人类TNF基因的3′-区域可能参与了巨噬细胞特异性的转录。随后研究发现[34],在C57B1/6 CBA小鼠的背景下,与BDA/1反向杂交产生一种TNF过表达的小鼠,其关节炎发病比前者要严重,可导致关节炎的发病加速,且持续几代,就是说第一代发病在8~9周,意味着第11代可能是在第三周或者出生后11 d就发病。这些小鼠关节中淋巴细胞和巨噬细胞浸润可表明,细胞因子的产生和随后的关节损伤至少部分是通过成纤维细胞的TNF-α的异常表达产生的。通过体内注射人类TNF抗体可以预防小鼠中关节炎的发生并治疗已发生的关节炎,这些结果为TNF在炎症性关节炎发病机制中的作用提供了直接证据。抑制TNF可能被证明在设计这类疾病的治疗方案中是有用的。
白介素-1(interleukin 1,IL-1)作为一种促炎因子,也参与人类RA的疾病进展,IL-1似乎特别重要,因为将IL-1注入正常兔关节会引起严重的关节炎[35],并且将抗IL-1抗体或IL-1受体拮抗剂(ra)注入受影响的关节会改善疾病[36-38]。IL-1受体拮抗剂(ra)是其内源性抑制剂,为了阐明IL-1ra的作用,通过基因靶向构建IL-1ra缺陷型小鼠,IL-1ra缺陷小鼠是通过将分泌型的整个外显子与neo基因进行同源重组而产生的[39]。在这些突变小鼠中,IL-1ra的四种亚型均被破坏。这些小鼠与BALB/cA或C57BL/6J品系小鼠回交5~8代,与BALB/cA小鼠回交5代后,IL-1ra-/-小鼠自发发展为慢性炎症性关节炎,后肢的踝关节处的肿胀和发红最为明显,前肢的关节也发展为关节炎,发生率和严重性较低;组织学分析显示滑膜和关节周围炎症;可看到包括淋巴细胞和嗜中性粒细胞在内的炎性细胞的入侵形成了血管翳,骨侵蚀也很明显[40]。研究表明IL-1ra基因的缺乏会引起自身免疫性疾病和关节炎,强调IL-1/IL-1ra平衡在维持关节正常生理和免疫系统稳态方面的重要性。除此之外,发现C57BL/6J背景下的IL-1ra-/-小鼠在II型胶原免疫时发生关节炎的几率很高,这表明IL-1ra-/-小鼠的免疫系统具有高反应性,我们还观察到该疾病在DBA/1背景下的早期发病和更严重的表型[40]。

表1 诱导型类风湿关节炎动物Table 1 Induced rheumatoid arthritis animals
研究发现[41],编码T细胞中一个关键的信号转导分子,ZAP-70 SH2结构域的基因发生了自发的点突变,导致BALB/c小鼠的慢性自身免疫性关节炎,称为SKG关节炎模型。小鼠在2个月大时开始发病,X线检查显示,在8~12个月大时,软骨下骨破坏和融合、关节脱位和骨质疏松症。
除此之外还包括K/BxN模型[42]、Human/SCID嵌合体小鼠模型[42]和Human DR4-CD4小鼠模型[43]等。K/BxN模型小鼠关节炎属于慢性进行性疾病,首先表现为关节肿胀,并发展到多个关节畸形严重损害活动能力的程度,关节受累明显对称,并显示出明显的远端突出;组织学分析揭示了大量白细胞浸润,滑膜炎,血管翳形成,软骨破坏,骨质侵蚀继而重塑和纤维化[42]。基因工程型关节炎模型更有助于研究某一特定因子或者基因在关节炎疾病中的作用,模型具有遗传性,可以在后代中持续表达。

表 2 基因工程型类风湿关节炎模型Table 2 Genetically engineered rheumatoid arthritis model
3 结语
近年来,人们对于关节炎动物模型的研究逐渐增多,模型构建方法也从诱导型发展至基因工程修饰的小鼠动物品系。对动物模型的不断深入研究,对于RA的发病机制、影响因素以及治疗方法等多方面都发挥了至关重要的作用。多种类的动物模型,也使得研究更加精准,尤其新的基因工程模型,为一些靶点药物研究提供了新思路。虽然目前对RA动物模型的研究较为广泛,但模型都是在特定的条件下诱导产生,不能完全反应RA疾病过程中的所有影响因素,而且动物模型侧重于啮齿类动物,与人类还存在较大的种属差异。所以研究出一种种属与人类更贴近,操作更为便捷、经济,更加全面反应人类RA疾病进展的动物模型是今后研究RA动物模型的重要内容之一。

