不同浓度菟丝子乙醇提取物对宫颈癌Hela细胞增殖和凋亡的影响
姚红丽 姚英武 崔开宇 仝进毅 孙丽萍
菟丝子为抗肿瘤复方药的主要成分,既往研究已经证实在菟丝子乙醇提取物的单体成分中可以通过直接或间接的方式起到免疫调节、抗氧化等作用[1-2]。目前有关中药单体对宫颈癌Hela细胞抑制的研究较多[3-4],但是有关菟丝子乙醇提取物的研究相对较少。本研究旨在评估不同浓度的菟丝子乙醇提取物对宫颈癌Hela细胞生物学行为的影响,现报道如下。
1 材料和方法
1.1 实验细胞及药物 人宫颈癌Hela细胞株购自中国科学院细胞库,菟丝子乙醇提取物由浙江中医药大学中药炮制实验室制备并提供,生药浓度为0.3 g/ml。
1.2 实验试剂及仪器 DMEM细胞培养基与FBS购自上海浩然生物技术有限公司,MTT试剂盒和细胞周期检测试剂盒购自上海优予生物科技有限公司,BCA蛋白定量检测试剂盒与ECL化学发光液购自上海恒斐生物科技有限公司,Transwell培养小室购自上海锐赛生物技术有限公司。兔抗人Caspase-3单克隆抗体、兔抗人Bcl-2单克隆抗体、兔抗人GAPDH多克隆抗体、HRP标记的羊抗兔二抗购自北京百奥莱科技有限公司。
1.3 方法
1.3.1 菟丝子乙醇提取物的制备 菟丝子乙醇提取物由浙江中医药大学中药炮制实验室制备并提供,制备方法为:30 g菟丝子生品药材经粉碎机粉碎,过40目筛,称重定量后放入500 ml的95%乙醇内,浸泡30 min,回流提取3次,每次提取60 min,混合3次滤液并过滤得到醇提液,使用旋转蒸发仪减压回收乙醇,随后在真空环境下(温度60℃,真空度0.1 mpa)干燥3~4 d,将得到的乙醇提取物加入100 ml纯水溶解,经0.2 μm滤菌膜抽提过滤,定容为100 ml放入棕色瓶中,封口膜密封避光保存,生药浓度为0.1 g/ml。
1.3.2 宫颈癌Hela细胞的培养 将Hela细胞置于高糖DMEM完全培养基(含青霉素100 U/ml、链霉素100 μg/ml、10%FBS)中培养,置于恒温箱 37 ℃、体积分数为5%CO2的培养箱中培养,隔日换液,当细胞生长密度达到80%~90%时,取处于对数生长期的Hela细胞进行传代培养。
1.3.3 实验分组及细胞周期检测 将培养好的细胞充分混匀后铺到96孔板细胞培养板,分为5组,对照组仅给予1%DMSO,其余4组为实验组,分别加入3.125、6.25、12.5、25 mg/ml的菟丝子乙醇提取物。收集培育48 h后的各组细胞,用0.25%胰酶消化,以1 500 r/min离心10 min,去上清液,PBS洗涤2次,弃上清液,加预冷乙醇溶液70%振荡,4℃过夜。再用PBS洗涤1次后室温条件下加碘化丙啶30 μl/管,染色20 min,最后采用流式细胞术检测细胞周期。
1.3.4 MTT比色法检测细胞增殖能力 取对数生长期的Hela细胞消化制备单细胞悬液,以每孔4 000个细胞接种于96孔板中,每组设5个复孔,1个对照孔;置于恒温37℃、体积分数5%的CO2培养箱中培养12、24、48 h。48 h后加入5 mg/ml的 MTT 溶液 10 μl,37 ℃孵育4 h后弃上清液,每孔中加入200 μl DMSO溶解结晶,12 h后用570 nm波长测定各孔吸光度值,求其平均值。每个药物浓度设平行3孔。细胞生长的抑制率(%)=(对照组吸光度值-实验组吸光度值)/对照组吸光度值×100%。
1.3.5 Transwell迁移和侵袭实验 收集各浓度菟丝子乙醇提取物处理48 h后的Hela细胞,制备成1×105个/ml的单细胞混悬液。实验组Transwell上室中加入200 μl的细胞悬液,下室加入含10%FBS的DMEM高糖培养基,培养24 h后取出,擦去上室内表面细胞,PBS洗涤3次,4%多聚甲醛固定15 min,结晶紫染色30 min,蒸馏水冲净浮色,光镜(×200)下计数至少5个视野中的穿过滤膜的细胞个数,以平均细胞数表示细胞迁移能力。将50 mg/L的基质胶均匀铺在Transwell小室的上室底部,过夜干燥,其他步骤与迁移实验相同。光镜(×200)下计数至少5个视野中穿过滤膜的细胞个数,以平均细胞数表示细胞侵袭能力。
1.3.6 Western blot检测细胞蛋白的表达 收集各浓度菟丝子乙醇提取物处理48 h后的Hela细胞,弃培养基,预冷PBS清洗3次,加入含有10%蛋白酶抑制剂PMSF的RIPA裂解液,冰上裂解细胞。收集细胞裂解液,使用蛋白提取试剂盒,采用BCA法测定蛋白质浓度后进行SDS-PAGE电泳。电泳后采用湿转法将蛋白转移至PVDF膜上,加入封闭液室温摇床封闭2 h。次日加入一抗 Caspase-3 单克隆抗体(1∶1 000)、Bcl-2单克隆抗体(1∶1 000)及 GAPDH 多克隆抗体(1∶1 000),室温孵育 4 h,PBST 洗膜后加入相应的二抗(1∶500),室温孵育2 h。PBST洗膜后,PVDF膜置于胶片上,蛋白面朝上滴加适量的ECL发光液并迅速放入凝胶成像仪中成像分析测定各条带面积灰度值,重复3次,以平均数表示最终实验结果。
1.4 统计学处理 采用SPSS 23.0统计软件。计量资料以±s表示,多组比较采用单因素方差分析,组间两两比较采用LSD-t检验;计数资料以百分率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 宫颈癌Hela细胞的生长曲线及形态学观察 宫颈癌Hela细胞的生长曲线呈典型的“S”形,前2 d的细胞量略有降低,可能与部分细胞死亡有关。从第3天开始,细胞进入对数生长期,第7天达高峰;随后逐渐降低(图1a)。给予不同浓度的菟丝子乙醇提取物后,实验组细胞贴壁生长,在高倍镜(×100)下观察部分Hela细胞形态皱缩、个别细胞出现破碎或星状突,细胞间隙增宽(图 1b)。
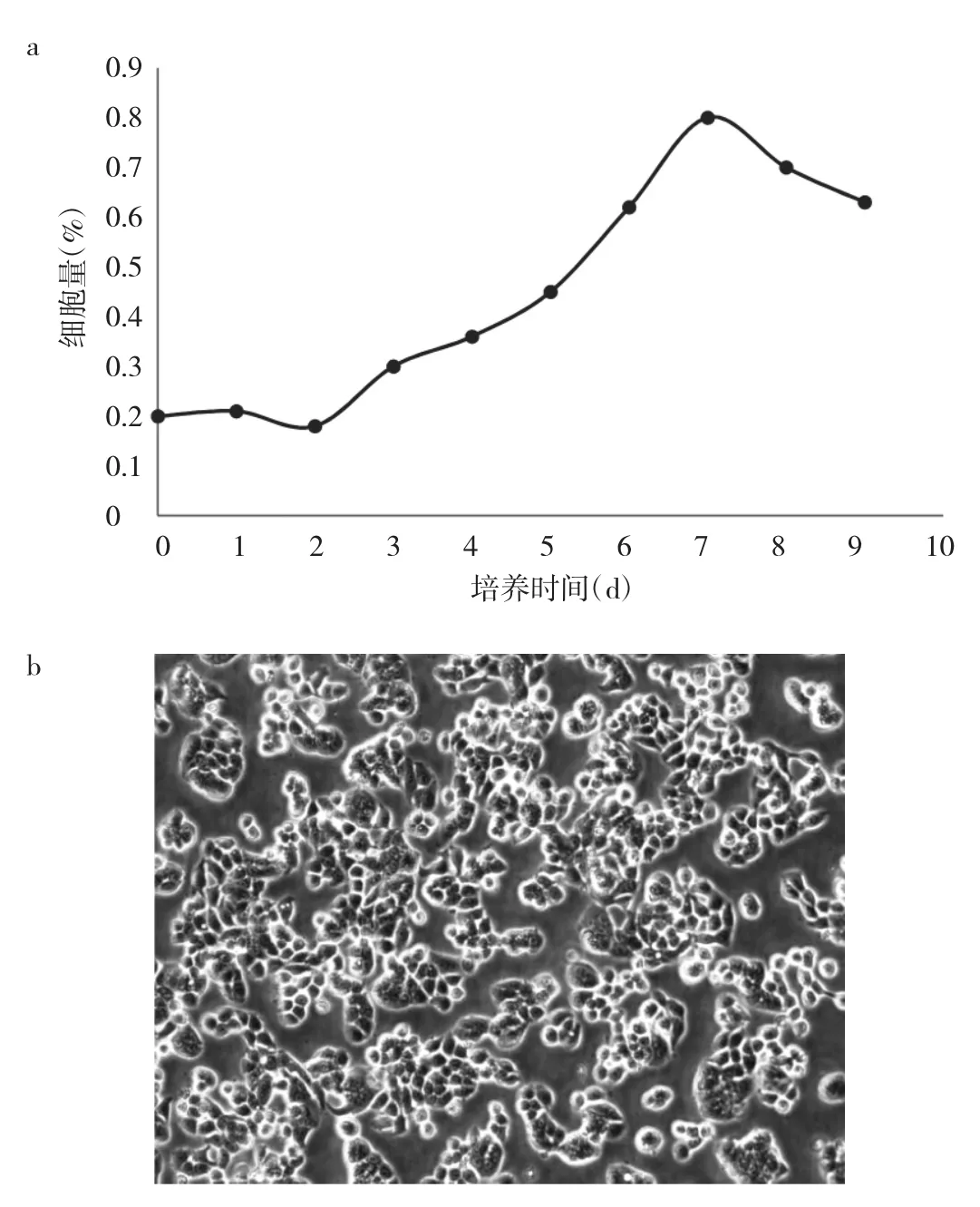
图1 宫颈癌Hela细胞的生长曲线(a)及形态学观察(b)
2.2 不同浓度菟丝子乙醇提取物对宫颈癌Hela细胞周期的影响 见表1。
由表1可见,宫颈癌Hela细胞经不同浓度菟丝子乙醇提取物作用后,25 mg/ml组G2/M期的细胞数比例显著高于其余各组,G0/G1期的细胞数比例显著低于其余各组,差异均有统计学意义(均P<0.05)。与对照组相比,仅12.5、25 mg/ml组G2/M期的细胞数比例显著增加,G0/G1期细胞比例下降,差异均有统计学意义(均P<0.05)。
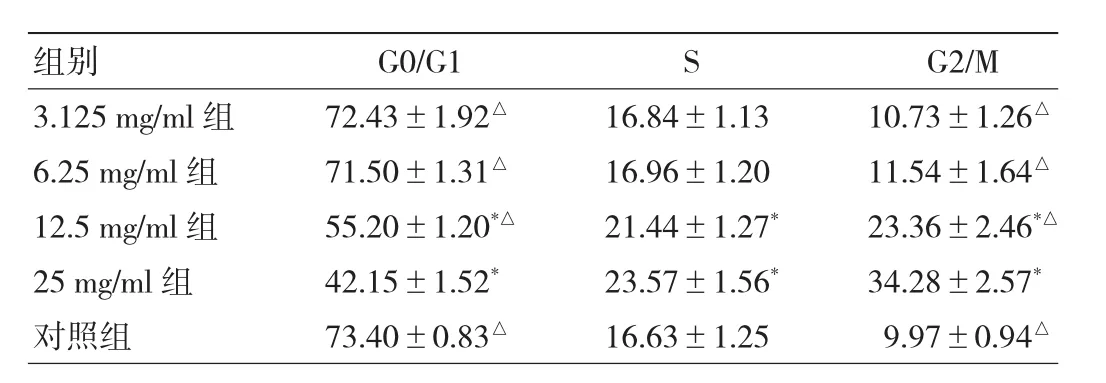
表1 不同浓度菟丝子乙醇提取物对Hela细胞周期的影响(h)
2.3 不同浓度菟丝子乙醇提取物对宫颈癌Hela细胞增殖的影响 见表2。
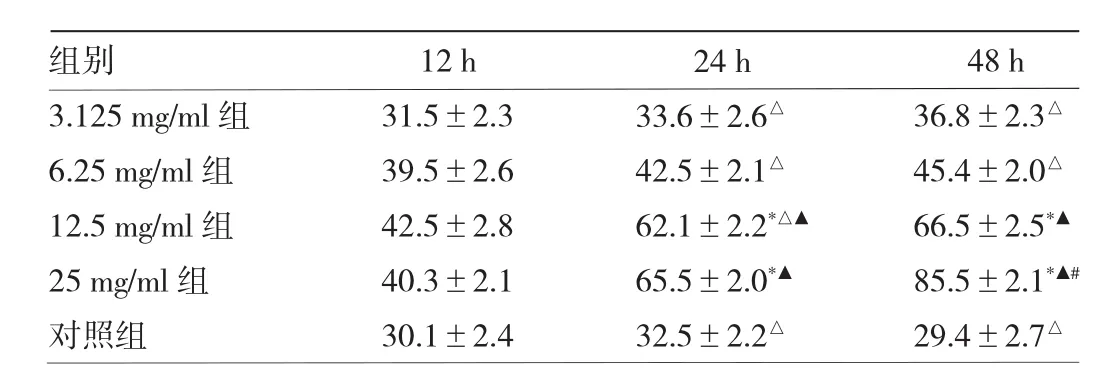
表2 不同浓度菟丝子乙醇提取物对宫颈癌Hela细胞不同时间点增殖抑制率的影响(%)
由表2可见,在培养12 h时,不同浓度的菟丝子乙醇提取物对宫颈癌Hela细胞的增殖抑制率在各组之间差异无统计学意义(P>0.05)。培养24 h后,25 mg/ml组宫颈癌Hela细胞的增殖抑制率均显著高于其余各组(均P<0.05)。3.125 mg/ml组和 6.25 mg/ml组不同时间点宫颈癌Hela细胞的增殖抑制率差异均无统计学意义(均P>0.05)。12.5 mg/ml组宫颈癌Hela细胞的增殖抑制率在24、48 h之间差异无统计学意义(P>0.05),但均显著高于12 h的增殖抑制率(均P<0.05)。25 mg/ml组宫颈癌Hela细胞的增殖抑制率随着时间的延长显著增加,差异均有统计学意义(均P<0.05)。
2.4 不同浓度菟丝子乙醇提取物对宫颈癌Hela细胞迁移及侵袭能力的影响 见表3。
由表3可见,在迁移实验中,3.125 mg/ml组与对照组差异无统计学意义(P>0.05),其余各组穿透小室的细胞数均小于对照组,差异均有统计学意义(均P<0.05)。25 mg/ml组穿透小室的细胞数均低于其余各组,差异均有统计学意义(均P<0.05)。

表3 不同浓度菟丝子乙醇提取物对宫颈癌Hela细胞迁移及侵袭能力的影响(105/ml)
2.5 不同浓度菟丝子乙醇提取物对宫颈癌Hela细胞凋亡相关蛋白的影响 见表4、图2。

表4 不同浓度菟丝子乙醇提取物对宫颈癌Hela细胞凋亡相关蛋白的影响

图2 不同浓度菟丝子乙醇提取物的电泳图
由表 4、图 2 可见,48 h 后,12.5、25 mg/ml组的宫颈癌Hela细胞中促凋亡蛋白Caspase-3表达均较对照组增加(均P<0.05),抗凋亡蛋白Bcl-2表达均较对照组降低(均P<0.05)。其中25 mg/ml组的Caspase-3表达水平均高于其余各组,Bcl-2表达水平均低于其余各组,差异均有统计学意义(均P<0.05)。
3 讨论
菟丝子在中国被广泛使用了数千年,具有抗生殖、改善内分泌及雌激素样作用,除此之外,菟丝子还具有抗衰老、抗氧化、免疫调节等诸多作用[5-6]。既往表明,菟丝子可以通过调节雌激素受体和黄体生成素受体(luteinizing hormone receptor,LHR)参与下丘脑-垂体-卵巢轴(hypothalamic-pituitary-ovarianaxis,HPOA)轴治疗卵巢内分泌和生殖功能障碍,对内分泌和免疫功能产生影响[6],而宫颈癌与雌激素密切相关,但是尚未发现有菟丝子对宫颈癌的相关研究。因此,本研究拟通过菟丝子乙醇提取物对宫颈癌Hela细胞生物学行为的影响寻找相关作用机制。
以往研究显示在菟丝子提取物中主要包括黄酮、芦丁、异鼠李素、少量金丝桃苷和山奈酚等成分。根据高效液相色谱的结果,黄酮是主要的活性成分[7-8]。而中药单体成分中黄酮类物质已经被广泛证实具有抗血管生成、舒张血管、抗细菌和病毒感染、抗肿瘤等生物活性作用[9-10]。本研究结果显示不同浓度的菟丝子乙醇提取物对宫颈癌Hela细胞的细胞周期及增殖均有影响,浓度较高的菟丝子乙醇提取物可以将Hela细胞阻滞在G2/M期,并且增殖抑制率具有随时间剂量的依赖性。这与国内的部分研究结果相似[11-12],郭澄等[11]的研究发现菟丝子中提取的黄酮成分对肿瘤坏死因子的抑制率达到18.3%~36.3%,认为中药菟丝子具有抗肿瘤作用。金松等[12]的研究也显示菟丝子可以有效抑制胃癌细胞的增殖和迁移。
本研究结果显示菟丝子乙醇提取物能够以剂量和时间依赖的方式抑制Hela细胞的迁移和侵袭能力,这与之前的研究一致[13]。Ray等[13]的研究显示Hela细胞通过中药提取物黄酮成分处理24 h后,通过激活p53和p21使细胞周期停滞。其中p21过表达时可通过与多种细胞周期蛋白/CDK复合物的相互作用引起细胞周期停滞。并且p21作为一种细胞周期蛋白依赖性激酶抑制剂,在细胞应激或DNA损伤后被p53上调。研究也显示DNA损伤可导致肿瘤抑制蛋白p53水平升高,诱导G1期、G2期或S期细胞周期停滞,并使DNA修复发生[14],由于p53介导的p21活化是改变癌细胞生长的关键,因此笔者推测菟丝子提取物对Hela细胞周期的阻滞可能与Hela细胞中p53依赖性调节有关[15]。
肿瘤细胞转移是由一系列涉及细胞迁移、侵袭和黏附的复杂过程组成[16]。为了检测菟丝子乙醇提取物对Hela细胞的抗转移活性。本研究进行了Transwell侵袭和迁移体外试验,结果显示与对照相比,高浓度的菟丝子乙醇提取物限制了Hela细胞的侵袭和迁移。既往研究认为MMP-9和MMP-2的抑制可以显著减少宫颈癌细胞的肿瘤侵袭和转移[17]。国内研究也显示中药成分中的黄酮类成分可以有效抑制MMP-9和MMP-2蛋白的表达[18]。
既往大量研究显示细胞周期停滞和细胞凋亡相互关联[19]。本研究中还发现随着菟丝子乙醇提取物浓度的增加,Hela细胞中促凋亡蛋白Caspase-3表达量逐渐上升,抗凋亡蛋白Bcl-2表达下调。众所周知,Bcl-2家族蛋白和Caspase-3家族蛋白在细胞凋亡中发挥重要作用,其中Bcl-2家族蛋白成员通过调节线粒体外膜通透性来控制线粒体凋亡途径[20]。Bcl-2的表达降低时会导致线粒体膜的去极化,通过激活半胱天冬酶级联和释放细胞色素C等促凋亡因子导致线粒体基质扩增,从而调控细胞凋亡[20]。Caspase-3也是凋亡的典型标志物,是凋亡过程中的主要终末执行酶,在某些与细胞解体和凋亡体形成相关的过程中必不可少[21],研究显示Caspase-3可以降解多聚ADP-核糖聚合酶等抑制DNA复制和修复,并干扰mRNA的剪切,使细胞表现出染色体固缩,DNA片段化等凋亡特征,进而形成凋亡小体[21]。
总之,本研究结果显示高浓度的菟丝子乙醇提取物可以通过阻滞细胞周期于G2/M期,抑制Hela细胞的侵袭和迁移,通过促进Caspase-3上调和Bcl-2下调促进Hela细胞凋亡,提示高浓度的菟丝子乙醇提取物有望成为抗宫颈癌药物的可能。

