抑郁症患者血清鸢尾素水平与认知功能的关系
雷 雨 刘 伟 包 黎
近年来,随着社会节奏的加快,抑郁症的发病率不断攀升,抑郁症主要特征是持久性的与处境不相称的情绪低落、以及诸如疲倦乏力、失眠、呕吐等复杂多变的躯体症状,发病机制尚不明确[1],24项汉密尔顿抑郁量表(Hamilton Depression Scale-24,HAMD-24)是公认的抑郁症病情严重程度评估量表,评分越高反映病情越严重[2]。抑郁症患者随着病情不断发展,认知功能受到一定程度的损伤,不利于病情恢复[3]。蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)是常用认知功能评估工具,信效度良好[4]。鸢尾素是由前体纤维连接蛋白Ⅲ型域包含蛋白5(Fibronectin Type Ⅲ Domain-Containing 5,FNDC5)经蛋白水解酶水解生成的多肽片段,具有促进脂肪组织棕色化、改善胰岛素抵抗、提高认知功能等作用[5],但关于抑郁症患者血清鸢尾素水平与认知功能关系的研究尚未见诸报道,本研究就此展开研究。
1 对象与方法
1.1 对象 选取2016年3月~2018年11月在武汉市精神卫生中心就诊的217例抑郁症患者为研究对象,年龄22~55岁。纳入标准:(1)符合美国精神障碍诊断与统计手册第4版(DSM-4)中关于抑郁症的诊断标准[6];(2)汉族;(3)年龄18~60岁;(4)右利手;(5)6个月内无严重生活创伤史;(6)受教育程度为初中及以上;(7)无严重器质性病史;(8)1个月内未服用影响认知功能的药物。排除标准:(1)合并其他精神疾病者;(2)孕妇及哺乳期女性;(3)酗酒史;(4)药物滥用史。依据HAMD-24评估的疾病严重程度将研究对象分为三组,轻度组(80例)、中度组(65例)、重度组(72例)。轻度组男37例,女43例,平均年龄(36.25±7.91)岁,平均体质量指数(BMI)(23.89±2.28) kg/m2,平均受教育年限(11.15±3.03)年;中度组男28例,女37例,平均年龄(35.76±7.45)岁,平均BMI(23.34±2.83) kg/m2,平均受教育年限(11.63±3.42)年;重度组男42例,女30例,平均年龄(35.93±6.72)岁,平均BMI(23.65±2.77) kg/m2,平均受教育年限(11.38±3.21)年。三组性别、年龄、BMI、受教育程度比较差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准,患者及家属知情并签署同意书。
1.2 方法
1.2.1 HAMD-24 量表共24题,可归纳为7类因子:焦虑/躯体化、体重、认知障碍、日夜变化、阻滞、睡眠障碍、绝望感,采用0~4分五级评分法,无症状为0分,轻度为1分,中度为2分,重度为3分,极重度为4分。由两名经培训的精神科主治医师共同评定。HAMD-24评分<8分为无抑郁症状,8分≤HAMD-24评分<20分为轻度抑郁,20≤HAMD-24评分<35分为中度抑郁,HAMD-24评分≥35分为重度抑郁[2]。
1.2.2 MoCA 共11个检查项目,30个单项,总分30分,答对计为1分,不回答或答不知道或答错计为0分。包括以下8项认知领域:视空间与执行功能(共5分)、命名(共3分)、记忆(不计分)、注意力(共6分)、语言能力(共3分)、抽象能力(共2分)、延迟回忆(共5分)、定向力(共6分),MoCA评分在26分及以上者为认知功能正常。整个测试在安静环境中进行,并使用标准化用语。
1.2.3 血清鸢尾素水平检测 清晨抽取研究对象5 ml空腹静脉血,放置30 min,离心(3 000 r/min,10 min),保留上层血清于-20 ℃冰箱中,采用酶联免疫吸附法(Enzyme Linked Immunaosorbont Assay,ELISA)检测血清鸢尾素水平,严格按照试剂盒说明书步骤操作,试剂盒购于美国R&D公司。应用美国Thermo Labsystems公司生产的MULTISKAN MK3型酶标仪在450 nm波长下测量吸光度值,绘制标准曲线,根据标本吸光度值计算对应鸢尾素水平。

2 结果
2.1 三组HAMD-24评分比较 轻度组、中度组、重度组HAMD-24评分分别为(15.21±2.43)分、(26.56±2.93)分、(41.46±5.78)分,三组HAMD-24评分比较差异有统计学意义(F=826.376,P=0.000),进一步比较发现,三组的HAMD-24评分依次升高(P<0.05)。
2.2 三组MoCA评分比较 轻度组、中度组、重度组MoCA总分及视空间与执行功能、命名、注意力、语言能力、抽象能力、延迟回忆因子分比较差异有统计学意义(P<0.05),进一步比较发现,三组总分及视空间与执行功能、命名、注意力、语言能力、抽象能力、延迟回忆均依次降低(P<0.05)。见表1。
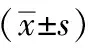
表1 三组MoCA评分比较
2.3 三组血清鸢尾素水平比较 轻度组、中度组、重度组血清鸢尾素水平分别为(3.02±0.83)ng/L、(2.67±0.51)ng/L、(2.33±0.65)ng/L,三组血清鸢尾素水平比较差异有统计学意义(F=19.127,P=0.000),进一步两两比较发现,三组血清鸢尾素水平依次降低(P<0.05)。
2.4 抑郁症患者血清鸢尾素水平与HAMD-24、MoCA评分相关性分析 Spearman结果显示,抑郁症患者血清鸢尾素水平与HAMD-24评分呈负相关(r=-0.537,P=0.000),与MoCA总分呈正相关(r=0.625,P=0.000)。
3 讨论
现代人们的心理压力越来越大,加上个体的消极应对方式使抑郁症的发病率逐年增高,抑郁症致残率、自杀率极高,对家庭、社会都造成沉重负担,已成为位列第二的威胁人类健康的疾病[6]。约2/3的抑郁症患者均出现不同程度的认知损伤,认知损伤不仅是抑郁症患者的普遍临床症状,同时也对抑郁症的康复造成不利影响,部分抑郁症患者康复之后认知损伤依然存在[3],监测抑郁症患者的认知功能有助于病情改善及增强患者社会适应性,生物学指标具有客观、可量化的优点,分析抑郁症患者生物学变化有助于抑郁症机制的阐明,同时也可为抑郁症的治疗提供新思路。孔令明等[7]研究发现,与健康对照相比,重度抑郁症患者视空间与执行能力、注意力与计算力、语言能力、抽象能力、延迟记忆评分均较低,命名、定向力比较差异无统计学意义,重度抑郁症患者存在认知障碍。本研究结果发现,轻度组、中度组、重度组MoCA总分及视空间与执行功能、命名、注意力、语言能力、抽象能力、延迟回忆均依次降低,提示抑郁症患者认知功能受损,与上述研究一致。抑郁症与认知功能受损发病机制可能都与β淀粉样蛋白增多、脑源性神经营养因子调节失衡、炎症因子激活、氧化应激反应及海马萎缩有关[8]。抑郁症患者认知功能受损已有生物学基础,研究表明,执行功能受损与前额叶及皮下核团相关,注意力受损与额顶、枕叶及扣带回有关,记忆力受损与海马、内侧颞叶皮质、扣带回等有关[9]。
蛋白激酶可使过氧化物酶体增殖活化受体γ辅助活化因子1α发生磷酸化而激活,进而促进FNDC5的表达,FNDC5经水解酶剪切后形成裂解产物鸢尾素分泌到血液中,鸢尾素包含112个氨基酸,进化上具高度保守性,人与小鼠的序列同源性约为100%,在机体广泛分布[10,11],与2型糖尿病[12]、心血管疾病[13]、肿瘤[14]、认知受损[15]等密切相关,发挥不可或缺的作用。国内外报道均指出血清鸢尾素水平受肌肉组织水平及运动强度直接影响,苏坤霞[16]研究发现,高脂诱导肥胖小鼠模型血清鸢尾素水平降低,采取耐力运动训练后,鸢尾素水平升高,Belviranli M等[15]进一步研究了血清鸢尾素与认知功能的关系,发现耐力运动员MMSE评分、鸢尾素水平均较久坐不动者高,两者呈正相关。本研究发现,轻度组、中度组、重度组血清鸢尾素水平依次降低,提示血清鸢尾素可能参与抑郁症的发生,进一步研究结果显示,抑郁症患者血清鸢尾素水平与HAMD-24评分呈负相关,与MoCA总分呈正相关,提示血清鸢尾素水平可能成为抑郁症患者的病情发展及认知功能损伤评估指标,另外,运动或可对抑郁症患者认知功能受损产生积极作用。分析原因是鸢尾素可能与海马神经生成有关,其水平降低可能导致脑源性神经营养因子表达减少,促使神经细胞生成减少,最终导致认知功能受损[15,17]。
综上所述,抑郁症患者血清鸢尾素水平较低,且与病情严重程度、认知功能受损程度具有相关性,可能成为抑郁症的病情监测指标及指标靶点,但其具体作用机制尚待进一步研究。

