河流漫游球菌蛋白质组鉴定及功能初探
曹 喻,周 婷,段晓雷,陈泽慧,杨 欢,闵 迅,
漫游球菌属(Vagococcus)是一类独特的革兰氏阳性菌,呈球形,与乳球菌类似,可与乳酸链球菌抗血清反应,可感染多种动物;同时也有少数菌株被报道能引起人类感染,在临床标本中可分离到。首株漫游球菌发现于1989年,由Collins等人发现并报道[1],为河流漫游球菌(Vagococcusfluvialis);随后其他研究团队陆续发现了鲑鱼漫游球菌(Vagococcussalmoninarum)[2-3]、水獭漫游球菌(Vagococcuslutrae)[4]、海豹漫游球菌(Vagococcusfessus)[5]和嗜肉漫游球菌(Vagococcuscarniphilus)[6]等。到目前,已发现的多种漫游球菌属细菌中仅有河流漫游球菌和水獭漫游球菌报道与人类感染有关,主要可以在血液、腹膜液、伤口和牙根几个地方分离到该细菌。1997年Teixeira等人[7]首次从人体组织中分离出河流漫游球菌;2008年Al-Ahmad A等人从根周病变的根部填充牙齿内[8]发现了第一株口腔中的河流漫游球菌;2009年Schirrmeister JF等人也对口腔根周病变的根部填充牙齿内的河流漫游球菌进行了报道[9]。水獭漫游球菌最初分离于水獭等海洋生物,很少被报道为人类的病原体。Garcia V等人于2016年发现了首例人感染的水獭漫游球菌[10]。河流漫游球菌可引起人类和动物感染,如伤口感染时会出现边缘皮肤红肿、患肢肿胀、周围皮肤张力及皮温高、压痛及触痛存在。临床若不及时给与抗感染治疗或治疗不合理,可引发血流感染,重者可危及生命[10-11]。
近年来,基于质谱平台的蛋白质组技术飞速发展,不同于蛋白质组学在肿瘤等重大疾病的广泛应用,目前其在细菌研究中的应用相对较少,具有较大的发展空间[12-14]。用蛋白质组学揭示细菌的特异蛋白质表达,由表达引出内在蛋白质之间的差异是近几年来相关研究的一个重点,但是至今尚无关于漫游球菌属微生物特异表征的蛋白质组学研究的任何报道。最近的研究工作中,团队成员在一骨科临床患者左股骨中下段创口术后感染穿刺液中分离得到一株革兰阳性球菌,经鉴定为河流漫游球菌;在此部位发现河流漫游球菌在世界范围内尚属首次[15]。本研究利用高精度无标定量蛋白质组学技术对该临床发现的河流漫游球菌进行蛋白质组组分的全面鉴定;采用生物信息学分析方法对河流漫游球菌表达蛋白的生物学功能开展探讨,以为临床河流漫游球菌的诊断与治疗提供新的蛋白质组实验数据参考。
1 材料与方法
1.1菌株样本分离和培养 菌株样本分离自遵义医科大学附属医院骨一科病房住院的女性患者,为术后感染菌。取患处穿刺液标本培养,以分区划线的方式接种于麦康凯平皿和哥伦比亚血平皿中,放置于温度为35 ℃、二氧化碳浓度为5%的孵箱中培养24~48 h,观察并记录菌落形态。此株细菌在哥伦比亚血平板上生长,涂片经革兰染色后通过油镜观察其形态,判断为革兰阳性的球菌;随后经过一系列生化试验,以及质谱和16S rRNA分析,最终鉴定该菌株为河流漫游球菌[15]。
1.2主要试剂和仪器 实验中使用的主要仪器包括:显微镜(Olympus,型号:CX41),全自动微生物鉴定及药敏分析系统(Bio Mérieux,型号:VIYTEK- 2Compact),全自动快速微生物质谱监测系统(Bio Mérieux,型号:VITEK MS),测序仪(ABI,型号:3730xl),电泳系统(Bio-Rad),涡旋振荡器(其林贝尔仪器,型号:QL-901),离心机(赛默飞世尔科技,型号:PICO17),恒温孵育器(浦东荣丰科学仪器,型号:HH.S4),酶标仪(赛默飞世尔科技,型号:Multiskan MK3),高效液相色谱仪:(赛默飞世尔科技,型号:EASY-nLC 1000 System),质谱系统(赛默飞世尔科技,型号:Orbitrap Fusion)。
主要试剂包括:阳性球菌鉴定卡板(Bio Mérieux),CHCA基质液(Bio Mérieux),快速革兰氏染色液(珠海贝索),哥伦比亚血琼脂培养基(郑州贝瑞特生物),麦康凯琼脂培养基(郑州贝瑞特生物),Mueller-Hinton琼脂培养基(郑州贝瑞特生物),革兰氏阳性细菌基因组DNA提取试剂盒(上海欧孚生物医药科技),通用型16SrDNA PCR扩增检测试剂盒(北京派拓科技),抗菌药物纸片(塞默飞世尔科技),尿素(Bio-Rad),硫脲(Sigma-Aldrich),CHAPS(Bio-Rad),蛋白定量染液(Thermo Scientific),牛血清白蛋白(Sigma-Aldrich),DTT(10 mmol/L IAA in H2O),IAA(50 mmol/L IAA in H2O),Trypsin buffer(4 μL Trypsin in 40 μL NH4HCO3),胰蛋白酶(AB Sciex),乙腈(Thermo Scientific),FA(Sigma)。
1.3蛋白提取和定量 蛋白裂解液(7 mol/L尿素,2 mol/L硫脲)加入菌株样本中,随后进行涡旋混匀;超声60 s(0.2 s on、2 s off,振幅22%);在室温条件下进行蛋白质提取(30 min);4 ℃条件下15 000 r/min离心20 min,取上清分装后于-80 ℃冰箱保存待用。实验样本提取的蛋白质采用Bradford方法[16]完成定量:首先使用裂解液将样本蛋白混合物进行一定比例稀释,使待测样本浓度处于标准曲线范围内;然后,将稀释好的样本蛋白混合物和标准品(标准蛋白品由BSA和不同比例裂解液溶解制成)各取10 μL,分别和蛋白定量染料避光进行反应(300 μL,20 min);最后,使用酶标仪分别测定样本蛋白和标准品蛋白在595 nm下的吸光值,绘制标准曲线,并根据标准品吸光值和浓度的对应关系计算样本蛋白浓度。
1.4蛋白质酶解 蛋白质定量后取60 μg蛋白溶液置于离心管中;按照溶液总体积加入1 mol/L DTT溶液5 μL,涡旋混匀,放入水浴锅中37 ℃保温1 h,取出放至室温。还原后的样品加入1mol/L IAA溶液20 μL,涡旋混匀,室温条件下避光放置1 h;吸取所有样品加入超滤管中,12 000 r/min离心10 min后弃收集管底部溶液;加入100 μL UA(8M urea,100 mmol/L Tris-HCl,pH8.0)至超滤管中,离心后弃收集液,重复2次;加入50 mmol/L NH4HCO3100 μL,离心后弃收集液,重复3次;更新收集管,在超滤管中加入胰蛋白酶,按照蛋白和酶50∶1的比例加入Trypsin,37 ℃酶解12~16 h。
1.5质谱分析 采用纳升级反相色谱-质谱系统对胰蛋白酶酶解后肽段进行无标记定量蛋白质组检测。液相色谱-串联质谱系统(LC-MS/MS)由纳升级高效液相色谱仪(HPLC,赛默飞EASY-nLC 1000)和Orbitrap Fusion质谱仪(塞默飞世尔科技)组成。肽段混合物首先采用high-pH反向色谱(Hp-RP)进行分离,然后用20 μL 2%甲醇,0.1%甲酸进行复溶;12 000 g离心10 min,吸取上清10 μL进行上样。使用120 min线性梯度填充液相色谱柱,Orbitrap Fusion质谱系统以数据依赖模式运行(Data-dependent mode),选择每次一级质谱(MS)扫描的前20个最强峰进行二级质谱(MS/MS)分析。一级质谱母离子扫描范围为:350~1 800 m/z,分辨率为:70 000 FWHM,AGC目标值为:3×106,一级Maximum IT(maximum injection time)为:60 ms。二级质谱分辨率为:17 500 FWHM,AGC目标值为:5×106,二级Maximum IT为:70 ms;碰撞能量为:HCD 29%。
1.6质谱数据鉴定及生物信息学分析 质谱仪器产出的原始数据采用软件MaxQuant[17-18](软件版本:1.6.5.0)进行搜库鉴定及定量分析。从UniProt[19](https://www.uniprot.org/)中下载的漫游球菌属(Vagococcus)蛋白质序列作为搜索数据库。主要数据库搜索参数设置如下:母离子及碎片离子质量误差分别为±(15×10-6)和± 20 mmu;半胱氨酸(Cysteine,C)还原烷基化(Carbamidomethylation,+57.02 Da)为固定修饰;蛋氨酸(Methionine,M)氧化(Oxidation,+15.99 Da)和蛋白质N端乙酰化(Acetyl,Protein N-term)为可变修饰;胰酶酶切且最多允许两个漏切位点。要求肽段和蛋白水平的假阳性率均低于1%,采用MaxQuant软件中绝对定量算法iBAQ[20]进行鉴定蛋白质丰度计算。
1.7生物信息学分析 基于UniProt数据库中蛋白质功能注释,对质谱鉴定得到的河流漫游球菌蛋白质进行Gene Ontology (GO)[21]功能注释和KEGG通路[22]注释,其中GO功能注释主要包括生物学过程(biological process,BP),分子功能(molecular function,MF)以及细胞组分(cellular component,CC)3大类别;进一步采用过表达分析方法进行功能富集分析,基于超几何分布进行统计学检验,计算出鉴定蛋白质在特定GO功能类别或KEGG通路上显著富集程度的P值,以及基于多重假设检验的FDR校正值,并基于-log(Pvalue)计算获得富集度。
2 结 果
2.1蛋白质组质谱数据搜索数据库探索及选择 为了获得最优的蛋白质鉴定,我们对质谱数据搜索的漫游球菌属蛋白质组序列库进行探索。首先,下载UniProt数据库中漫游球菌属(Vagococcus)中17个物种共31 361条蛋白质序列,包括:Vagococcusfluvialis(2 890条蛋白质序列),Vagococcuscarniphilus(2 909条蛋白质序列),VagococcusfluvialisbH819(2 822条蛋白质序列),Vagococcussp.SS1994(2 356条蛋白质序列),Vagococcusmartis(2 263条蛋白质序列),Vagococcussp.AM17-17(2 134条蛋白质序列),Vagococcuspenaei(2 065条蛋白质序列),Vagococcusteuberi(1 936条蛋白质序列),Vagococcussp.SS1995(2 196条蛋白质序列),Vagococcusacidifermentans(2 679条蛋白质序列),Vagococcussalmoninarum(2 867条蛋白质序列),Vagococcusfessus(2 113条蛋白质序列),VagococcuslutraeLBD1(1 736条蛋白质序列),Vagococcusentomophilus(2 260条蛋白质序列),Vagococcuslutrae(1 834条蛋白质序列),Vagococcuselongatus(2 623条蛋白质序列),Vagococcushumatus(1 966条蛋白质序列)。将上述漫游球菌属17个物种的蛋白质序列混合进行数据库搜索,并查看鉴定肽段序列在各个子物种序列库中的匹配情况。如图1所示,蓝色代表多个子物种库共同鉴定的肽段序列数目,红色代表各个子库独有鉴定的肽段序列数目;两个数字分别代表独有鉴定的肽段序列数目和总鉴定肽段数;采用河流漫游菌蛋白质序列库(Vagococcusfluvialis,2 890条蛋白质序列),不仅可以鉴定得到最多的总肽段数(9 818条肽段),并且可以鉴定到大量其他子物种数据库未包含的序列(5 790条肽段);该结果首先从蛋白质组数据的水平进一步佐证了前期菌种鉴定的准确性,同时也提示我们可以只采用河流漫游菌(Vagococcusfluvialis)蛋白质序列库的鉴定结果进行后续功能注释分析。

图1 鉴定肽段序列在漫游球菌属各个子物种序列库中匹配的分布Fig.1 Distribution of the identified peptide sequences in 17 different sub-species of Vagococcus
2.2河流漫游球菌蛋白质组表达谱 本研究对河流漫游菌样本进行了3次质谱技术重复实验,共鉴定得到1 372个蛋白质,为目前已知河流漫游球菌最全面的蛋白质组组分表达谱(详细列表见附录表1);如图2A所示,3次质谱实验分别鉴定到1 344(Rep1)、1 335(Rep2)和1 337(Rep3)个蛋白质,并且,3次技术重复实验鉴定蛋白质重叠率极高,同时鉴定和定量的蛋白质达到1 301(为总数的94.83%),说明了质谱实验良好的重复性和稳定性。
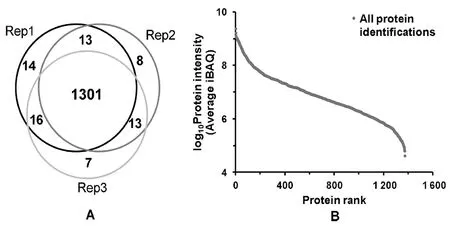
图2 河流漫游菌蛋白质组表达谱数据统计信息展示Fig.2 Statistics information of Vagococcus fluvialis proteome profile dataset
基于MaxQuant软件鉴定结果中的绝对定量值iBAQ,对所有鉴定蛋白质的3次重复实验丰度计算平均值,进一步基于平均iBAQ定量值对所有鉴定蛋白质丰度进行排序,蛋白质平均丰度的分布如图2B所示,跨越了5个数量级(104~109);丰度排名前10的蛋白质组成如表1所示,主要为酶和核糖体蛋白,包括甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase)、烯醇化酶(Enolase)、磷酸甘油酸激酶(Phosphoglycerate kinase),50S核糖体蛋白L4、L24和L19(50S ribosomal protein L4, L24, L19),以及30S核糖体蛋白S5、S9和S10(30S ribosomal protein S5, S9, S10)。
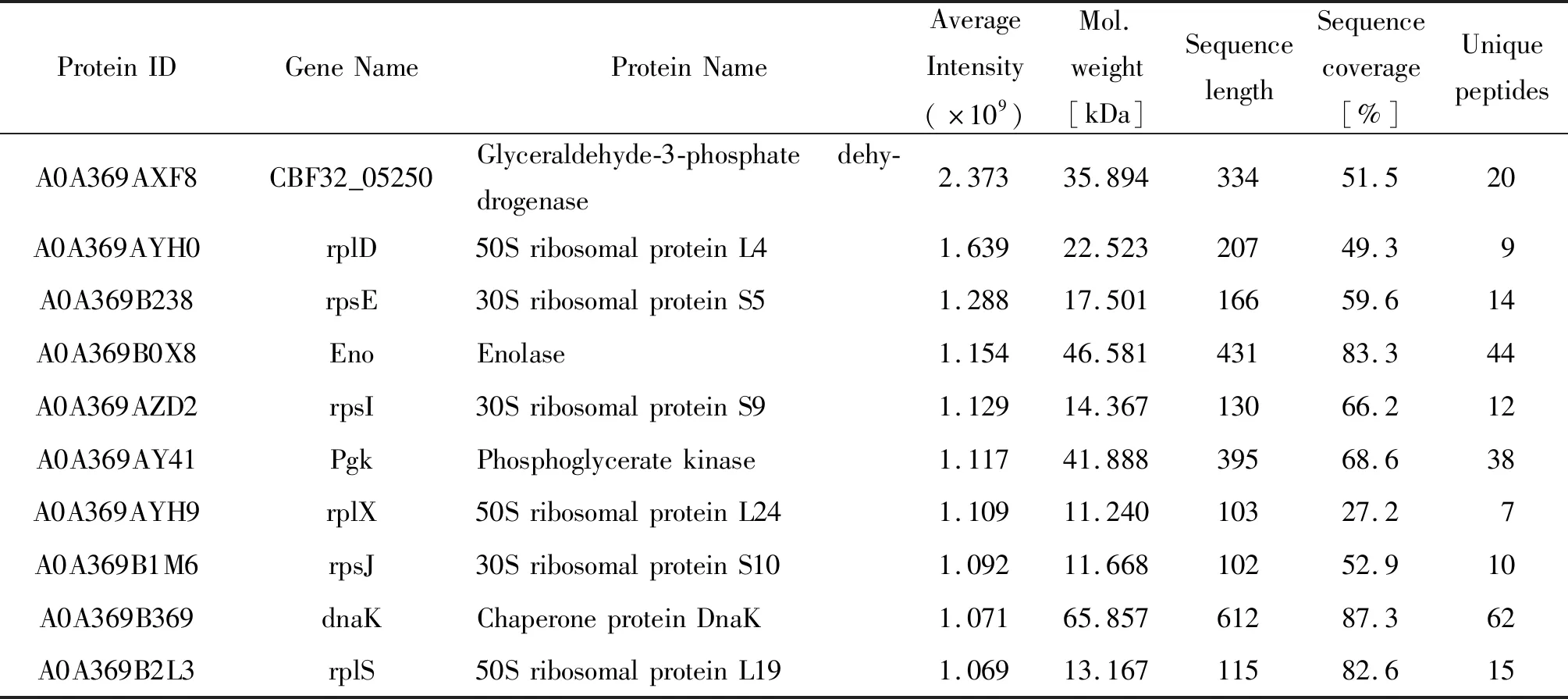
表1 平均丰度前10位蛋白质鉴定信息列表Tab.1 Detail information of the proteins identified with top ten intensities
2.3河流漫游球菌蛋白质功能注释分析 基于UniProt数据库中的注释,对蛋白质组质谱数据鉴定到的河流漫游菌的1 372个蛋白质分别进行生物学过程(Biological process)、分子功能(Molecular Function)和细胞组分(Cellular Component)注释和富集分析。如图3所示,河流漫游菌表达的蛋白主要参与的生物学过程包括:转录调控、碳水化合物代谢、细胞分裂、细胞周期、DNA复制和修复、细胞形态调节、跨膜转运、磷脂酶信号转导等;主要的分子功能包括:ATP结合、DNA结合、金属离子结合(包括锌离子、镁离子结合)、ATP酶活性、rRNA和RNA结合、核糖体的结构成分、DNA结合转录因子活性等分子功能;蛋白质的细胞组分组成主要包括:细胞质、染色体、核糖体、核糖体亚基、质膜和其他膜组分等。
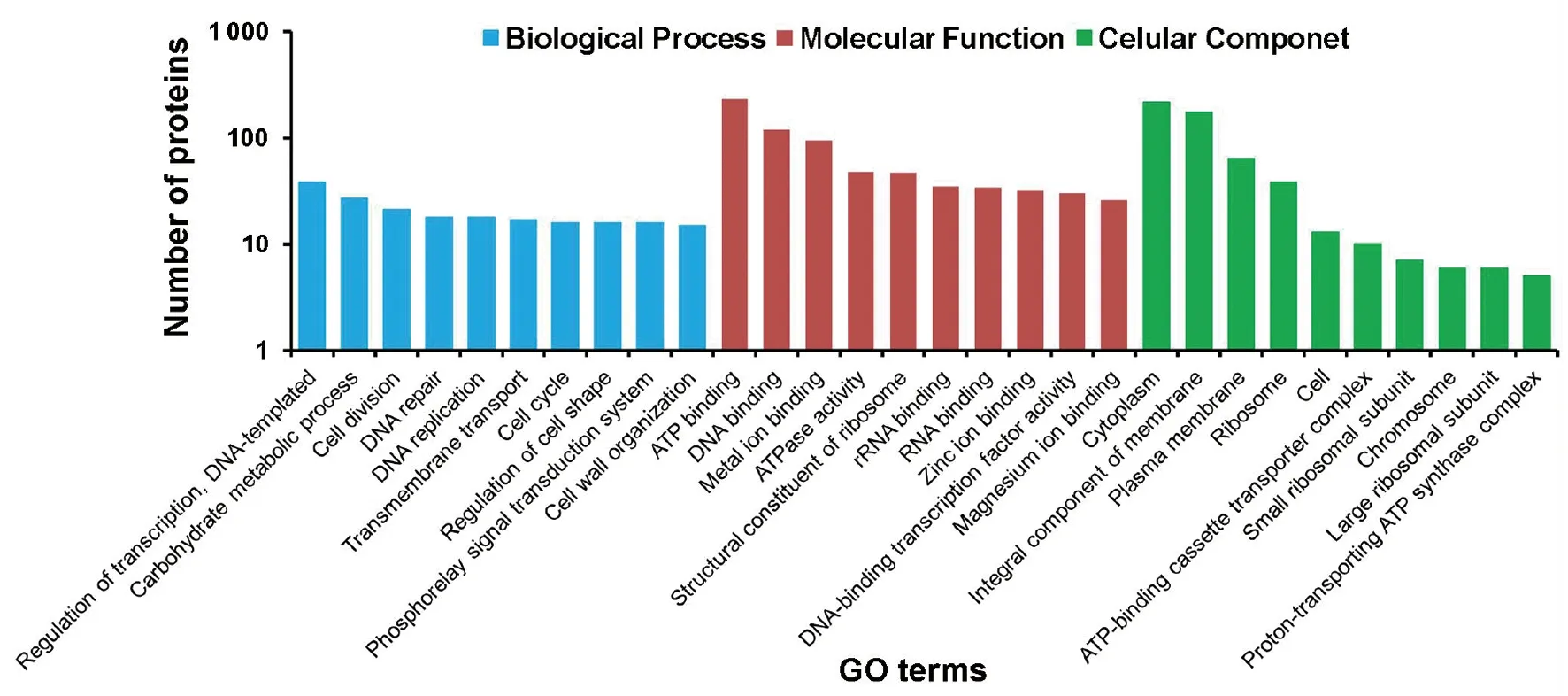
图3 河流漫游菌蛋白质GO功能注释分布图Fig.3 GO annotation distributions of proteins identified in Vagococcus fluvialis
2.4河流漫游球菌蛋白质通路富集分析 同样基于UniProt数据库中的注释,对河流漫游菌鉴定的蛋白质进行KEGG富集通路分析。如图4所示,河流漫游菌表达的蛋白主要参与生物合成和代谢两大类通路,以及核糖体、细菌分泌系统等相关通路。生物合成相关通路主要包括:氨基酸的生物合成、氨酰tRNA生物合成、苯丙氨酸、酪氨酸和色氨酸的生物合成,抗生素的生物合成、次生代谢产物的生物合成、脂肪酸生物合成、赖氨酸生物合成等;代谢相关通路主要包括:甘油酯代谢、嘧啶代谢、脂肪酸代谢、丙酸盐代谢、甘油磷脂代谢、烟酸和烟酰胺代谢等。

图4 河流漫游菌蛋白质通路富集分布图Fig.4 Pathways enrichment diagram of proteins identified in Vagococcus fluvialis
3 讨 论
国内外对河流漫游球菌属引起人感染的相关报道较少,我们基于临床骨科患者左股骨中下段深部组织穿刺液分离获得并鉴定一株河流漫游球菌,在此部位发现在世界范围内尚属首次[15]。进一步结合无标定量蛋白质组技术,构建了目前河流漫游球菌最全面的蛋白质组组分表达谱,共定性和定量鉴定了1 372个蛋白质。通过GO功能注释和KEGG通路富集分析,发现河流漫游球菌大部分蛋白质主要参与维持细菌生存的转录翻译、代谢以及物质的生物合成等生物过程。
通过质谱鉴定到河流漫游球菌表达蛋白质中丰度最高的主要为酶和核糖体蛋白,核糖体蛋白主要参与转运生物学过程,而酶主要参与葡萄糖代谢过程和糖酵解过程。糖酵解过程(Glycolytic process)是生物代谢的重要部分,是细菌分解葡萄糖的几种途径之一,通常与细菌的厌氧或者发酵代谢相关,是细菌获得自身生长、代谢所需能量的重要方式。最近有研究发现参与糖酵解过程的很多酶类定位于链球菌或其它细菌表面并且与细菌毒力相关,如猪链球菌表面的α-烯醇化酶能够结合并活化人的血纤溶酶原,有助于细菌在感染宿主过程中穿越组织屏障,进而在宿主体内扩散[23];α-烯醇化酶还可以作为革兰氏阳性病原体的毒力因子,如金黄色葡萄球菌和链球菌[24];以及作为纤溶酶原和细胞外基质蛋白、层黏连蛋白来调节细菌黏附和侵袭作用[25]。而磷酸甘油酸激酶存在于肺炎链球菌及无乳链球菌表面,能与宿主纤维蛋白溶酶原结合,在细菌黏附中发挥重要作[26-27]。
本研究产出的流漫游球菌蛋白质组数据集中鉴定到糖酵解过程中多个关键酶,包括烯醇化酶(Enolase)和磷酸甘油酸激酶(Phosphoglycerate kinase),以及果糖1,6-二磷酸醛缩酶(Fructose 1,6 bisphosphate aldolase,FDA)、三聚磷酸异构酶(Triosephosphate isomerase)、葡萄糖-6-磷酸异构酶(Glucose-6-phosphate isomerase)、2,3-双磷酸甘油酸依赖性磷酸甘油酸变位酶(2,3-bisphosphoglycerate-dependent phosphoglycerate mutase)乳酸脱氢酶(L-lactate dehydrogenase)、葡萄糖激酶(Glucokinase)和苹果酸脱氢酶(Malate dehydrogenase,NAD)。虽然目前河流漫游球菌致病极为罕见,但有研究报道如果临床不及时给与抗感染治疗或治疗不合理,可引发血流感染,重者可危及生命[10];国内至今尚无任何河流漫游球菌感染及致病机理方面研究,本研究首次通过蛋白质组技术鉴定到河流漫游球菌表达了大量已知革兰氏阳性菌(如金黄色葡萄球菌)致病及毒力因子相关的蛋白质,其中,烯醇化酶和磷酸甘油酸激酶表达丰度极高,在所有鉴定蛋白质中排名第4和第6,这提示我们以后的研究工作可以从糖酵解生物学过程入手,特别关注烯醇化酶和磷酸甘油酸激酶这两个酶,进一步阐释河流漫游球菌的致病机制。
利益冲突:无

