参麦注射液对恶性肿瘤化疗患者微循环及白细胞水平的影响
郝晶 孙岸弢 赵伟 杜福泉 高明洁
摘要 目的:探討参麦注射液对恶性肿瘤化疗患者微循环及白细胞水平的影响。方法:选取2016年2月至2017年1月黑龙江中医药大学附属第一医院收治的恶性肿瘤患者61例作为研究对象,按照随机数字表法随机分为对照组(n=30)和观察组(n=31)。对照组接受常规化疗,观察组在对照组基础上给予参麦注射液进行治疗。检测2组化疗前后全血T淋巴细胞亚群、血液流变学、微循环状态及白细胞水平,统计2组化疗后缓解率。结果:化疗4个周期后,对照组全血CD3+、CD4+、NK及观察组CD8+较化疗前降低,且观察组全血CD8+低于对照组(P<0.01);观察组全血CD3+、CD4+、NK及CD4+/CD8+较化疗前升高,且观察组高于对照组(P<0.01);2组全血血浆黏度、血沉、纤维蛋白原、红细胞压积及形态、管周状态、流态、综合积分较化疗前降低,且观察组低于对照组(P<0.01)。化疗1~4周期后,对照组全血白细胞计数较化疗前逐渐降低,观察组较化疗前先降低后升高,且化疗4个周期后观察组高于对照组(P<0.01)。化疗4个周期后,观察组ORR高于对照组(64.52% vs 33.33%,P<0.05)。结论:参麦注射液可改善恶性肿瘤化疗患者微循环状态,并能抑制化疗所致的白细胞减少。
关键词 恶性肿瘤;化学疗法;参麦注射液;微循环;免疫;血液流变学;白细胞水平
Abstract Objective:To explore the effects of Shenmai Injection on microcirculation and leukocyte levels of patients with malignant tumor receiving chemotherapy. Methods:A total of 61 patients with malignant tumor admitted to First Affiliated Hospital, Heilongjiang University of Chinese Medicine were selected as the research objects and were randomly divided into a control group (n=30) and an observation group (n=31) according to random number table method. The control group received conventional chemotherapy, and the observation group was treated with Shenmai Injection on the basis of the control group. The whole blood T-lymphocyte subsets, hemorheology, microcirculation status and leukocyte levels in 2 groups of patients were detected before and after chemotherapy, and the remission rate in 2 groups were statistically analyzed after chemotherapy. Results:The whole blood CD3+, CD4+ and NK proportion in control group and CD8+ proportion in observation group after 4 cycles of chemotherapy were lower than those before chemotherapy (P<0.01), the whole blood CD8+ proportion in observation group was lower than that in control group (P<0.01); the whole blood CD3+, CD4+, NK proportion and CD4+/CD8+ in observation group were higher than those before chemotherapy, and observation group were higher than control group (P<0.01); the whole blood plasma viscosity, erythrocyte sedimentation rate, fibrinogen, hematocrit and morphology, peritubular state, fluid state, and comprehensive integral in the 2 groups were lower than those before chemotherapy, and the observation group were lower than the control group (P<0.01). After 1~4 cycles of chemotherapy, the total white blood cell count of the control group gradually decreased compared with that before chemotherapy, and the observation group first decreased and then increased. The observation group was lower than before chemotherapy and then increased, and the observation group was higher than the control group after 4 cycles of chemotherapy (P<0.01). After 4 cycles of chemotherapy, the ORR of the observation group was higher than that of the control group (64.52% vs 33.33%, P<0.05). Conclusion:Shenmai Injection could improve microcirculation status of patients with malignant tumor receiving chemotherapy, and inhibit the reduction of leukocyte caused by chemotherapy.
Keywords Malignant tumor; Chemotherapy; Shenmai Injection; Microcirculation; Immune; Hemorheology; Leukocyte levels
中图分类号:R273文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.21.017
恶性肿瘤患者普遍存在血液高黏、高凝、白细胞减少等情况,是威胁人类健康的重要疾病之一[1]。临床治疗方法主要有手术、放化疗,其中化疗是恶性肿瘤的重要治疗方法,能够延长患者生存时间,但化疗过程中易产生多种并发症,常见的有骨髓抑制、心脏毒性等,其延长了化疗周期,对患者的生活质量及身体健康带来严重危害[2-3]。参麦注射液能够促进白细胞生成,抑制肿瘤生长,调节患者免疫功能,是一种能增强抗癌疗效,并减少化疗毒性的药物[4-5]。因此本研究旨在探讨恶性肿瘤患者在化疗过程中使用参麦注射液的疗效,以观察其对患者微循环及白细胞水平的影响。
1 资料与方法
1.1 一般资料 选取2016年2月至2017年1月于黑龙江中医药大学附属第一医院就诊的恶性肿瘤患者61例作为研究对象,按照随机数字表法随机分为对照组(n=30)和观察组(n=31),对照组男18例,女12例;年龄36~76岁,平均年龄(53.64±6.04)岁;按国际抗癌联盟(UICC)肿瘤分期标准:Ⅲ期13例,Ⅳ期17例;其中淋巴瘤8例,多发性骨髓瘤6例,急性白血病5例,骨髓增生异常综合征-RAEB 11例。观察组男20例,女11例;年龄40~78岁,平均年龄(54.28±6.25)岁;肿瘤分期:Ⅲ期15例,Ⅳ期16例;其中淋巴瘤5例,多发性骨髓瘤8例,急性白血病4例,骨髓增生异常综合征-RAEB 14例。2组患者基线比较,差异无统计学意义(P>0.05),具有可比性。本研究经本院医学伦理委员会审批后(伦理审批号:HL201756)。
1.2 诊断标准 西医符合《中国常见恶性肿瘤诊治规范》[6]中关于恶性肿瘤的相关诊断标准;中医符合《中药新药临床研究指导原则(试行)》[7]中的气虚血瘀、气阴两虚等型。
1.3 纳入标准 临床分期为Ⅲ~Ⅳ期者;Karnofsky评分在60分以上者;预计生存期大于6个月者;经病理学或细胞学诊断为淋巴瘤、多发性骨髓瘤、急性白血病、骨髓增生异常综合征-RAEB者;自愿参与本研究,且患者与家属均对本研究知情并同意者。
1.4 排除标准 肿瘤诊治经过记录不清,资料不完整者;肝肾功能不全者;服用其他中药,影响评价结果者;对本研究所用药物过敏者;妊娠或哺乳期妇女;合并心脑血管、造血系统等原发性疾病者等。
1.5 脱落与剔除标准 正在参加其他药物临床实验者;治疗过程中病情骤然加重,或有严重不良反应及并发症者;治疗后失访者等。
1.6 治疗方法 2组均接受常规化疗:霍奇金淋巴瘤:ABVD方案,多柔比星(汕头经济特区明治医药有限公司,国药准字H44024477)25 mg/m2,博萊霉素(日本化药株式会社,进口药品注册证号:20090885)10 mg/m2,长春碱(Maybe Pharma Pty Ltd,进口药品注册证号:H20050134)6 mg/m2,达卡巴嗪(上海瀚香生物科技有限公司,国药准字H20044281)375 mg/m2,第1~15天;非霍奇金淋巴瘤:RCHOP方案,利妥昔单抗(上海罗氏制药有限公司,国药准字J20170034)375 mg/m2,环磷酰胺(江苏盛迪医药有限公司,国药准字H32020856)750 mg/m2,多柔比星(汕头经济特区明治医药有限公司,国药准字H44024477)50 mg/m2,长春新碱(广东岭南制药有限公司,国药准字H20065057)1.4 mg/m2,第1天,泼尼松(天津力生制药股份有限公司,国药准字H12020123)100 mg/m2,第1~5天;多发性骨髓瘤:PAD方案,硼替佐米(齐鲁制药有限公司,国药准字H20183102)1.3 mg/m2,第1、4、8天,多柔比星(汕头经济特区明治医药有限公司,国药准字H44024477)9 mg/m2,第1~4天,地塞米松(广东白云山天心制药股份有限公司,国药准字H44022090)30 mg/m2,第1~4天;急性髓系白血病:诱导化疗DA方案:阿糖胞苷(辉瑞制药有限公司,进口药品注册证号:H20160230)100 mg/m2,第1~7天,柔红霉素(深圳万乐药业有限公司,国药准字H44024361)45 mg/m2,第1~3天;骨髓增生异常综合征-RAEB:地西他滨方案(江苏豪森药业集团有限公司,国药准字H20130067)25 mg/m2,第1~5天。观察组在常规化疗基础上静脉滴注参麦注射液(正大青春宝药业有限公司,国药准字Z33020021)50 mL+5% 500 mL葡萄糖溶液,1次/d,21 d为1个周期,治疗4个周期。
1.7 观察指标 1)分别于化疗前、化疗4个周期后,采集2组静脉血4 mL,1部分取全血,另1部分经抗凝处理后,3 500 r/min,离心半径为13.50 cm,离心10 min取血浆,于-70 ℃保存备用。采用Beckman Couhere流式细胞仪检测2组全血CD3+、CD4+、CD8+及NK细胞比例,并计算CD4+/CD8+。2)采用黏度计(北京普利生有限公司)检测2组血浆纤维蛋白原水平、血浆红细胞压积、血浆黏度及血沉水平。3)采用WXH-7型微循环检测分析系统,在18~25 ℃下对患者的左手无名指甲襞进行检测,观察血管形态、流态、管周等状态,应用田氏加权积分法评价各项积分及综合总分。4)采用Mindray BC-1800型全自动快速血球分析仪检测2组全血白细胞计数。5)统计2组化疗4个周期后临床总缓解率(ORR)。
1.8 疗效判定标准 评价疗效参照WHO实体瘤疗效标准[8],其中完全缓解(CR)为所有靶病灶消失,且≥1个月未复发;部分缓解(PR)为靶病灶最长经之和与基线状态比较减少≥50%,且复发时间≥1个月;疾病稳定(SD)为靶病灶最长经之和与基线状态比较减少<50%,或≥25%,且无新病灶出现;疾病发展(PD)为靶病灶最长经之和与基线状态比较≥50%,或出现新病灶。
1.9 统计学方法 采用SPSS 21.0统计软件进行数据分析,计数资料以百分比(%)表示,采用χ2检验;计量资料以(±s)表示,采用t检验,计量资料多组间比较采用F检验,以P<0.05为差异有统计学意义。
2 结果
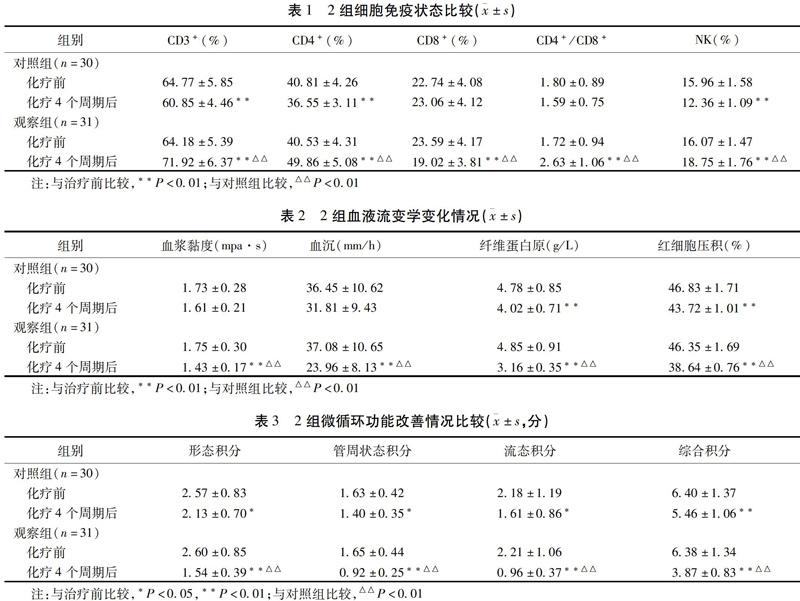
2.1 2组细胞免疫状态比较 化疗4个周期后,对照组全血CD3+、CD4+、NK比例及观察组CD8+比例较化疗前降低(P<0.01),且观察组全血CD8+比例低于对照组(P<0.01);化療4个周期后,观察组全血CD3+、CD4+、NK比例及CD4+/CD8+较化疗前升高(P<0.01),且观察组高于对照组(P<0.01)。见表1。
2.2 2组血液流变学变化情况 化疗4个周期后,2组全血血浆黏度、血沉、纤维蛋白原水平及红细胞压积较化疗前均降低,且观察组低于对照组(P<0.01)。见表2。
2.3 2组微循环功能改善情况比较 化疗4个周期后,2组形态积分、管周状态积分、流态积分、综合积分较化疗前降低(P<0.01),且观察组低于对照组(P<0.01),见表3。
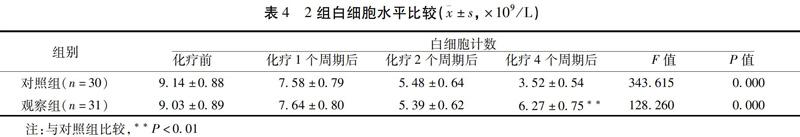
2.4 2组白细胞水平比较 化疗1~4周期后,对照组全血白细胞计数较化疗前逐渐降低(P<0.01),观察组较化疗前先降低后升高(P<0.01),且化疗4个周期后,观察组高于对照组(P<0.01)。见表4。
2.5 2组临床疗效比较 化疗4个周期后观察组CR 7例,PR 13例,SD 7例,PD 4例,ORR为64.52%(20/31);对照组CR 2例,PR 9例,SD 13例,PD 7例,ORR为33.33%(10/30),观察组高于对照组(χ2=4.749,P=0.029)。
3 讨论
致癌因子的积累、免疫力下降等多种因素均会引起恶性肿瘤产生,多数恶性肿瘤确诊时已是晚期,其血液存在高凝、高黏等状态,血液流变学也会存在异常,使患者失去手术机会[9]。通过化疗可改善恶性肿瘤患者的临床症状,延长其生存时间,但化疗药物不仅对肿瘤细胞有抑制、杀灭的作用,还会影响人体的正常细胞,使化疗过程中出现贫血、白细胞减少、血小板减少等不良反应,进而损害机体的免疫功能,导致大多数患者不能耐受化疗而影响治疗效果,严重威胁患者的生命安全[10]。因此急需找到既可延长患者生存期,又能减轻化疗不良反应的药物及方法。
中医学认为正气不足为肿瘤形成的关键因素,《黄帝内经》曰:“邪之所凑,其气必虚,正气存内,邪不可干”,认为肿瘤的形成与正气不足有关;《医宗必读》:“积之成也,正气不足,而后邪气距之”,认为正气虚弱,外邪入侵而致气血瘀滞,邪浊交结,最终发展为肿瘤。“正气”是机体的抵抗力,“邪气”即为肿瘤细胞,因此治疗中应遵循“扶正为根本,祛邪为目的”的原则[11]。中医可通过调理脏腑、补气益血等方法祛除邪气,增强机体免疫功能,进而控制肿瘤的复发,在改善患者生命质量、延长生存时间等方面有着重要意义[12]。参麦注射液是以《症因脉治》中的生脉饮为基础,由相同剂量的红参和麦冬提纯后混合而制成,其中补气常用药红参有补脾益肺、生津安神、益气摄血、补元气等功效;补阴常用药麦冬有清心除烦、养阴润肺、益胃生津等功效,二者共奏养阴生津、益血安神、运脾化湿之功效。现代药理研究表明,参麦注射的有效成为人参、麦冬皂甙及微量多糖,能够使巨噬细胞炎性反应递质胺释放量降低,减轻对机体的损伤,增强机体体液免疫及细胞免疫应答,提高患者的抗肿瘤能力;此外,参麦注射液能刺激造血器官生成白细胞、血红蛋白,预防化疗所致骨髓抑制及白细胞减少[13-14]。本研究结果显示,化疗4个周期后,观察组全血CD3+、CD4+、NK、CD4+/CD8+比例均高于对照组,而全血CD8+比例低于对照组;化疗1~4周期后,对照组全血白细胞计数较化疗前逐渐降低,观察组较化疗前先降低后升高,且化疗4个周期后观察组显著高于对照组,提示参麦注射液可提高恶性肿瘤化疗患者的免疫功能,抑制化疗所致的白细胞减少。
有研究称,恶性肿瘤患者伴有高黏滞血症及血液流变学异常,高黏度血液有利于癌细胞着床,促进癌细胞生长和转移,还可以导致微循环障碍,使血液流速缓慢,黏附于血管壁上极易形成癌栓;肿瘤细胞促进血小板在其表面聚集、变形,导致肿瘤细胞表面被掩盖而不易被杀死[15]。因此治疗恶性肿瘤的过程需要改善患者微循环状态、降低血液黏度。现代药理研究表明,人参多糖可抑制肿瘤细胞进入分裂期,抑制肿瘤的生长,人参皂苷可通过增加内皮活性物质释放,抑制细胞黏附分子及细胞因子表达,进而增加血流量,降低血液黏稠度;麦冬多糖可明显降低血液高切黏度、低切黏度、血浆黏度,改善血液流变学,麦冬皂苷可强心利尿、扩张血管,降低血液黏稠度,改善微循环,增加血液流动性[16]。本研究结果显示,化疗4个周期后,观察组血浆黏度、血沉、纤维蛋白原水平、红细胞压积及形态、管周状态、流态、综合积分均低于对照组,而ORR明显高于对照组,提示参麦注射液可改善恶性肿瘤化疗患者微循环状态,降低血液黏稠度,提高化疗效果。
综上所述,参麦注射液可改善恶性肿瘤化疗患者微循环状态,降低血液黏稠度,提高其免疫功能,抑制化疗所致的白细胞减少,提高化疗效果,值得临床推广应用。

