利用BD FACSAria Ⅲ二次分选法纯化低比例细胞群体的流式细胞技术
首都医科大学医学中心实验室 (北京 100069)
内容提要:目的:利用BD FACSAria Ⅲ流式细胞仪,通过两次分选获得高纯度的GFP阳性HEK293T细胞。方法:GFP-px458空载质粒转染的293T细胞,通过流式细胞仪yield结合purity模式对细胞进行两次分选,比较二次分选后阳性细胞的纯化率与细胞分别经yield 和purity单次分选的差异并对分选后细胞进行7-AAD染色鉴定分选后细胞的活性。结论:使用BD FACSAria Ⅲ型流式细胞仪的yield加purity模式可将低表达量3.1±1.0%且分群不明显的GFP+293T纯化至96.5±1.1%,且活性良好,是一种可靠的获取高纯度目的细胞的方法。
免疫磁珠法和流式细胞分选法是目前纯化活细胞最常用的两种技术,其中,流式细胞分选技术因其高通量,多参数多荧光,且能实现四路同时分选而有更为广泛的应用[1]。快速获取足够数量的高纯度活细胞是目前对分选实验的基本要求。BD FACSAria Ⅲ是目前实验室应用比较广泛的流式细胞仪,该仪器特点是操作简便,能够利用Accurdrop beads快速准确调节分液滴延迟,且存在sweet spot分选液流监控系统保证液流断点稳定。目前,利用流式细胞仪分选独立群体CD4,CD8阳性细胞效果优于免疫磁珠分选,分选后细胞回测,目的细胞能达到90%以上,但对于分选低表达,目的细胞阳性率在0%~5%,且阳性细胞荧光分布弥散的样品,往往存在纯化率不高,分选时间过长,从而导致细胞活性差等问题[2,3]。FACSAria Ⅲ根据收集原理不同设置有purity(纯化)、4 way purity(四路纯化)、yield(富集)和single cell(单细胞)四种分选模式可选,可根据实验要求选择分选模式从而得到不同纯度的细胞。本文以携带GFP报告基因的PX458空载质粒转染HEK293T细胞为例,利用流式细胞仪上yield分选模式与purity分选模式相结合,缩短分选时间,提高目的细胞分选阳性率,获得纯度及数量更高的目的细胞。
1.材料与方法
1.1 实验材料及主要试剂
携带GFP报告基因的PX458空载质粒转染HEK293T细胞,由首都医科大学基础医学院提供,Accudrop beads,CST beads购自BD公司,7-AAD试剂购自Biolegend公司,分选使用仪器为BD FACSAria Ⅲ,美国BD公司产品,分选用鞘液为PBS缓冲液,配制后以0.22μm滤膜过滤并高压灭菌,冷却后使用。
1.2 方法
1.2.1 流式细胞仪分选前液流参数的调节
打开FACSDiva软件并运行开机程序,安装85μm喷嘴打开分选液流Stream,参数的调节主要涉及主液流液滴断点的调节和液滴延迟的调节。首先根据仪器说明书指导,使用85μm喷嘴时液滴频率Freq设定为47,上下调节液滴振幅Ampl以确定适合的Gap值,输入能够让液滴断点稳定的Drop1值和Gap值,而后选中主液流框的sweet spot键,仪器会自动确定液滴频率使液流稳定。上样CST质控微球运行CST程序以检测仪器光路状态稳定,待液流光路均为稳定状态后调节分选液滴延迟。上样Accudrop beads微球,调节上样速度为800~2000evt/s,打开分选电压和滤光片图标(Optical Filter),选中Auto Delay键,系统自动调节液滴延迟数值,使得微球在initial或fine tune模式下都达到侧液流偏转以99%以上。
1.2.2 流式细胞分选
GFP+的HEK293T:以未转染的HEK293T细胞为对照设门确定GFP+细胞的位置;调节上样速度4500~5500evt/s,将细胞分成3份,分别采取yield模式,purity的模式,yield分选后将细胞离心去除部分PBS上清并重悬,细胞再次purity模式分选。
1.2.3 分选效率检测以及分选后细胞活力检测
3种模式最终分选后的GFP+HEK293T细胞各自分成2份,一份再次上机进行分选后纯度检测,另外一份离心后去上清PBS重悬至体积300μL后加入1μL 7AAD上流式细胞仪检测分选后细胞死活情况。
1.3 统计学分析
2.结果
2.1 流式细胞仪液流断点及液滴延迟
使用85μm喷嘴进行分选,频率设定为47,第一滴液流断点位置Drop1为275,Gap为8,此时开启“sweet spot”自动分选模式,振幅自动调节在24.6的位置(图1),上样Accudrop beads后调节Drop Delay值为29.17,此时在initial和fine tune两种模式下侧液流偏转均可达99%以上(图2),液流开启0.5h以上无晃动,无断点位置改变,说明稳定性良好,各种参数符合分选条件。
2.2 GFP+HEK293T细胞分选模式与纯度
分选前GFP+细胞百分比为3.1±1.0%,将细胞分为三组分别采用yield,purity,yield分选后再次purity模式进行分选,分选后细胞进行回测,GFP+细胞得率依次为yield+purity模式,purity模式,yield模式,阳性率的差异有统计学意义(P<0.5),结果见图3,表1。三种模式分选后所得细胞经7AAD染色,活细胞百分比无显著差异(P>0.5),见图4。
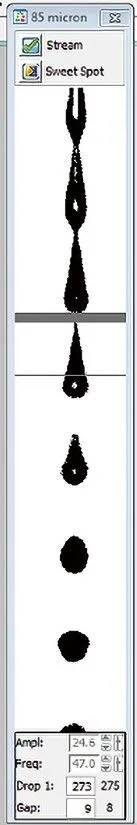
图1.调节后稳定的液流断点状态
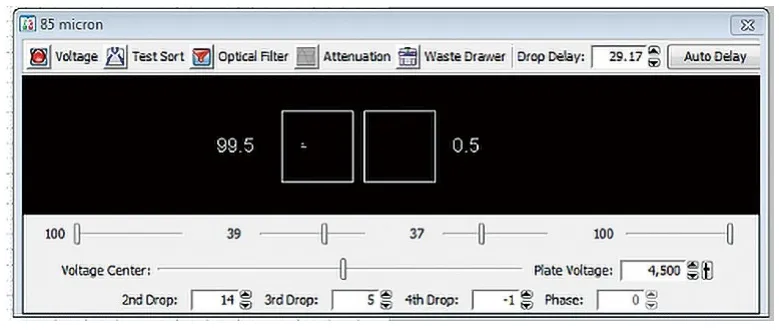
图2.液滴延迟调节结果
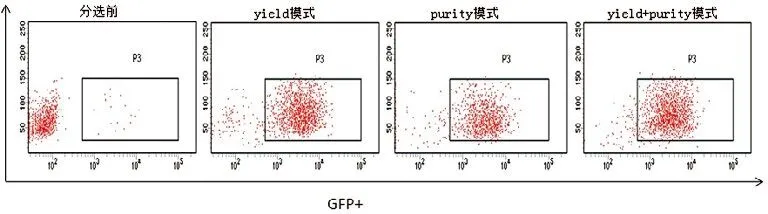
图3.GFP+细胞纯度检测
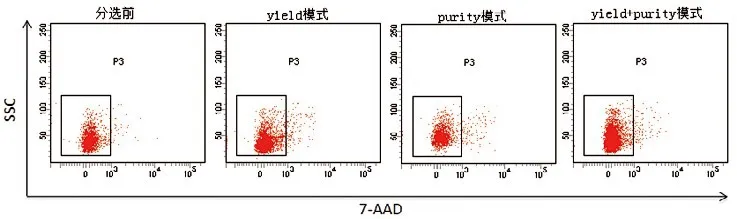
图4.细胞活性检测
表1.不同模式下分选前后GFP阳性率和细胞活性(7-AAD染色)(每组n=3,±s,%)
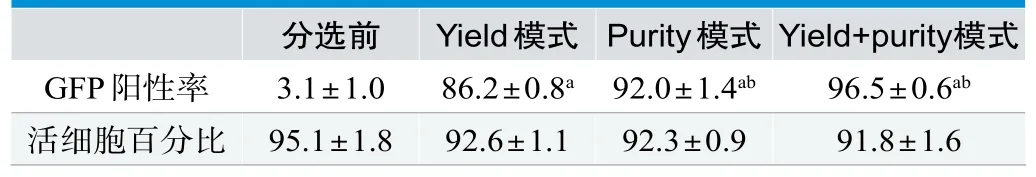
表1.不同模式下分选前后GFP阳性率和细胞活性(7-AAD染色)(每组n=3,±s,%)
注:与分选前比较,aP<0.5,与上一组比较,bP<0.5。
分选前 Yield模式 Purity模式 Yield+purity模式GFP阳性率 3.1±1.0 86.2±0.8a 92.0±1.4ab 96.5±0.6abimages/BZ_25_1252_1593_2267_1645.png
3.讨论
使用流式细胞仪分选,其分选后纯度和活性会受多方面的影响。第一,仪器自身状态:包括液流的稳定性,液滴延迟时间的确定,激光信号的校准[4]。稳定的液流是准确分选首要条件。开启液流窗口的“sweet sopt”自动监控功能按钮有助于维持分选液流稳定状态,当实际Gap值大于设定值±2时即液流稳定性变差时分选会自动停止。液滴延迟是用来设置细胞检测点与断点之间的时间间隔,精确的液滴延迟是通过分选Accudrop Beads的效果校正得到。此外,样品分选前仪器需运行CST程序检测仪器激光强度及变异系数才CV是否在正常范围内[5]。
第二,分选模式的选择。BD FACSAria Ⅲ属于电荷分选型流式细胞仪,细胞通过检测区域后会被高频率的振荡断裂成均匀的小液滴,包裹有目标细胞的液滴会被加相应的电荷,样品上机后,分选模式的选择直接决定着哪部分细胞被看作目的细胞而后加电压打入收集管。BD FACSAria Ⅲ提供了yield,purity,4-way purity,single cell四种分选模式,其中yield模式得率最高,分选速度最快,但纯度欠佳,为了保证纯度往往选择purity模式,四路同时分选式选择4-way purity,single模式一般单克隆细胞分选,此模式得到的细胞为单个阳性细胞,含有两个或多个阳性细胞的液滴被抛弃,因此率最低。本实验采取yield加purity的模式和模式进行二次分选,首先将表达量低的阳性细胞利用yield模式进行富集,在能够保证effiency为100%的情况下采取尽量快的速度上样,这样能够将阳性细胞迅速富集变成优势细胞,使得GFP阳性细胞86.2%±0.8%,收集后的细胞1000转5min稍离心,吸除部分上层PBS后再次利用purity模式分选,调节上样速度,使得effiency在90%左右,最终将所分细胞阳性率纯化至96.5±0.6%。
在细胞分选过程中,缩短分选时间也是需要考虑的问题之一。先富集,再分选,有助于缩短分选时间提高分选阳性率。预富集的方式常用的有如下几种:流式细胞仪的enrich模式,适用于荧光表达量低且细胞能够抗液流压力的样本;免疫磁珠阴选法对于多色标记淋巴细胞富集效果良好[6];对于外周血来源的样本,淋巴细胞分离液结合密度梯度离心法能够对淋巴和单核细胞起到富集作用[7,8]。
由于FACSAria Ⅲ属于液流电压分选型流式细胞仪,因此分选过程中细胞一定会受到仪器液流系统压力的影响,过大的压力会造成细胞破碎或是死亡,分选过程中需根据细胞大小不同选择不同喷嘴,喷嘴过小影响大细胞通过,且细胞承压过大,而喷嘴过大则不能将细胞有效地在喷嘴位置排队成单细胞,从而影响分选精度,本实验采取85μm喷嘴分选GFP+的HEK293T,分选后利用7-AAD染色检测细胞活性,两次分选与分选前无显著性差异,说明目前仪器喷嘴和压力条件适用于该细胞的分选,但是对于不同形态大小的细胞,使用的喷嘴规格尚需要摸索。除此之外,每次细胞分选时会利用仪器检测系统的FSC阈值切除细胞碎片,FSC-A和FSC-H排出黏连细胞,也会主观排除碎片或黏连体,有利于最终分选到的细胞是单一的,状态良好的细胞。
本实验利用FACSAria Ⅲ流式细胞仪的yield结合purtity两种分选模式相结合,对GFP+的HEK293T进行两次分选,使得最终获得的阳性细胞达到了96.5%±0.6%,较单一模式分选法有所提高,分选的时间缩短,且分选后的细胞活性良好,是一种可靠的,获取高纯度阳性细胞的方法。

