“超重力+”法可控制备透明纳米分散体及应用
孙倩,曾晓飞,王丹,,王洁欣,,陈建峰,
(1 北京化工大学,北京市软物质科学与工程高精尖创新中心,有机无机复合材料国家重点实验室,北京100029;2 北京化工大学,教育部超重力工程研究中心,北京100029)
纳米技术是21 世纪国际前沿科技代表性领域之一,可广泛应用于材料、生命科学、电子信息、能源、环保、国防和军事等诸多领域,具有重要的应用价值。纳米技术通常以纳米材料或器件的形式发挥作用,而纳米颗粒是构筑纳米材料与器件的核心基础,具有独特的小尺寸效应、表面效应和量子效应[1],一直以来都是国际研究热点。然而,纳米颗粒的高性能应用至今仍面临一些难题,如纳米颗粒的稳定可控制备(尺寸、形貌、晶型等)、单分散和低成本工程放大等[2-3]。
单分散纳米颗粒材料是近十多年来纳米材料研究过程中发展出的新一代纳米材料,其颗粒小且较均匀、无团聚,分散在溶剂中可形成具有良好透明性或明显丁达尔效应的纳米分散体,较传统的纳米粉体材料更易于分散和应用,从而展现出更优异的光、电、磁、力、声和催化等性能,因而对其制备和应用性能的研究一直是国际前沿研究领域[4-8]。目前,其制备方法主要包括:液-固-液相转移法、有机金属前体热分解法、生物仿生和聚合物模板法、水热反应法和溶胶凝胶法等。这些方法各有优点,但也存在一些缺点,如反应条件苛刻、过程步骤多、成本高等,所得产品存在稳定性差、固含量低、制备过程规模化放大困难等问题,较难满足实际应用的需求。因此,“高固含量、高稳定、高透明”的单分散纳米颗粒分散体及其低成本规模化可控制备仍是一个巨大的国际科技挑战问题,也是纳米科技工程应用的共性前沿问题。
为此,本文作者课题组基于分子化学工程原理,以国际首创的超重力反应结晶法制备无机纳米粉体为基础,引入表面改性分离过程,创新提出超重力反应结晶-改性分离耦合法(“超重力+”法)制备透明纳米分散体的新方法与新技术,实现了纳米颗粒尺寸、形貌、晶型、分散介质极性匹配性等的调控;创建了“超重力+”法可控制备平台,研制出具有“高固含量(质量分数高达60%)、高稳定(可存放一年以上)、高透明(可见光透过率可达90%以上)”优异性能特征的金属、无机和有机三大体系近40 种透明纳米分散体材料,攻克了低成本规模化放大制备工程难题,与企业合作建成多条生产线;创制出高性能透明纳米复合材料和拟均相纳米催化剂,实现了高透明节能纳米复合膜制品的工程应用。
1 “超重力+”法可控制备透明纳米分散体
1.1 制备原理
化学反应过程通常可分为慢反应和快反应两大类型(图1)。研究发现,制备纳微颗粒常采用的液相反应结晶过程,大多数属于快反应过程,其分子本征反应时间tR约为1ms级,极难控;而传统搅拌釜反应器分子混合特征时间tM(5~50ms)>tR。因此,该类反应过程受混合/传质控制。图2 为结晶过程中颗粒形成过程的示意图[9-10]。根据经典的结晶理论,液相反应结晶过程主要分为成核和生长两个阶段,其中,成核是关键。成核速率与浓度差的5~18 次方成正比(成核速率常表达式:J=kΔcm,式中,k 为常数,Δc 为过饱和度,m=5~18),呈强的非线性,成核速率极大地依赖于Δc 的大小及其在空间分子尺度上的分布均匀性,浓度的微变会引起成核速率的剧变,从而导致粒度分布不均、难控及批次间重复性差[9]。为此,需要进行分子混合强化,使tM≤tR,以保证微观分子尺度上全程过饱和浓度分布均匀。而对于纳米颗粒的单分散,一方面需要根据材料体系的特点,进行颗粒表面性质的调控,以实现成核颗粒界面最大可能的低表面能化或最大的空间位阻;另一方面,可能需要在颗粒成核后,迅速实现颗粒的分离,以避免快速生长或团聚。因此,关键需要进行颗粒表面性质的设计和传质过程强化。
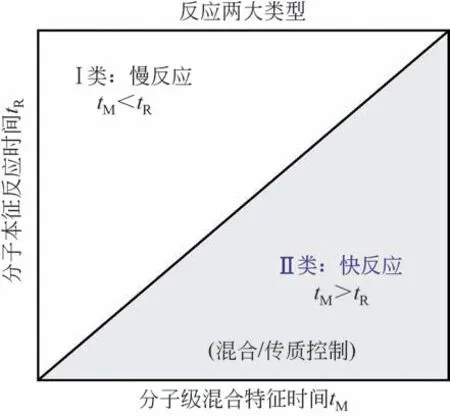
图1 反应两大类型tM与tR的关系

图2 结晶过程中颗粒形成过程[9-10]
近年来,本文作者课题组研究发现,超重力技术作为一种强化分子混合和传质过程的技术手段,可实现液相反应结晶沉淀过程的强化,进而获得尺寸小且分布窄的纳米颗粒。所谓超重力指的是在比地球重力加速度(9.8m/s2)大得多的环境下物质所受到的力。超重力技术通常可通过旋转填充床(rotating packed bed,RPB)产生的离心力来实现。在超重力环境下,不同大小分子间的分子扩散和相间传质过程均比常规重力场下的要快得多,高速旋转的多孔填料产生的巨大剪切力将液体撕裂成微米至纳米级的膜、丝和液滴,从而产生巨大和快速更新的相界面,分子混合和传质过程由此得到极大强化,分子混合特征时间可达到0.1ms甚至更小,小于分子本征反应时间(或成核诱导期时间),颗粒成核生长过程在微观均匀的理想环境中进行,非常适合于制备粒径小且分布窄的纳米颗粒[11-13]。
有鉴于此,本文作者课题组面向终端工程应用需求,基于颗粒表面主动设计和修饰调控表面特性,利用本中心国际首创的超重力强化分子混合结晶过程的方法,有机耦合表面改性分离过程,率先提出了超重力反应结晶-改性分离耦合新方法,即“超重力+”法可控制备透明纳米分散体。目前,“超重力+”法主要分为两种:①超重力反应原位改性分离的“超重力+”一步法;②先超重力反应成核后改性分离的“超重力+”两步法。
1.2 “超重力+”一步法
“超重力+”一步法即超重力反应原位改性分离法,是指在纳米颗粒的制备过程中,将表面活性剂与反应原料同时加入含油和水两种完全不互溶的体系中,在超重力环境中形成微乳液体系,反应成核过程在内核相进行,生成的纳米颗粒迅速被另一相中的表面改性剂包覆,进而实现改性转相,去除内核相后即形成纳米分散体。此方法实现了纳米颗粒制备和改性过程的同时进行。图3是以纳米碳酸钙(CaCO3)分散体为例的“超重力+”一步法制备原理。将Ca(OH)2、微量水和磺酸盐类表面改性剂加入油相介质中,在超重力强化分子混合和传质过程的作用下,形成W/O 的微乳液,同时通入CO2气体。反应在水相中进行,生成的纳米CaCO3颗粒被油相中的表面活性剂包覆,原位萃取转移至油相介质中,再经分离后,形成纳米CaCO3油相分散体[14-16]。
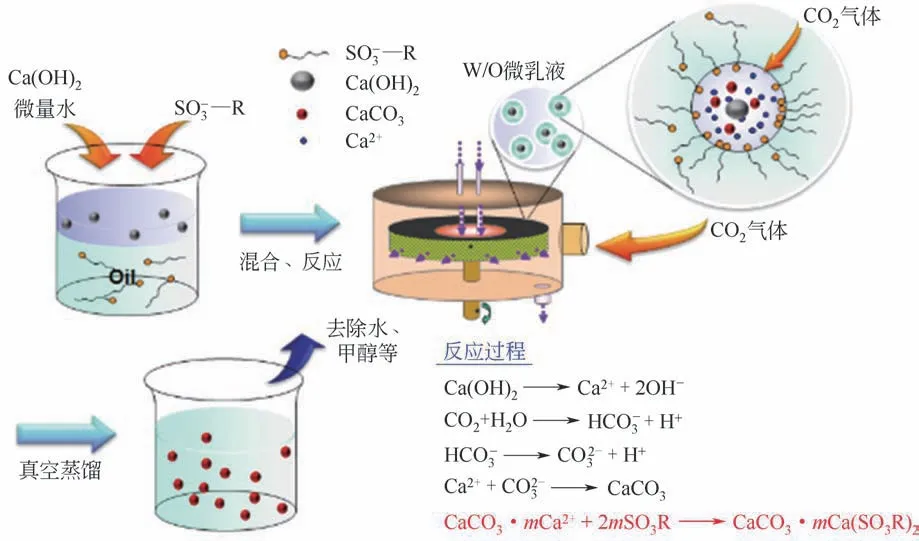
图3 “超重力+”一步法制备纳米分散体原理(以纳米CaCO3分散体为例)[9]
纳米CaCO3油相分散体作为一种油品清洁剂,CaCO3为无定形,颗粒小,可良好分散于油中。碱值是鉴别油品清洁剂性能的关键参数,其高低主要取决于清洁剂中碱性组分的含量。研究发现,通过调变水的添加量、超重力水平、进料流速和比例、反应温度等因素,可调控纳米颗粒成核、生长与分散以及原位改性分离环境,从而实现对透明纳米分散体颗粒尺寸和分布、分散性、固含量等的可控。图4为添加不同水量的分散体TEM图以及水的添加量对产品碱值、钙含量的影响。由图可知,随着水添加量从0增加到3g时,纳米CaCO3的平均粒径明显增加,由6.4nm增至10.3nm,但不添加水时,纳米CaCO3的分散性相对较差,因此,较优的水添加量为1~2g。此外,随着水添加量的增加,分散体的碱值和钙含量先增加后下降;当水量为1.5g 时,碱值最高,可达416mg KOH/g[15]。分散体的TEM图、粒径分布对比以及不同超重力水平对碱值、 钙含量和残渣量的影响。 由图5(a)~(e)可知,水热所得分散体中纳米CaCO3颗粒均为单分散,但超重力水平对CaCO3颗粒的粒径大小和分散性有明显的影响。在较低的超重力水平β=21 时,所制备的纳米CaCO3颗粒平均粒径为10.3nm;随着超重力水平的逐渐增加,CaCO3颗粒的粒径减小,粒径分布也越来越窄;当超重力水平增加到β=134(2500r/min)时,CaCO3平均粒径减小至5.5nm。这主要是由于较高的超重力水平可以增强剪切力,通过填料的流体可以破碎成更细小的液滴,从而极大强化混合和传质过程,形成更加均一的成核和反应环境,有利于生成粒径小和分布窄的颗粒。由图5(c)可知,随着超重力水平的增加,碱值和钙含量也迅速增加。当超重力水平β=76时,碱值和钙含量分别达到401mg KOH/g和15.35%(固含量为38.5%);进一步增加超重力水平,碱值和钙含量变化很小,且略有下降。相应地,残渣量从6.7%减至2.6%,这主要是由于超重力水平引起的混合和传质过程的强化,明显改善了反应效率,特别是碳化反应过程,Ca(OH)2残渣量明显下降,几乎都变成了CaCO3,进而促进了固含量和碱值的增加[16]。

图4 水的添加量对纳米CaCO3的影响[15]

图5 超重力水平对纳米CaCO3的影响[16]
图6 为不同气液比条件下所制得的纳米CaCO3分散体的TEM 图以及不同气液比对碱值、碳化时间和残渣量的影响。由图可知,气液比的变化对颗粒粒径影响不大,但当气液比为0.082 时,所得产品的分散性相对较好;当气液比为0.109 时,分散体有较高的黏度和较差的流动性。此外,随着气液比从0.027提高至0.082,碱值仅有微小的增加,即从398mg KOH/g 提高到405mg KOH/g,此时,碳化时间从138min 迅速缩短至53min,残渣量控制在2.5%的较低水平;进一步增加气液比至0.136,碱值快速降低,残渣量明显增加至6.5%,碳化时间仅微小缩短。这是由于在较高气速下,过量的CO2很难在固定的液速下被消耗,而较高的气速导致气液接触时间缩短,不利于炭化反应[16]。
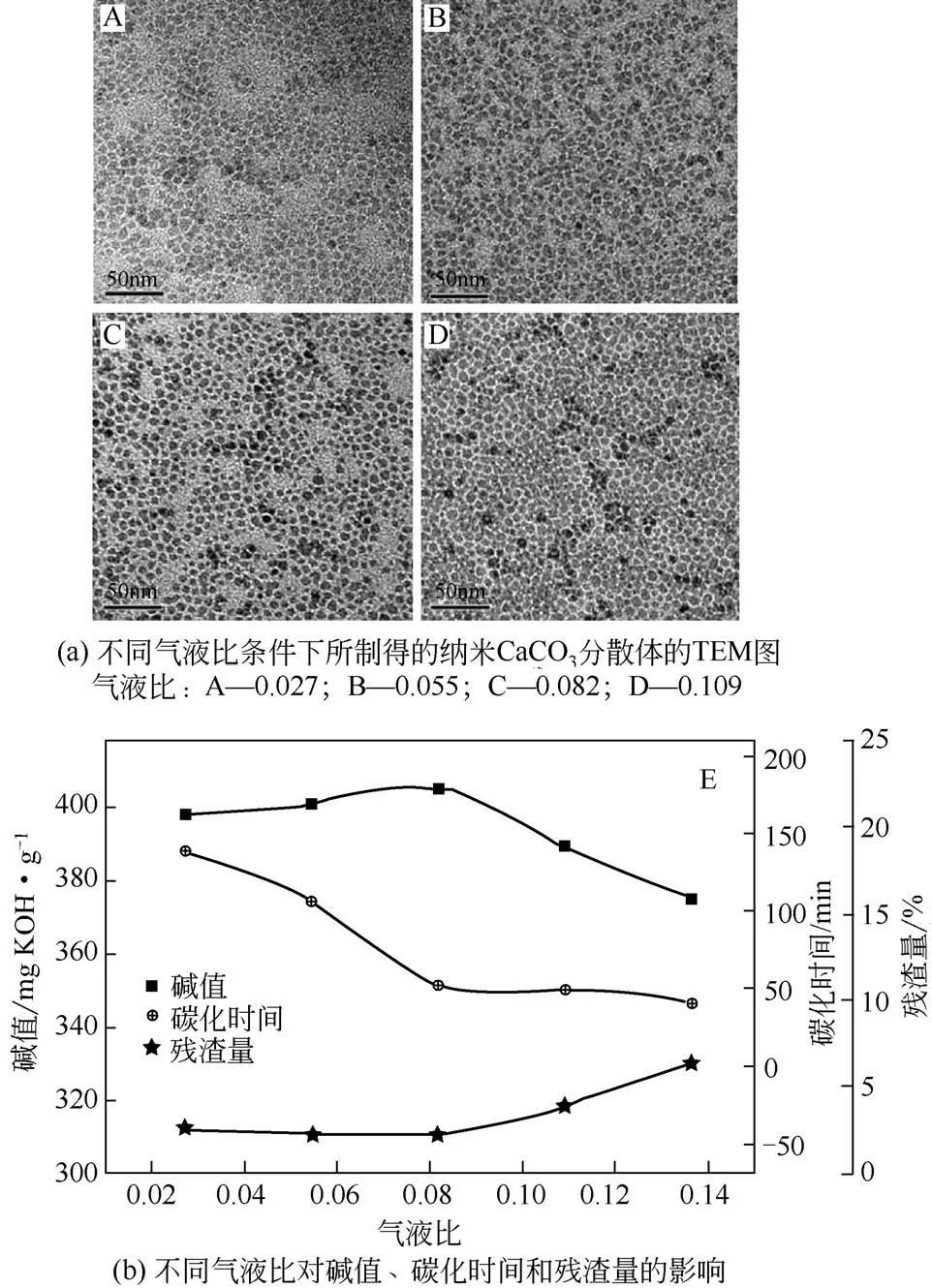
图6 气液比对纳米CaCO3的影响[16]
图7 是采用“超重力+”一步法制备的纳米CaCO3油相分散体产品与传统釜式法产品的TEM图、粒径分布对比。由图可知,超重力法生产的纳米晶体颗粒的平均粒径为5.9nm,粒径分布较窄,而采用传统釜式法合成的纳米CaCO3颗粒平均粒径为9.4nm,粒径分布范围较宽,粒度分布不均匀。此外,“超重力+”反应时间由120min 缩短至53min,生产效率提高了56%[16]。图8 为“超重力+”法和传统釜式法所得的产品实物。由图可知,“超重力+”法所得纳米分散体是均匀透亮的,而传统釜式法所得纳米分散体透明度较差,这进一步说明了传统釜式法制备的纳米颗粒粒径较大,分散性较差,造成了可见光的散射,从而使分散体的透明度变差[16]。
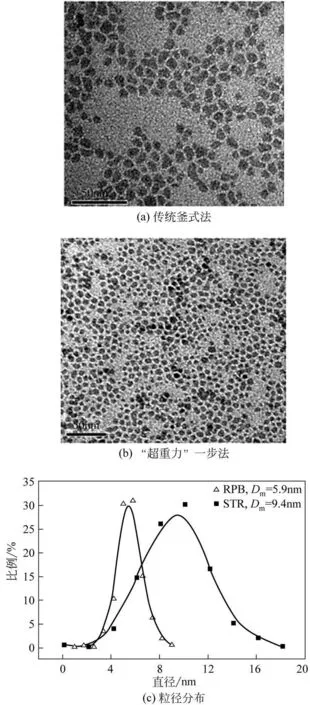
图7 纳米CaCO3油相分散体的TEM图以及粒径分布对比[16]

图8 纳米CaCO3油相分散体的实物
1.3 “超重力+”两步法
“超重力+”两步法即先超重力反应成核后改性分离。其制备过程主要分为两步:首先在超重力环境下快速反应结晶生成纳米颗粒悬浮液;然后将表面改性剂迅速加入到所制备的纳米颗粒悬浮液中,经表面改性后的纳米颗粒再分离转移至另一相,转相至目标介质中即形成纳米分散体。该方法中纳米颗粒的制备过程以及表面改性过程是相继进行的。图9 是以纳米氢氧化镁[Mg(OH)2]分散体为例的“超重力+”两步法制备纳米分散体的原理。将Mg 盐和碱分别溶于液相介质中,迅速通入超重力旋转填充床中,在超重力场中反应成核并生成尺寸均匀且粒径较小的纳米Mg(OH)2颗粒;随后将改性剂添加于所制得的Mg(OH)2纳米颗粒悬浮液中,经表面改性后,将所得纳米颗粒经多次洗涤并去除原液相介质后,再分散于目标溶剂中,即形成纳米Mg(OH)2透明分散体[17-20]。
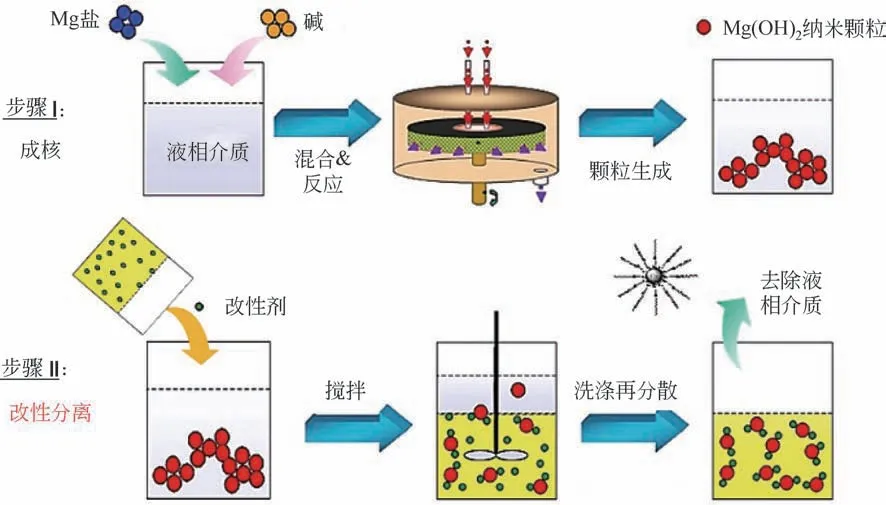
图9 “超重力+”两步法制备纳米分散体原理[以纳米Mg(OH)2分散体为例][9]
Mg(OH)2是一种常见的绿色无机阻燃剂。本文作者课题组采用“超重力+”两步法首次制备了纳米Mg(OH)2透明分散体。图10为不同超重力转速下所得纳米Mg(OH)2分散体的TEM 图以及Mg(OH)2颗粒粒径分布和平均粒径。从图中可以看到,所得纳米Mg(OH)2呈薄片状,当转速为400r/min 时,其粒径范围在60~120nm左右。随着转速从400r/min增加到2400r/min,超重力过程强化作用逐渐变得显著,平均粒径迅速减小,从92nm减小至45nm,粒径分布也明显变窄。图11 为不同进料速率下所得纳米Mg(OH)2分散体的TEM图以及粒径分布和平均粒径。由图可知,逐渐增加进料速率,Mg(OH)2颗粒的平均粒径的数值先减小后增加。当进料速率从100mL/min 提高至400mL/min 时,纳米Mg(OH)2颗粒的粒径分布变窄,平均粒径也从66nm 减小至46nm。这是由于进料速率的增加会加剧反应物料间的碰撞程度,从而极大地增加接触面积,进而强化反应体系的微观混合效果。然而,当进料速率进一步从400mL/min 提高至1000mL/min 时,出现了较大的Mg(OH)2颗粒,平均粒径从46nm 迅速增加到220nm,且粒径分布明显变宽。这可能是由于当进料速率较快时,反应体系的局部过饱和度偏高,晶体成核速度加快,容易发生更多的碰撞而颗粒变大[21]。
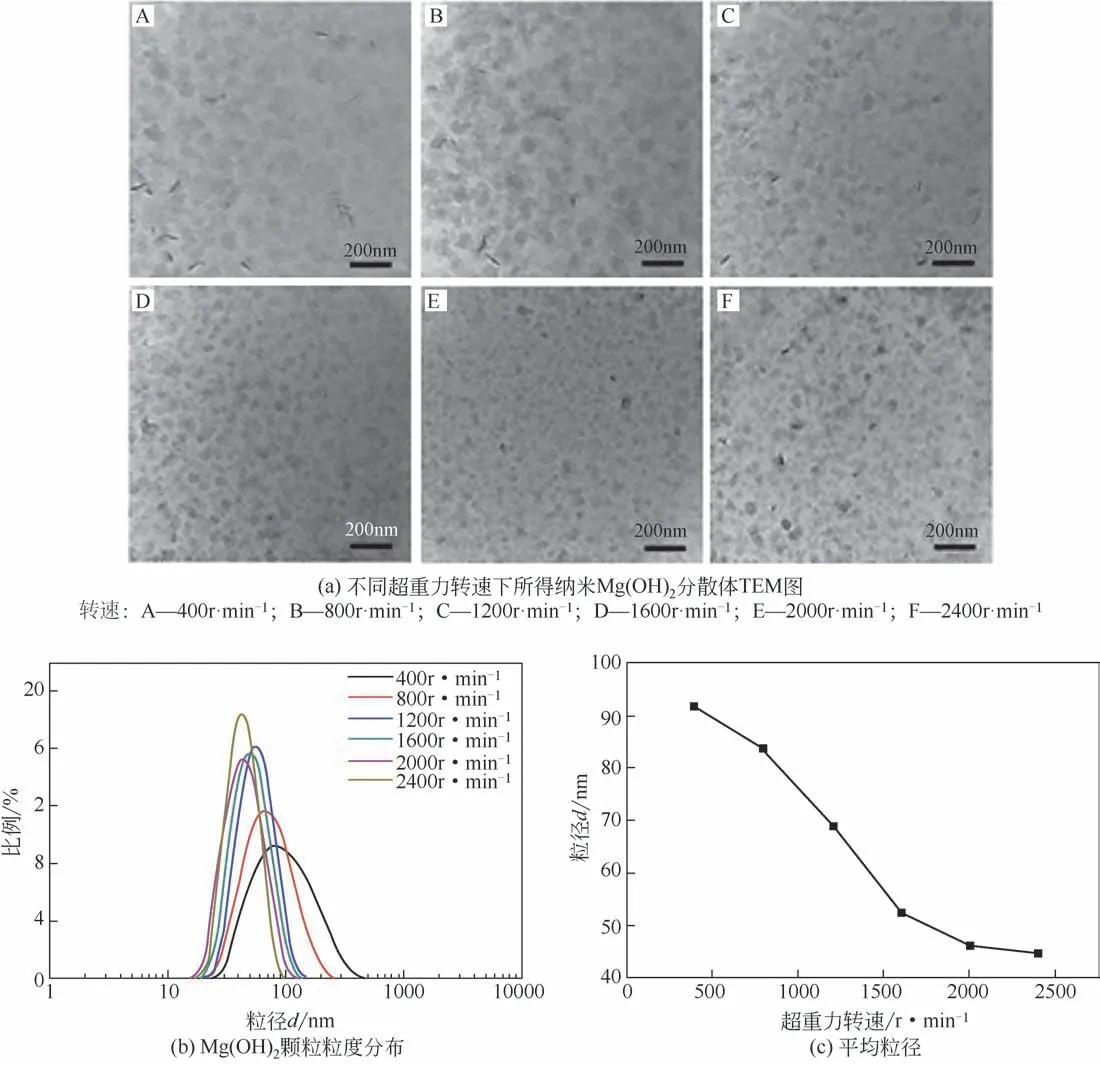
图10 不同超重力转速下所得纳米Mg(OH)2分散体TEM图及粒度分布[21]
图12为采用传统釜式法和“超重力+”法所得纳米Mg(OH)2分散体的TEM图、粒径分布,以及紫外-可见光透过率和实物的对比图。由图可知,采用上述两种方法都可以制得纳米Mg(OH)2透明分散体,且所得纳米分散体中的颗粒具有良好的分散性。其中,采用传统釜式法所制备的纳米Mg(OH)2颗粒,粒径范围为60~100nm,有少量较大颗粒生成;而采用“超重力+”法所制备的纳米Mg(OH)2颗粒分布更均匀,平均粒径更小,粒径范围为40~60nm。由于“超重力+”法制备的颗粒平均粒径更小,分布更窄,同时颗粒的分散性更好,因而所形成的分散体具有更优异的透明性。这也进一步证明了“超重力+”法可显著强化分子混合,有利于制备粒径小且更均匀的纳米颗粒[21]。目前,本文作者课题组已成功制备出醇相、甲苯相和水相等纳米Mg(OH)2透明分散体(图13)[18-20]。
1.4 “超重力+”法可控制备平台
目前,本文作者课题组已利用“超重力+”法,成功研制出系列高固含量(可高达60%,远高于文献报道值)、高稳定(可存放一年以上)、高透明(可见光透过率可达90%以上)以及尺寸、形貌、晶型、分散介质极性匹配性等可控的金属、无机和有机三大体系近40 种透明纳米分散体材料(不同极性分散介质主要包括水、乙醇、苯甲醇、乙酸丁酯、甲苯、环己烷、白油、石油醚等)。图14为“超重力+”法制得的金属、无机和有机三大体系透明纳米分散体实物和TEM 图。图15 为以纳米ZnO为例的不同分散介质和不同固含量的透明分散体的实物。所研制的纳米分散体材料主要包括:金属如Cu、Ag、Pd等,金属氧化物如ZrO2、ZnO、TiO2、ATO、Fe3O4、CeO2、SiO2等,金属氢氧化物如Mg(OH)2、Al(OH)3、MgAl-LDHs等,金属硫化物如CdS、Ag2S等,其他无机化合物如CaCO3、CaF2、BaSO4、HAP、NaYF4等,有机体系如尼罗红、脂质体、维生素A以及水飞蓟宾、伊曲康唑等药物活性组分等,形成了可控制备平台[22-38]。
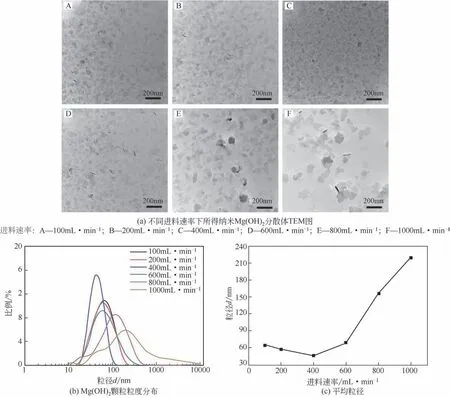
图11 不同进料速率下所得纳米Mg(OH)2分散体TEM图及粒度分布
1.5 “超重力+”法制备透明纳米分散体的工程放大
基于“超重力+”法的技术原理、实验室制备以及超重力反应器放大规律的科学基础等研究,本文作者课题组进一步与企业合作建成了多条“超重力+”法制备纳米分散体或纳米颗粒的规模化生产线,包括:100t/a纳米金属氧化物(ZnO、ATO等)透明分散体中试生产线、100t/a纳米铜油相分散体和1000t/a纳米CaCO3润滑油分散体工业示范线(无机体系)[9]以及5t/a非诺贝特纳米药物颗粒中试装置和5000t/a维生素A纳微颗粒产品工业生产线(有机体系),实现了相应产品的高品质化、生产高效率化和节能降耗低成本化。图16是部分透明纳米分散体工程化示范生产线及其产品。以1000t/a 纳米CaCO3润滑油分散体工业示范线为例,在相同的反应条件和反应投料下,与传统釜式法相比,采用“超重力+”法制备的产品具有明显的优势:产率可增加15%以上;碳酸化反应所需时间从130min降低为60min,生产效率提高50%以上;CO2的利用率提高31%,钙渣量从24.5%降低至8.5%[9]。
2 透明纳米分散体的应用
本文作者课题组利用透明纳米分散体,成功解决了纳米颗粒的分散难题,创制出面向节能隔热、电子信息、生物医用等高性能纳米复合材料以及高效拟均相纳米催化剂,实现了高透明纳米复合节能膜制品的规模化生产和工程应用。
2.1 透明纳米复合材料
光学级有机无机纳米复合材料是对纳米颗粒在有机基体中分散度要求最高的材料,任何由于纳米颗粒团聚而造成的光散射,都会降低材料的透明度。为此,本文作者课题组基于所制备的不同功能的透明纳米分散体,根据透明聚合物体系特点,采用溶液共混、原位聚合和纳米母料等方法,创制出了光、电、阻燃等多种功能透明纳米复合材料,研究并揭示了纳米颗粒尺寸、分散性、组成及固含量与应用性能间的关系。
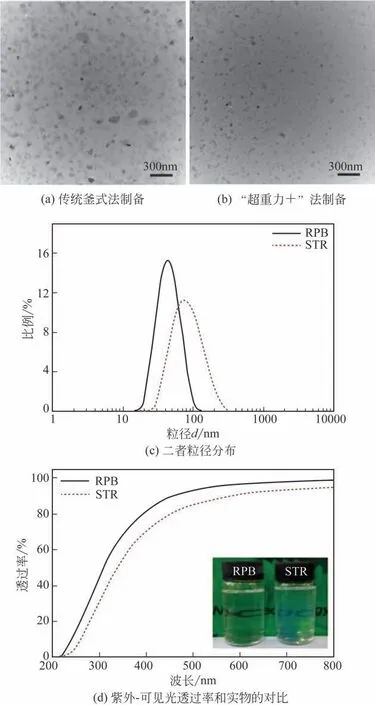
图12 传统方法与“超重力+”的对比[21]

图13 不同分散介质的纳米Mg(OH)2透明分散体的实物[18-20]
2.1.1 高折射率透明纳米复合材料
二氧化锆(ZrO2)具有折射率高、光学性能良好、热膨胀系数低、硬度高以及优异的热稳定性等优点。本文作者课题组基于纳米ZrO2透明水相分散体,采用溶液共混法制备得到了透明PVA/ZrO2纳米复合材料[39-40]。图17为基于纳米ZrO2透明分散体和纳米ZrO2粉体制备的不同添加量的PVA/ZrO2纳米复合薄膜以及基于不同添加量的纳米ZrO2透明分散体所制备的PVA/ZrO2纳米复合膜折射率曲线。由图可知,当无机填料是纳米ZrO2透明分散体时,所得纳米复合薄膜在ZrO2添加量(质量分数)高达80%时仍然高透明;而当无机填料是纳米ZrO2粉体时,填充量在30%时复合薄膜已有明显的雾感,添加量为80%时已变得发白。进一步研究发现,所得复合薄膜折射率与ZrO2体积分数呈线性关系,ZrO2添加量为80%(体积分数44.8%)时,薄膜的可见光透过率仍高于80%,其折射率从1.528 提高至1.754(@589nm)[39]。图18是不同ZrO2添加量和相应PVA/ZrO2纳米复合薄膜接触角的关系。由图可知,PVA/ZrO2纳米复合薄膜的疏水性随着ZrO2添加量先增加后略有下降,即接触角从不添加的17°,提高至50%添加量的98.1°,然后又下降至70%添加量的72°[40]。
利用类似的研究思路,进一步制备得到了ZrO2/环氧树脂透明纳米复合材料;与商品化封装胶制备的封装器件相比,基于ZrO2/环氧树脂纳米复合封装材料的器件,其出光率可提升超10%,在LED照明器件封装领域具有重要的应用前景(图19)[25]。此外,采用“超重力+”法原位制备的高折射率ZrO2/有机硅纳米复合封装胶材料,在可见光透过率不低于95%时,折射率可达1.65,该光功能纳米复合材料用于LED照明器件封装(图20),与国外道康宁商品胶(折射率<1.6)封装器件相比,光通量可提升136%,蓝光比例由3.1%降至1.8%,色温4573K,符合LED健康照明器件封装需求[41]。
2.1.2 抗紫外/红外透明纳米复合材料
氧化锌(ZnO)是一种稳定的两性氧化物,具有优异的紫外线屏蔽、抗菌等性能,应用范围十分广泛。为了解决纳米ZnO的加入引起高分子材料可能的降解,本文作者课题组首先基于纳米ZnO分散体,在纳米ZnO表面包覆薄层SiO2,并接枝改性制得稳定的纳米ZnO透明分散体;进一步结合其他具有屏蔽近红外功能的纳米颗粒,采用溶液共混法制得ZnO/PLA、ZnO/掺铯氧化钨(CsxWO3)/PLA 和ZnO/乙基纤维素(EC)等多种抗紫外/红外透明纳米复合薄膜[27,42-43]。当ZnO含量为5phr[phr表示对每100 份(以质量计)聚合物中添加Mg(OH)2的份数]时,所得PLA/ZnO 透明复合膜材料即可屏蔽近100%的紫外线,从而实现了良好的抗老化性能;当添加量高达60phr 时,复合材料仍能保持和纯PLA 一样的可见光透过率。而PLA/ZnO/CsxWO3薄膜除具有优异的透明性和紫外屏蔽性能外,还可以阻挡90%的近红外线。隔热测试结果表明,在一侧相同的光照下,相同时间内,经纯PLA 贴合的玻璃另一侧温升为10.2℃,而PLA/ZnO/CsxWO3纳米复合薄膜贴合的玻璃另一侧温升仅为2.3℃,表现出显著的隔热性能[27]。此外,本文作者课题组还采用原位聚合法制得了ZnO/碳纳米管(MWCNTs)/聚甲基丙烯酸丁酯(PBMA)薄膜,其不仅具有良好的透光性和紫外线屏蔽性能,且复合材料的机械性能(拉伸强度和断裂伸长)也得到了明显的改善[44](图21)。

图14 “超重力+”法制得的金属、无机和有机三大体系透明纳米分散体的TEM图和实物[22,24,26,29,31,35,37]

图15 不同分散介质和不同固含量的纳米ZnO透明分散体实物[27]

图16 部分透明纳米分散体工程化示范生产线及其产品[9]
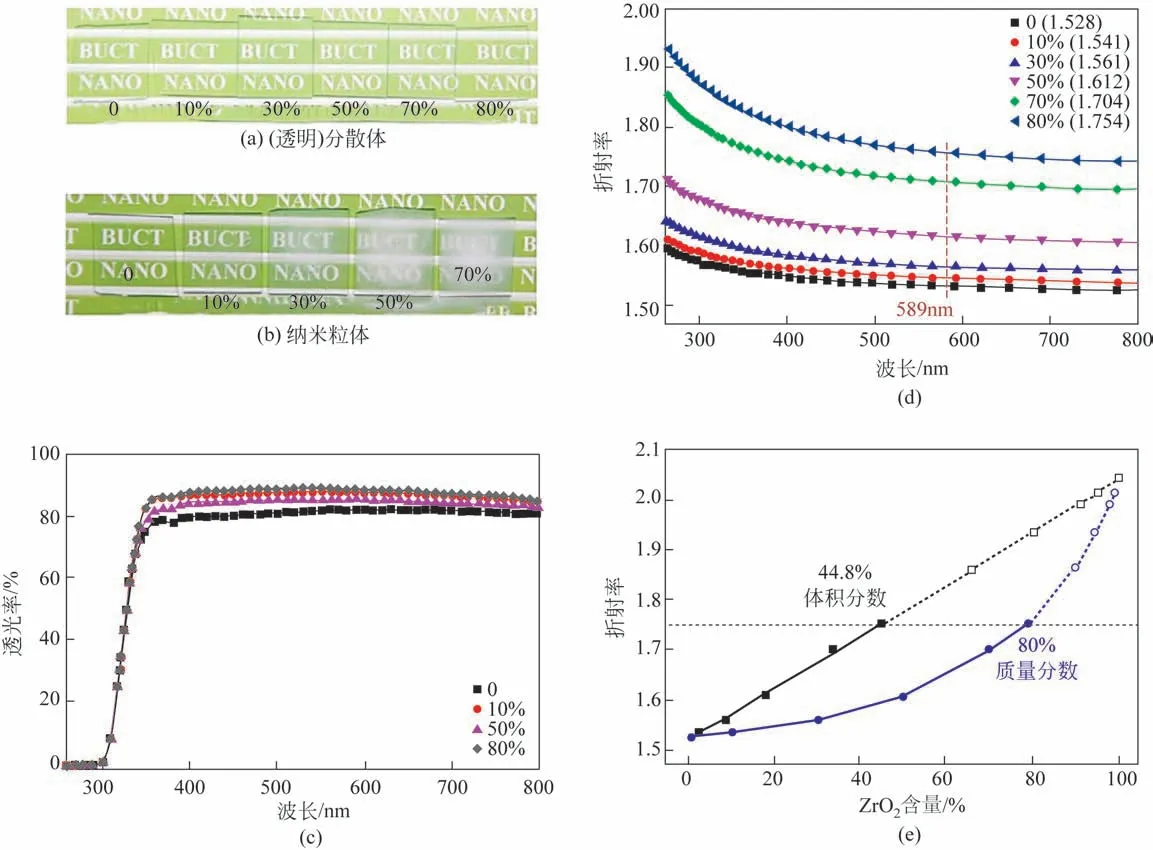
图17 基于纳米ZrO2透明分散体和纳米ZrO2粉体制备的含有不同添加量(质量分数)的PVA/ZrO2纳米复合薄膜以及基于不同添加量的纳米ZrO2透明分散体所制备的PVA/ZrO2纳米复合膜折射率曲线[39]

图18 不同ZrO2添加量(质量分数)和相应PVA/ZrO2纳米复合薄膜接触角的关系[40]
基于上述研究,本文作者课题组进一步与企业合作建立了一条产能为5×106m2/a 的透明复合节能膜规模化生产线。图22 是所得高透明纳米复合节能膜制品的实物照片及其贴膜玻璃辐照前后的UV-Vis-NIR 透过率曲线。从图中可以看出,所研制的制品具有良好的可见光透过性(550nm处可见光透过率达83%)、优异的阻隔紫外线(可完全阻隔350nm以下的紫外线)和近红外线的性能以及良好的抗光老化性能。在辐照500h 后,该产品的光学性能没有发生明显变化,且产品本身没有发生褪色、变色、脱落及产生气泡等现象。该产品贴于建筑玻璃上,经测试(地点为安徽)发现,夏季使用空调用电可节约30%以上,这可望为我国的建筑节能领域提供一种重要的新材料[9]。目前,该产品已在国内几十个商业建筑中实现了工程示范应用。
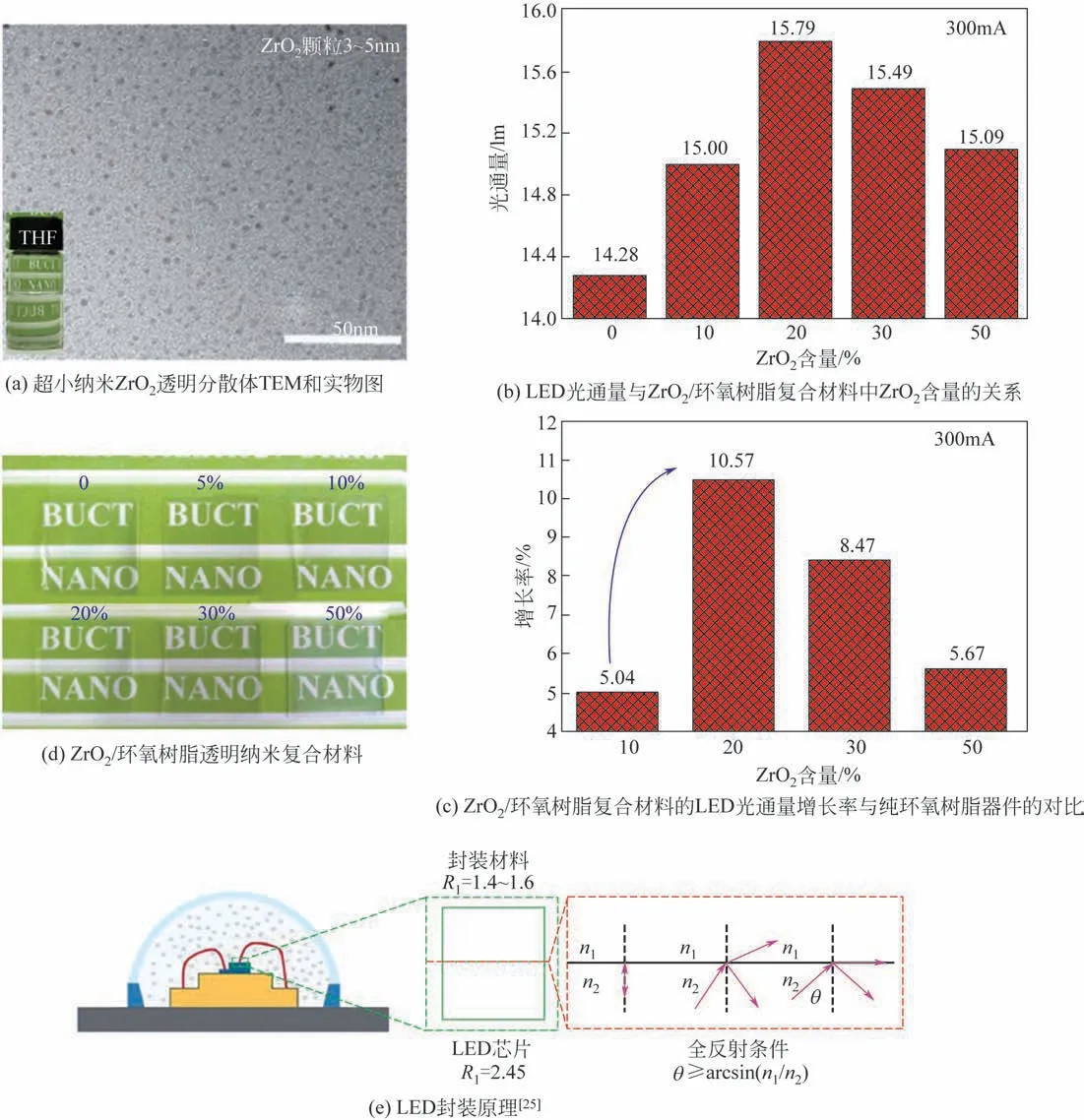
图19 ZrO2/环氧树脂材料的形貌及性能[25]
2.1.3 导电透明纳米复合材料
银(Ag)纳米颗粒具有独特的与尺寸效应相关的表面等离子体共振效应,且具有高导电性和导热性,被广泛应用于催化、抗菌、喷墨打印、成像和传感等方面。本文作者课题组基于所制得的纳米Ag颗粒和纳米Ag线,成功制备出导电透明纳米复合材料。图23是基于所制备的纳米Ag颗粒和纳米Ag 线而得到的导电透明纳米复合材料的实物和电镜照片以及导电性能图。由图可知,基于纳米Ag颗粒所得的透明复合薄膜具有良好的透光性和导电性,当可见光透过率为91%时,其方块电阻为98.1Ω/sq;当可见光透过率为85%时,其方块电阻为12.7Ω/sq[22]。而采用纳米Ag线制备的柔性透明导电电极具有优异的柔韧性和光电性能,在可见光透过率为90%时,其方块电阻仅为9.6Ω/sq[23]。
2.1.4 阻燃透明纳米复合材料
Mg(OH)2具有抑烟、受热分解时释放水、吸收大量的潜热且不产生有毒气体等优点,因而被认为是一种绿色的无机阻燃剂。由于纳米Mg(OH)2颗粒具有较大的表面能,因此易发生团聚,若将其粉体直接作为阻燃剂添加于聚合物基体中,难以发挥出纳米阻燃剂的优势,限制了其应用。基于“超重力+”法制得的可分散于不同液相介质的Mg(OH)2透明分散体,本文作者课题组进一步采用原位聚合法、溶液共混法和熔融挤出等方法,制得了系列具有良好透明性、阻燃性和机械性能的Mg(OH)2/聚合物透明纳米复合材料。图24 为纯聚合物PP、纳米Mg(OH)2分散体/PP 和纳米Mg(OH)2粉体/PP 复合材料的实物照片,以及相应样品的极限氧指数(LOI)和机械性能对比。由图可知,纯PP 和纳米Mg(OH)2分散体/PP 样品的透明性较好,而纳米Mg(OH)2粉体/PP样品的透明性明显较差,其原因主要是由于纳米粉体在聚合物复合材料的加工过程中难以达到均匀的分散,存在一定的团聚颗粒,而透明分散体中纳米Mg(OH)2颗粒在PP中分散性良好,没有团聚的白色大块颗粒,能保持基体原有的良好透明性,因此也具有更优异的阻燃性能(极限氧指数)和力学性能(拉伸强度和冲击强度)。类似地,纳米Mg(OH)2分散体还可用于制备高性能透明PVA 纳米复合材料。图25 为纳米Mg(OH)2分散体/PVA和纳米Mg(OH)2粉体/PVA复合材料的实物照片和相应样品氧指数试验后的SEM 图,以及它们的极限氧指数结果对比。由图可知,基于纳米分散体所制备的纳米Mg(OH)2/PVA复合薄膜材料的透明性、其中的颗粒分散性以及阻燃性能,均明显优于采用粉体制备的纳米Mg(OH)2/PVA复合材料。尤其当纳米Mg(OH)2添加量达50phr时,纳米Mg(OH)2/PVA复合材料的可见光透过率仍可高达85%以上;此外,由于纳米Mg(OH)2颗粒的加入,所得复合材料具有优异的阻燃性能,极限氧指数由最初的19.5 增加至28.2,提高约45%,阻燃效果显著[21]。
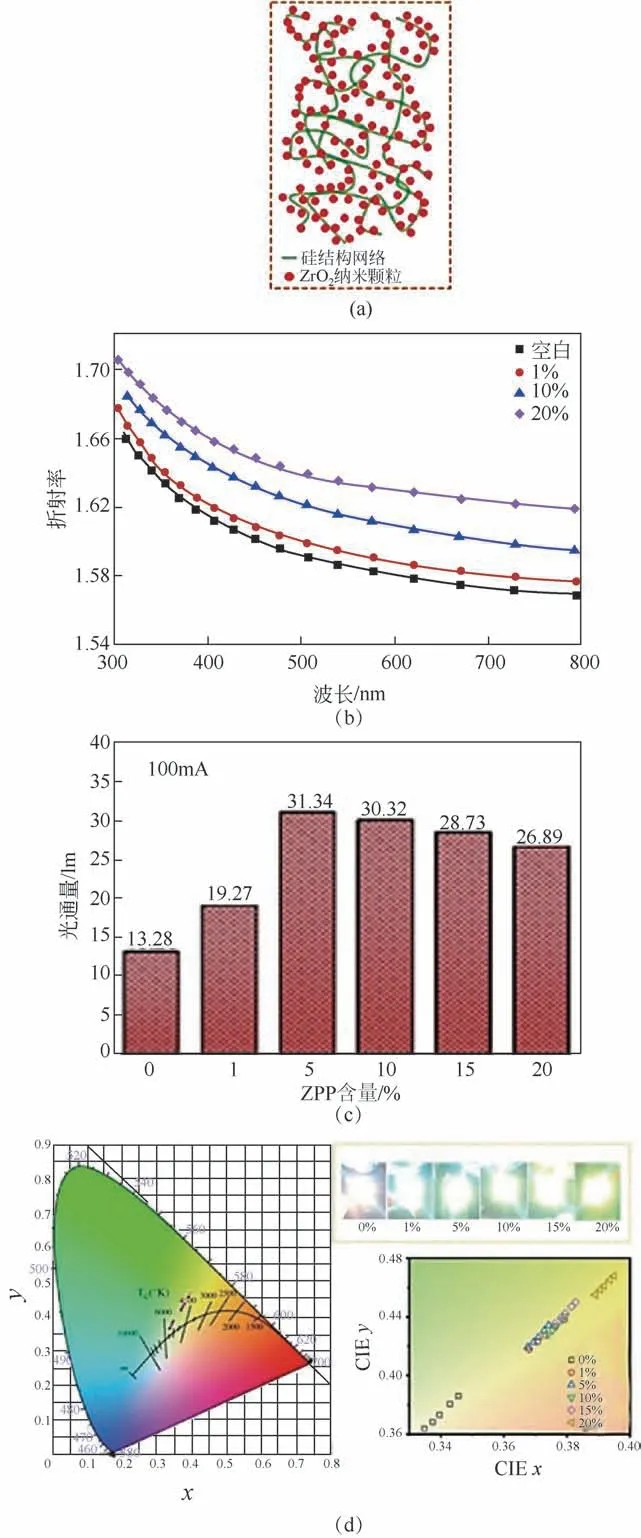
图20 “超重力+”法原位制备的ZrO2/有机硅纳米复合封装胶材料及封装器件表征[41]
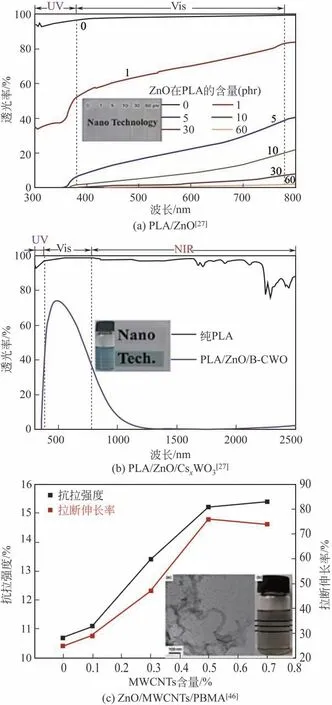
图21 基于纳米ZnO分散体的不同类型透明纳米复合材料
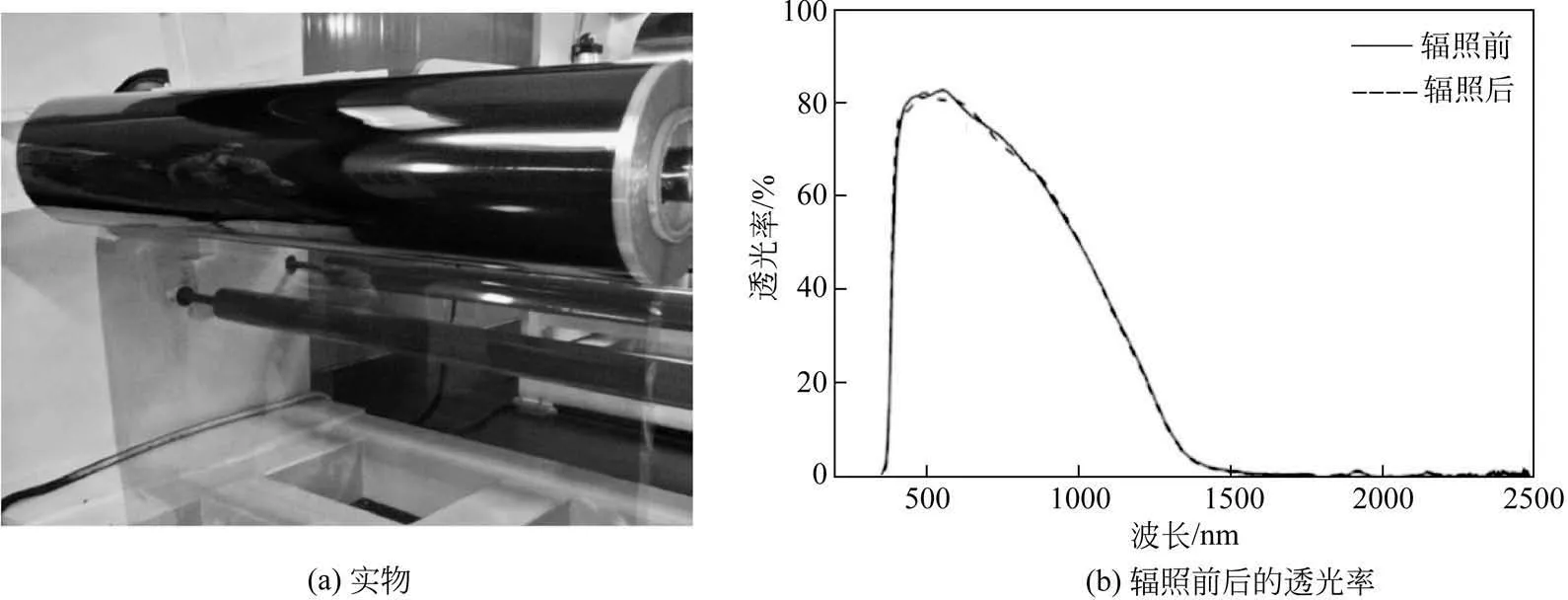
图22 透明纳米复合节能膜制品实物照片和纳米复合节能贴膜玻璃辐照前后UV-Vis-NIR透过率曲线[9]
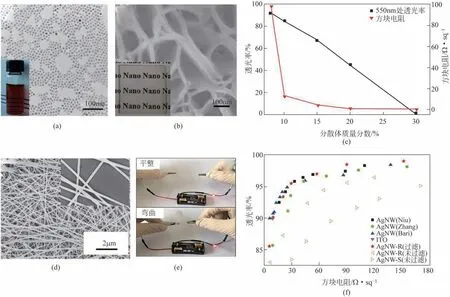
图23 纳米Ag分散体(a)和透明复合薄膜的电镜和实物(b),透明复合薄膜在550nm的透过率和电阻与分散体浓度的关系(c),Ag纳米线电镜和实物(d),基于纳米Ag线的柔性透明导电膜的LED灯电路实物(e)以及文献报道的基于纳米Ag线的复合材料的透过率和电阻的关系(f)[22-23]
2.2 拟均相纳米催化剂
拟均相纳米催化剂是指纳米粒子均匀分散在溶剂中形成拟均相体系,并用于催化反应过程。它结合了均相和多相催化的优点,其近似于均相体系,有利于反应物和催化剂之间的充分接触,减少了传质扩散问题,从而提高催化活性。为此,本文作者课题组采用所制备的纳米分散体作为拟均相纳米催化剂,利用其颗粒小、分散性好且稳定分散于反应介质中以及无内扩散等特点,充分发挥拟均相纳米催化效应。
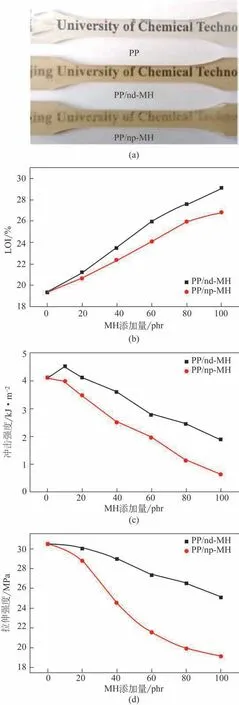
图24 纯PP、纳米Mg(OH)2分散体(np-MH)/PP和纳米Mg(OH)2粉体(nd-MH)/PP复合材料实物(a),极限氧指数(b)和机械性能对比(c、d)[21]
2.2.1 Pd体系
将所制备的2.6~10.1nm 的单分散纳米钯(Pd)水相分散体作为拟均相纳米催化剂应用于硝基苯还原。硝基苯还原是一种重要的催化反应过程,其产物苯胺被广泛用于制造精细化学品的原料或中间体。图26为纳米Pd分散体的TEM图,不同粒径的Pd 纳米颗粒和不同循环使用次数的催化反应还原速率,以及相关模拟计算结果。研究发现,纳米Pd 分散体具有良好的催化活性,尺寸效应明显,超小的2.6nm Pd 纳米颗粒的催化反应速率是10.1nm的5倍,且5次循环后仍具有良好的催化活性。此外,基于DFT 理论计算吸附行为,结合Langmuir-Hinshelwood模型,计算得到的kapp与实验值比较,偏差小于10%,吻合良好。而且,所研制的拟均相纳米催化剂催化活性较文献报道的非均相催化剂的最高活性可提高30%以上,反应时间可缩短一半以上[24]。
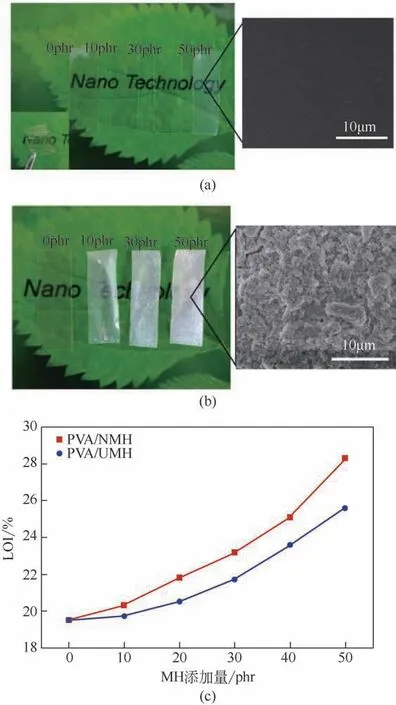
图25 纳米Mg(OH)2分散体/PVA(a),纳米Mg(OH)2粉体/PVA复合材料实物和相应样品氧指数试验后的SEM(b)以及二者氧指数测试结果的对比(c)[20]
2.2.2 ZnO体系
ZnO除具有紫外线屏蔽和抗菌等功能外,还可作为催化剂使用。聚对苯二甲酸乙二醇酯(PET)的化学解聚和循环利用,既环保又符合可持续发展理念,具有重要的实际应用价值和研究意义。本文作者课题组首次以纳米ZnO 甲醇和乙二醇相分散体作为PET 醇解的拟均相纳米催化剂。在所采用的分散体中,纳米ZnO 的平均粒径约为4nm,可稳定分散6 个月以上。主要探究了PET 甲醇降解的过程中,PET 转化率和对苯二甲酸二甲酯(DMT)回收率的相关影响因素。图27为纳米ZnO分散体的TEM 和实物,以及相关催化性能表征结果。从图中可知,制备的甲醇相ZnO 纳米分散体对PET 的降解有较高的催化活性,明显优于纳米ZnO 粉体。研究发现,较高的反应温度(170℃)更有利于PET 的转化和增加DMT 产率。反应仅15min 后,PET 转化率可达97%,DMT 产率可达95%。该催化剂最高活性为553g PET/(g ZnO·h)。在同样的反应温度下,相比于PET 的糖解(Glycolysis),醇解(Methanolysis)过程具有更短的反应时间(1/4)和更高的活性(4.7 倍)。重复使用5 次后,催化剂仍有较高的活性,且仍可保持较好的分散性[45]。可见,此拟均相纳米催化剂具有高效、可重复使用等优点,在PET 醇解方面有良好的应用前景。
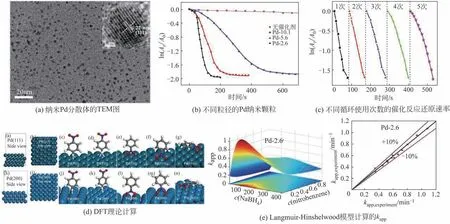
图26 Pd分散体的图片及催化性能[24]
2.2.3 ZrO2体系
ZrO2也可被作为催化剂用于光催化降解污水中的有机污染物。由于ZrO2具有耐酸耐碱以及化学惰性等特点,因而相比于ZnO、TiO2等常用光催化剂,其具有独特的优势。本文作者课题组基于纳米ZrO2水相分散体的制备工艺,通过引入Cl-或/和Na+,制备得到了方形和星形两种形貌的纳米ZrO2团簇体水相分散体,团簇体是由7nm的纳米ZrO2颗粒定向聚集而成,具有介孔结构,其平均孔径为12.4nm,团簇体粒径可在74~170nm内可调控。图28 为纳米ZrO2团簇体的示意图和TEM 图,不同结构纳米ZrO2颗粒与商业化P25催化剂的光催化降解染料罗丹明B(RhB)的效率比较以及不同循环使用次数的ZrO2催化剂降解率。从图中可知,所制备的纳米ZrO2团簇体分散体对RhB 的光催化降解性能优异,性能排序为:星形纳米ZrO2团簇体>P25>方形纳米ZrO2团簇体>纳米ZrO2颗粒,其中,星形纳米ZrO2团簇体的光催化性能是P25的1.98倍。重复使用5 次后,催化剂仍可保持初始的催化高活性。此外,除了能光催化降解罗丹明B 外,纳米ZrO2团簇体还对甲基紫、刚果红也有很好的光催化降解效果[46]。因此,此催化剂由于独特的结构,表现出了高效、易回收、可重复使用等优点,未来可用于多种染料废水的降解。
除了上述应用外,本文作者课题组还开展了基于单分散纳米SiO2及其纳微结构聚集体的高性能齿科修复复合树脂[28,47-48],基于纳米尼罗红的透明荧光防伪材料[35],基于掺杂的纳米Gd2O3、NaYF4等上转化法光材料的透明荧光薄膜和光动力治疗[32-34,49],以及基于单分散Ag@SiO2核壳纳米颗粒的抗菌及海洋防腐[50-52]等应用研究。
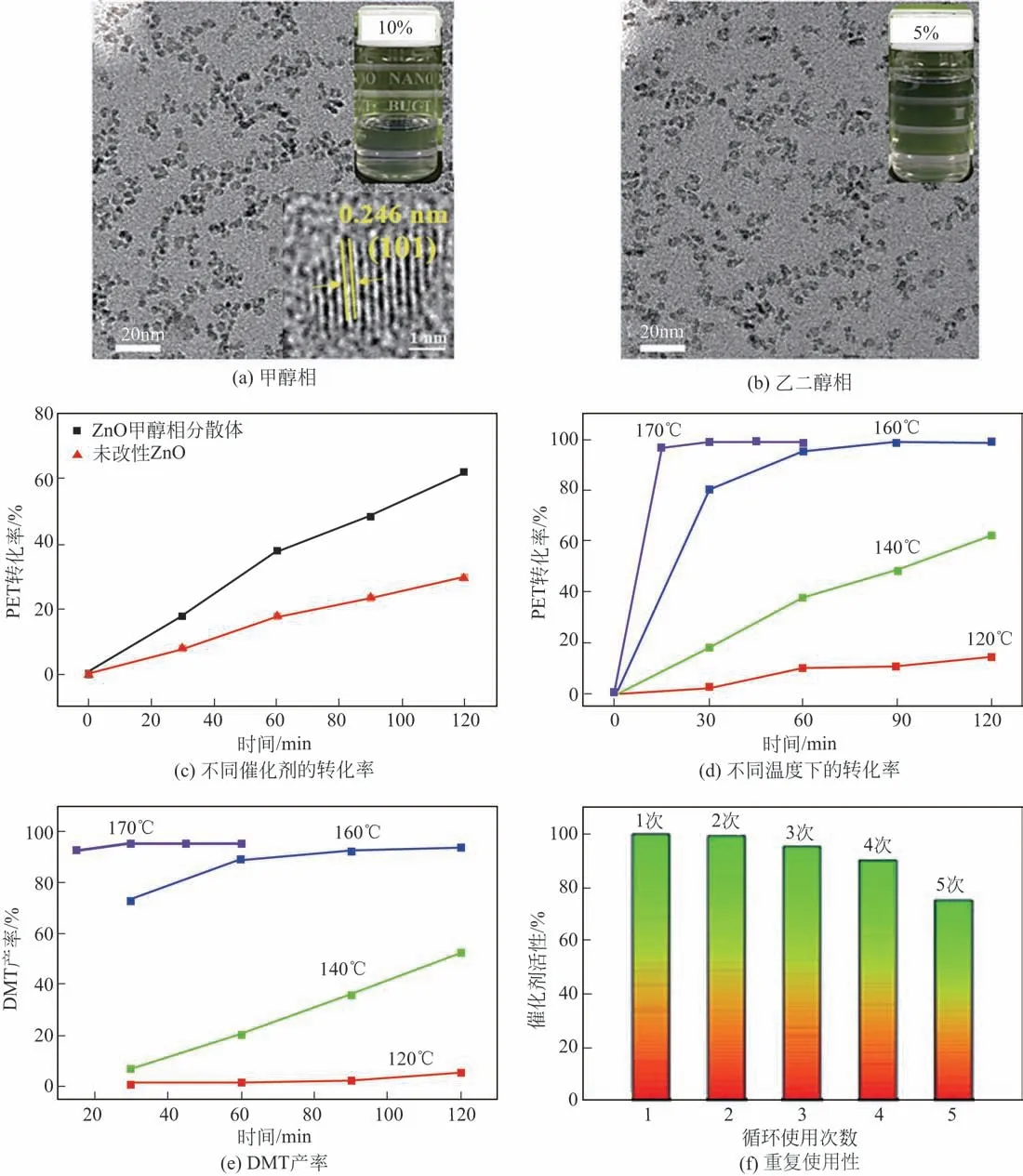
图27 纳米ZnO分散体的形貌及性能[45]
3 结语
本文作者课题组面向光电信息、生物医药、节能环保等战略产业需求,提出基于颗粒表面主动设计与修饰调控表面特性,利用超重力强化分子混合结晶过程的方法,有机耦合表面改性分离过程,首创“超重力+”法(超重力反应结晶-改性分离耦合法)制备透明纳米分散体的新技术,研制出高固含量、高稳定、高透明的金属、无机和有机三大体系近40 种透明纳米分散体材料,形成了“超重力+”法可控制备技术平台;进一步攻克了低成本规模化放大制备工程难题,与企业合作建成了多条“超重力+”法生产线;基于纳米分散体,研制出高性能透明纳米复合材料、拟均相纳米催化剂等,实现了高透明节能复合膜制品的规模化生产和工程应用。
未来,在纳米分散体的制备方面,“超重力+”法可控制备技术将进一步拓展其对象体系,即从金属、无机和有机等单一体系推广到有机-无机(金属)和无机(金属)-无机(金属)等复合体系的制备,从而获得更多高质量的功能纳米复合材料;而在纳米分散体的应用方面,纳米分散体可望在石油化工、精细化工、航空航天、能源环境,以及柔性可穿戴器件等应用领域发挥更大的作用。
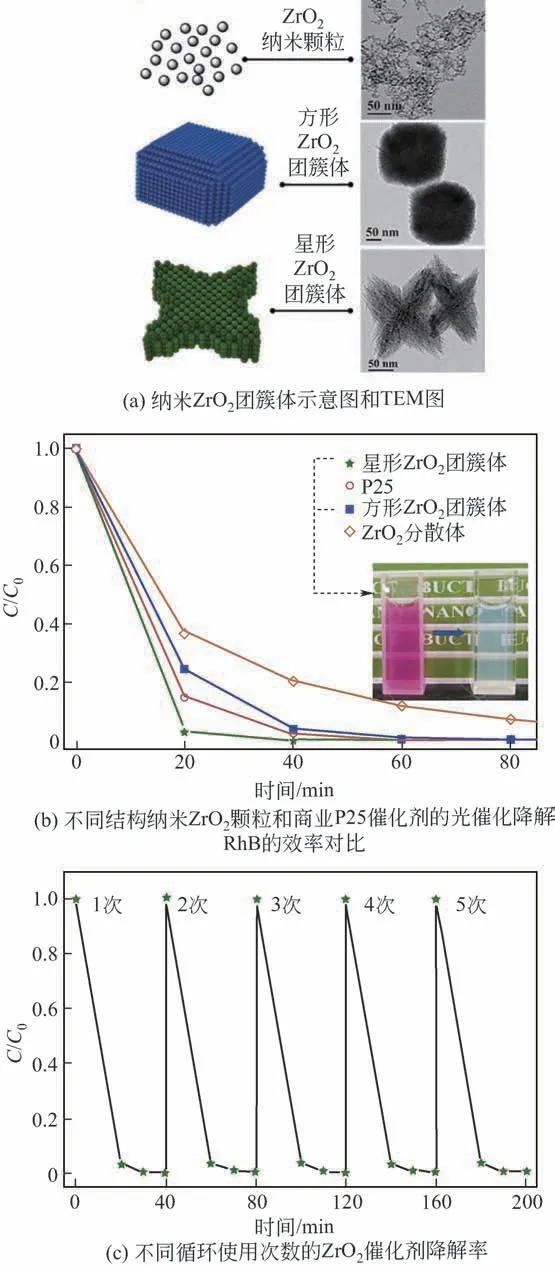
图28 ZnO2体系的形貌及催化性能[46]

