煤与生物质中高温共热解特性研究
金康华,章 康,季银飞,吕洪坤,韩高岩,刘颖祖
(1.浙能绍兴滨海热电有限责任公司,浙江 绍兴 312073;2.国网浙江省电力有限公司电力科学研究院,浙江 杭州 310014;3.浙江大学能源清洁利用国家重点实验室,浙江 杭州 310027)
随着经济快速发展和城市化加速,全球能源需求量不断增加[1]。煤炭是我国的主要一次能源,但其直接燃烧的利用方式却存在着效率低和环境污染严重等问题[2]。因此,发展清洁高效的转化技术,寻求可替代能源已经迫在眉睫。煤热解是一种在隔绝空气下将煤加热,使其转化为高热值的半焦、富氢气体和焦油的清洁技术,但存在着温室气体排放的问题[3-4]。生物质是一种储量大,分布广泛的可再生能源,碳排放量很低。煤和生物质共热解技术可有效减少CO2排放,同时可直接利用现有煤热解装置,大幅减少了设备投资,应用前景良好,因而获得越来越多人的关注[5-8]。
截至目前,针对煤与生物质单独热解的研究较多,而煤与生物质共热解研究还处于基础阶段[9-14]。Frau等人[15]利用小型气化炉分别对褐煤和木屑进行气化,得出进料速率为24 kg/h 时,煤气化和生物质气化所得合成气产率分别为79.67、23.32 kg/h,其热值则为5.14、7.49 MJ/kg。Kern等人[16]将褐煤与木屑颗粒在流化床反应器中850 ℃下进行气化,发现不同配比的煤与生物质可以调控气体产物并改变焦油质量。Meng等人[17]通过热重分析仪研究了梧桐木和煤的共热解,得出共热解可以提高热解气产率,并改变半焦结构。Howaniec等人[18]指出了煤与生物质共气化存在协同效应,可以有效提升气化活性。金会心等[19]则采用热重分析仪对煤和生物质进行热解,并进行反应动力学计算,发现生物质对煤热解存在促进作用。
以上关于煤与生物质的共热解研究主要集中在中低温慢速热解气体产物特性及半焦结构变化规律的定性分析,对于高温快速共热解过程中热解气的定量研究以及释放过程的具体动力学特性还较少。共热解过程中,生物质会出现软化、变形等情况,从而堵塞煤表面微孔,抑制煤中挥发分的析出。而高温热解时,气体膨胀,内压增加,从而使得煤中挥发分大幅逸出。因此,高温有助于煤与生物质共热解过程中挥发分大量析出,这对于煤炭清洁制气意义重大[20]。生物质和煤均为固体,共热解时两者间氢体的转移需要在严峻的条件下(如高温、高压)进行[21]。
基于此,本文采用固定床管式炉,借助傅立叶红外气体分析仪和氢气分析仪在线测量热解气组分,定量分析中高温快速热解过程中可燃气体(H2、CO、CH4和C2烃类气体)和含硫污染物(NH3、HCN)的反应动力学释放特性及组分变化规律,研究共热解过程对热解气产量和分布的影响机制,探索共热解过程中的协同效应。这对于未来煤与生物质共热解的大规模闪速制取煤气以及能源的低碳清洁转化利用有重要意义。
1 实验仪器与方法
1.1 实验仪器
本文所用实验系统如图1所示,主要包括反应炉和气体检测2部分。管式炉为YFFK30×325/13QK-G型。气体分析仪为GasmetDX4000型傅立叶红外分析仪,可以检测H2O、CO2、CO、SO2、NO、NO2、N2O、NH3、HCN、CH4、C2H2、C2H4、C2H6、C6H6等25种气体,测量精度在2%以内。氢气分析仪为上海英盛生产的电化学式,测量精度在5%以内。

图1 实验系统Fig.1 Schematic diagram of the experimental system
1.2 实验方法
实验所用样品为松木和兖州煤,其工业和元素分析见表1。由表1可知:松木的挥发分质量分数很高,灰分和固定碳质量分数较低,氧元素质量分数较高;而兖州煤的水分较低,灰分很高,碳元素质量分数较高。

表1 实验样品工业和元素分析Tab.1 Proximate and ultimate analysis of the samples
实验前,所有样品经过研磨,粒径均小于250 μm。实验时,采用1 200 mL/min的氩气作为载气吹扫炉中空气,加热带温度定为180 ℃以防气体冷凝。热解温度设定为800、900、1 000、1 100、1 200 ℃。采用质量比1:1的方式均匀混合松木和兖州煤(混合物共100 mg)并添加至石英舟进行反应。
当管式炉以10 ℃/min的加热速率升温到设定温度180 ℃时,迅速将石英舟推进管式炉中间反应段,样品迅速升温热解,热解气由气体分析仪和氢气分析仪进行在线检测,数据由计算机采集并记录,热解时间为5 min。为保证实验的准确性,所有实验均重复3次取平均值。实验得到各类气体的析出总量可以通过在线测得的体积分数和时间的积分得到:

式中:m为析出气体的总质量,mg;M为摩尔质量,g/mol;vi为热解气体积分数,/L;V1为基于实际进行修正的气体流量,mL/min;ti为时间间隔,s;k为单次实验中总测量的次数。
为了研究煤与生物质共热解过程的协同效应,引入共热解气体析出总量的理论值,此变量基于煤和生物质单独热解时的析出总量值进行线性叠加得到:
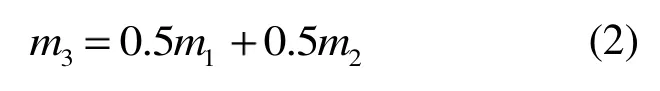
式中:m1为生物质单独热解气体析出总质量,mg;m2为煤单独热解气体析出总质量,mg;m3为共热解理论值,mg。
2 结果与分析
2.1 H2析出特性
松木和兖州煤单独热解及混合共热解时的H2释放特性如图2所示。

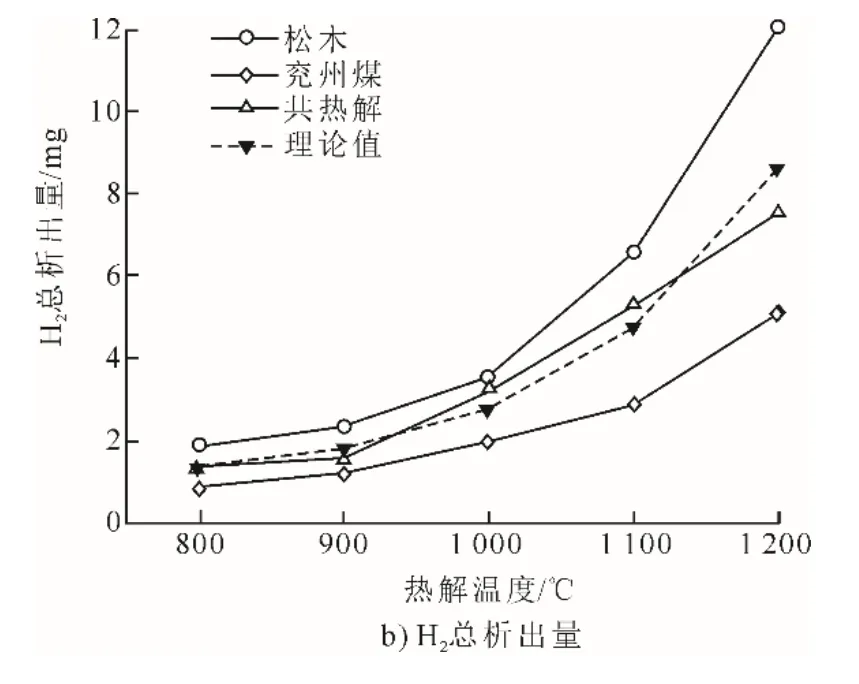
图2 H2析出特性Fig.2 Release characteristic of H2
图2a)给出了1 000 ℃热解时的H2释放曲线。从图2a)中可以看出,松木热解、兖州煤热解和两者共同热解时,H2均从30 s左右开始释放,并各有1个释放峰。不同的是,松木热解的H2释放峰出现得最早,在60 s左右,峰值高达61.7 μL/L;兖州煤的释放峰出现得最晚且峰值最低;而松木和兖州煤混合热解时,其释放峰介于松木释放峰和兖州煤释放峰之间,但其释放峰特征更接近于松木释放峰。
图2b)进一步从总析出量对H2析出特性进行探究。由图2b)可以看出:随着热解温度从800 ℃升至1 200℃,松木和兖州煤的H2总析出量均呈现增长趋势,并最终分别达到了12.0 mg和5.1 mg;共热解时,H2总析出量介于松木热解和兖州煤热解之间,并且在较低温度热解时(800~900 ℃),产物析出量与理论计算值非常接近,在较高热解温度下,产物析出量偏离理论计算值(-12%~17%)。这说明高温热解时,松木和兖州煤之间的化学结构断裂比较严重,而松木的灰熔点较低,其灰分的熔融状态对于热解过程中H2的释放也会有比较大的影响。H2的来源主要包括桥键断裂生成自由基、缩合反应以及缩聚反应和芳香结构的脱氢作用[22-23]。高温有助于这些反应过程的进行,因此大幅增加了H2的总析出量。
根据表1可知,生物质有着比煤更高的氢碳比,其结构更不稳定。在共热解的过程中,生物质先热解,生成大量H、OH、CH3等富含氢的活性自由基,这些富氢自由基与煤表面的自由基相结合,抑制了交联反应和缩合反应的进行,促进了煤的热裂解反应[20,24]。因此,生物质热解产生的H2被用于供氢从而加快了煤的热解反应,这使得H2的析出量与理论计算值产生了偏差。可见,生物质和煤共热解时存在协同效应,对H2的析出影响较大(热解温度为1 000 ~1 100 ℃时对于H2的生成比较有利)。此外,生物质富含碱性金属,共热解时,K、Ca等元素可以在煤颗粒的表面和内部形成活性位点,从而促进了热解反应的进行和热解气的生成[25]。
2.2 小分子可燃气体析出特性
2.2.1 释放曲线
由实验可知,煤和生物质热解时,其释放的主要可燃气体为H2、CO和CH4以及少量C2烃类。图3给出了松木和兖州煤在1 000 ℃热解时CO和CH4的释放曲线。从图3a)可以看出,松木和兖州煤单独热解时,各有1个释放峰,且峰值时间均在20 s左右,释放过程基本在5~72 s。松木热解时,CO的释放峰较大,高达138.9 μL/L,而兖州煤的释放峰很小,为10.9 μL/L,这与兖州煤中较低的氧元素含量有关。煤与生物质共同热解时,CO释放峰值处于两者之间,可达61.1 μL/L。由图3b)可以看出,CH4的释放规律与CO基本类似,其释放时间以及峰值大小存在差异。3种样品热解时,CH4的释放过程基本在5~81 s,其中松木释放峰值最高,可达45.7 μL/L,兖州煤释放峰值最低,为19.5 μL/L,但仍大于兖州煤的CO释放峰值。

图3 小分子可燃气体释放曲线Fig.3 Release curves of small-molecular combustible gases
可见,热解时,CO的释放过程比CH4释放过程快,但释放峰值却随着样品不同而不同。松木热解时,CO释放峰远高于CH4释放峰;而兖州煤热解时,CO释放峰远低于CH4释放峰;共热解时,CO和CH4的释放特性介于两者之间。
2.2.2 析出总量
图4进一步揭示了热解温度对可燃气体析出总量的影响。由图4a)可以看出,CO的析出量随着热解温度的升高而增加,松木热解的CO析出量最高,可达25.8~31.9 mg,兖州煤的CO析出量最低,这与图3a)中CO的释放规律一致。在较低温度时,CO主要由羰基和醚键的断裂形成,而在高温时,CO主要来自于酚羟基以及芳香环的分解[26]。生物质和煤混合共热解时,CO析出量与理论计算值基本一致,这说明CO的释放基本不受生物质和煤的协同作用影响。由图4b)可知,CH4的析出量随着热解温度而减少。松木800 ℃热解时,CH4析出量高达15.0 mg,而热解温度升至900 ℃时,CH4释放量减少至6.7 mg。这主要是因为生物质中高含量的羟基在高温下释放并与CH4发生反应,从而大大减少了CH4的生成[23,27]。煤和生物质共热解时,CH4的析出量与理论计算值类似,说明CH4的释放同样不受煤和生物质协同作用的影响。


图4 小分子可燃气体析出总量Fig.4 Total precipitation mass of small-molecular combustible gases
由图4c)可以看出,3种样品的热解C2烃类(C2H2、C2H4、C2H6)总析出量均很少,都在3.5 mg以下。因此,热解过程析出的可燃气体主要为H2、CO、CH4,且CO和CH4的释放过程基本不受煤和生物质混合协同作用的影响。
2.3 含氮污染物析出特性
热解过程中,煤和生物质中的官能团(羧基、羟基、甲氧基和酚类等)会大量分解,并以气态形式逸出,这其中就包括了含氮的污染物。研究表明,热解气中含氮污染物主要为NH3和HCN[28]。因此,本文对NH3和HCN的释放规律进行了研究,结果如图5所示。由图5a)可以看出:松木热解时NH3析出的很早,其释放过程在3~121 s,释放峰较低;而兖州煤的NH3释放过程则较晚,在16~180 s,且释放峰较高。这主要是由于兖州煤中氮元素含量远高于松木,煤中氮的存在形式主要为季氮、吡啶、吡咯和氮氧化物,结构较为稳定,而生物质中的氮主要存在形式为相对不稳定的氨基酸和蛋白质,从而生物质的热解NH3析出时间较早[29-30]。煤和生物质共热解时,NH3的释放时间主要集中于10~150 s,释放峰最低,说明NH3的释放并不是单纯兖州煤热解和松木热解时释放曲线的叠加,这2种样品之间存在相互作用,在一定程度上抑制了NH3的释放。由图5b)可以看出:3种工况下HCN开始释放时间类似,均在4 s左右;而松木的HCN释放结束时间最早,在95 s左右,且最高释放峰值最小。因此,松木中的氮结构更不稳定,析出更快,但由于其氮含量少,NH3和HCN的释放峰值也很低。

图5 含氮污染物释放曲线Fig.5 Release curves of nitrogen-containing gaseous pollutants
图6给出了含氮污染物析出总量随着热解温度的变化规律。由图6可以得出:松木热解NH3和HCN析出总量均最低,而兖州煤的NH3和HCN析出总量均最高,这与图5的释放曲线规律相一致;随着热解温度的升高,NH3的析出总量变化不大,且均在0.08 mg以下,HCN的析出总量变化规律较为复杂,在800 ℃低温时,3种工况HCN的析出总量基本都在0.20 mg左右。

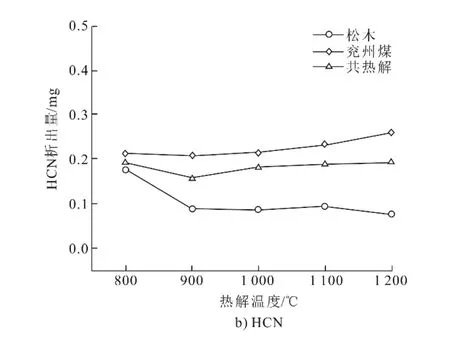
图6 含氮污染物析出总量Fig.6 Total precipitation mass of nitrogen-containing and sulfur-containing pollutants
2.4 热解过程各元素析出特性
了解各元素的析出特性,能更好地阐述热解气的释放过程,为高温快速热解制气提供了较好的指导意义。为此,本文以松木和兖州煤共热解为例,对热解气中C、H、O和N 4种元素的质量分数进行计算并比较,结果见表2。从表2可以看出:随着热解温度升高,松木和兖州煤共热解时的热解气中C元素质量分数基本呈现下降的趋势,最高可达28.9%;而H元素质量分数大大增加,最高涨幅达到了114.3%。这主要是由于高温下的缩聚和脱氢反应生成大量氢气,而含C类气体析出量相对变化较小,造成了C元素质量分数的相对下降[31-32]。热解气中,O元素质量分数的变化不大,O元素的变化主要包括了H2O的析出,羧基羰基等含O官能团的分解生成CO2和CO,以及少量含氮氧化物的生成。

表2 热解气中元素析出特性Tab.2 Precipitation characteristics of elements in the pyrolysis gases
3 结 论
1)热解过程中的主要可燃气体产物为H2、CO和CH4。热解温度升高,共热解气中的H2产量大大增加,最高可达75.4 mg/g混合物;CO产量缓慢增加;CH4下降。共热解过程中,H2析出最晚且析出过程基本在30~200 s;CO的释放过程比CH4释放过程快,其释放峰值也更高,可达61.1 μL/L。此外,CO和CH4的释放基本不受煤和生物质混合协同作用的影响。生物质化学结构更不稳定,其热解气释放相对更快。
2)生物质中氮结构存在形式主要为不稳定的氨基酸和蛋白质,析出快,但由于其氮含量少,NH3和HCN的释放峰值很低。共热解时,NH3释放被抑制,其释放峰最低(0.069 μL/L)。
3)热解温度升高,共热解气中C元素质量分数下降,降幅可达28.9%,而H元素质量分数大大增加,涨幅高达114.3%。高温下的缩聚和脱氢反应生成大量氢气,使得C元素质量分数相对下降。

