内皮细胞对髓母细胞瘤干细胞特性的影响
王洪新 王玉社 王 勇△
1)河南省人民医院 河南大学人民医院,河南 郑州 450003 2)河南省脑血管病医院,河南 郑州 450003
髓母细胞瘤是中枢神经系统恶性程度最高的神经上皮肿瘤之一,容易复发和远处转移。目前发现髓母细胞瘤中存在具有神经干细胞特征的肿瘤细胞,即肿瘤干细胞,它们被认为是肿瘤复发和转移的根源[1-2]。肿瘤干细胞所处的微环境包含多种细胞因子,调节干细胞的增殖及定向分化[3-4]。如果改变肿瘤细胞的微环境,就可能改变干细胞的转归[5-6]。本次研究通过血管内皮细胞和肿瘤细胞共同培养以改变肿瘤细胞的微环境,观察其对肿瘤干细胞增殖、自我更新和侵袭等方面的影响并探讨其机制。
1 材料与方法
1.1材料人脑微血管内皮细胞(HBMECs)购自美国Cell Biologics公司,M199培养基购自美国Sigma公司,DMEM培养基购自Invitrogen公司,髓母细胞瘤D341细胞株由美国American Type Cell Culture提供。CD133抗体购自德国Miltenyi公司,TRIzol购自美国Invitrogen公司,Notch2抗体购自加拿大PLLABS公司,Jagged 1购自英国Abcam公司,Hes-1抗体购自美国Abbiotec公司,Hey-2抗体购自美国Millipore公司,Transwell购自Corning公司。
1.2细胞培养人脑微血管内皮细胞在20%胎牛血清(FBS)和20 mg/mL内皮细胞生长因子(ECGF)的M199培养基中培养。D341髓母细胞瘤系在加入10% FBS的DMEM培养基中培养。
1.3成球试验将D341Med和HBMECs细胞放在孔径0.4 μm的Transwell小室中共培养72 h,在GFP标记的D341髓母细胞瘤系中,用Leica倒置显微镜观察2 000个细胞中的成球率,同时观察二代和三代的成球率。D341Med单独培养作对照。
1.4流式细胞仪和细胞计数收集共培养的肿瘤细胞,按试剂说明,加入1∶200的CD133抗体,然后流式细胞仪检测CD133+的细胞数。
1.5PCR按TRIzol说明书操作提取细胞总RNA,按反转录试剂盒说明书进行反转录合成cDNA。其中引物由Invitrogen公司合成,Notch2:5′-CCCAATGGGCAAGAAGTCTA-3′ and 5′-CACAATGTGGTGGTGGGATA-3′;Jagged 1:5′-CTCATCAGCCGTGTCTCAAC-3 ′and 5′-GGCACACACACTTAAATCCG-3′;Hes-1:5′-TGGATGCGGAGTCTACGATG-3′and 5′-TAAGGCCACTTGCCACCTTC-3′;Hey-2:5′-ACCTCTCTCTTGTCCCTCTCTG-3′and 5′-GGTTTATTGTTTGTTCCACTGC-3′。
1.6Western杂交试验通过裂解液提取蛋白,采用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离生物技术,然后转移到聚偏氟乙烯(PVDF)膜上,与一抗体兔抗人Notch 2(1∶500)、Jagged 1(1∶500)、Hes-1(1∶500)、Hey-2(1∶500) 4 ℃孵育过夜;TBST洗膜3次后,加入HRP标记的羊抗兔二抗(1∶200),室温孵育60 min;TBST洗膜3次后,加入增强型化学发光试剂后用成像仪显影。
1.7Transwell侵袭试验消化、离心、计数细胞后,用无血清培养液将细胞浓度稀释为1×105个/mL,将200 μL细胞悬液加入到已铺好Matrigel生物胶的孔径为8.0 μm Transwell小室内,将Transwell小室置于加入500 μL 的含10%胎牛血清培养液的24孔板中,继续培养细胞24 h,取出小室并用10%甲醛固定30 min,结晶紫溶液染色30 min,自来水漂洗30 s后倒置显微镜下计数穿过基底膜的细胞数量。
1.8裸鼠成瘤试验4周龄BALB/c裸鼠,数字随机法分组,各组体质量、性别、周龄比例均衡。各组皮下植入肿瘤细胞(1×105个/只),每2天用游标法测量肿瘤的长度和宽度。40 d后处死小鼠,肿瘤体积按长度(mm)×宽度2(mm2)/2计算。所有动物实验经河南省人民医院伦理委员会批准。

2 结果
2.1血管内皮细胞刺激髓母细胞瘤干细胞形成与D341Med组相比,D341Med+HBMECs组不仅提高了第一代髓母细胞瘤的成球能力(P<0.05),而且第二代、第三代的成球能力也明显提高(P<0.05)(图1),CD133+细胞也显著增加(P<0.05)(图2)。
2.2血管内皮细胞激活Notch信号通路与D341Med组相比,D341Med+HBMECs组提高了Noch 2、Jagged 1、Hes-1和Hey-2的mRNA和蛋白水平的表达(P<0.05)(图3)。
2.3Notch信号通路对血管内皮细胞诱导肿瘤细胞干细胞的影响通过加入DAPT,以阻断Notch信号通路,发现CD 133+细胞减少(P<0.05)(图2),伴随Noch 2、Jagded 1、hes-1和hey-2的表达下降(P<0.05)(图3)。
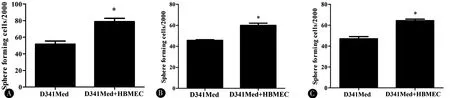
图1 内皮细胞对髓母细胞瘤干细胞成球率的影响 A:第一代;B:第二代;C:第三代;*P<0.05Figure 1 Effect of ECs on the stem-like cell phenotype of MB cells in vitro.Sphere-forming assay of primary D341Med (A),secondary generation D341Med cells (B),and tertiary generation D341Med cells (C) cultured with or without HBMEC,*P<0.05

图2 内皮细胞通过Notch通路对髓母细胞瘤CD133+细胞的影响 D341Med+HBMEC组与D341Med组相比,*P<0.05;D341Med+HBMEC组与D341Med+HBMEC+DAPT组相比,#P<0.05Figure 2 Effect of ECs on MB cell stemness and tumor growth via Notch in vitro.The percentage of CD133-positive cell in D341Med co-cultured with HBMEC with or without DAPT.Compared with the D341Med group,*P<0.05;compared with the D341Med + HBMEC group,#P<0.05
2.4血管内皮细胞刺激肿瘤细胞侵袭Transwell侵袭试验显示D341Med+HBMEC组穿膜细胞数319.56±10.67,与D341Med组(197.14±6.85)相比,差异有统计学意义(P<0.05);与D341Med+HBMEC+DAPT(128.32±3.42)相比,差异也有统计学意义(P<0.05)。
2.5血管内皮细胞促进体内肿瘤细胞生长在体内建立异种移植瘤模型,D341Med+HBMEC组与D341Med组相比,肿瘤生长有显著性差异(P<0.05);与D341Med+HBMEC+DAPT相比,差异也有统计学意义(P<0.05)(图4)。
3 讨论
肿瘤干细胞周围的微环境可通过分泌各种可溶性因子或刺激信号通路维持细胞自我更新和分化之间的平衡[7-10]。另外,它还在肿瘤的侵袭和转移中起至关重要的作用[11-12]。打破这种异常的微环境就会削弱或加强肿瘤干细胞的自我更新,从而抑制或促进肿瘤的侵袭转移[13-14]。
有证据表明血管内皮细胞是干细胞微环境的重要组成部分[15-16]。ZHU等[17]发现在胶质母细胞瘤中内皮细胞的一项重要功能是创造一个微环境,以促进肿瘤干细胞的自我更新。肿瘤细胞和血管内皮细胞相互作用是肿瘤增生、扩散和微转移灶发展的重要条件之一。肿瘤细胞常位于血管周围,而HAMBARDZUMYAN等[18]进一步研究发现髓母细胞瘤干细胞主要存在于血管旁微环境,且微环境可促进肿瘤干细胞生长和自我更新。本次实验中肿瘤细胞和血管内皮细胞共培养后,发现髓母细胞瘤成球能力和CD133+细胞明显增加,说明通过微环境的改变,可以改变髓母细胞瘤干细胞的行为。
关于内皮细胞对肿瘤细胞侵袭能力的影响,TRUONG等[19]建立3D器官型微流体模型以模拟三维的血管微环境,将胶质瘤干细胞和内皮细胞在模型内共同培养,可明显增加胶质瘤干细胞的侵袭特性。本研究Transwell侵袭试验表明D341Med+HBMEC组穿膜细胞数较D341Med组明显增加,体内试验显示D341Med+HBMEC组肿瘤体积明显增大,证实血管内皮细胞可促进肿瘤干细胞的侵袭性,而且加强了髓母细胞瘤的致瘤性。
Notch信号通路是保守而重要的经典通路之一。Notch受体有Notch1-4,配体有Jagged 1、 DLL4等,靶基因有Hes-1、Hey-2等。Notch信号系统可调控肿瘤干细胞的生长分化[20-21],有研究发现胶质瘤干细胞可激活Notch信号促进自我更新和侵袭性[22-23]。


图3 内皮细胞对Notch相关指标(Noch 2、Jagged 1、Hes-1和Hey-2)mRNA(A)和蛋白水平(B)的影响 D341Med+HBMEC组与341Med组相比,*P<0.05;D341Med+HBMEC组与D341Med+HBMEC+DAPT组相比,#P<0.05
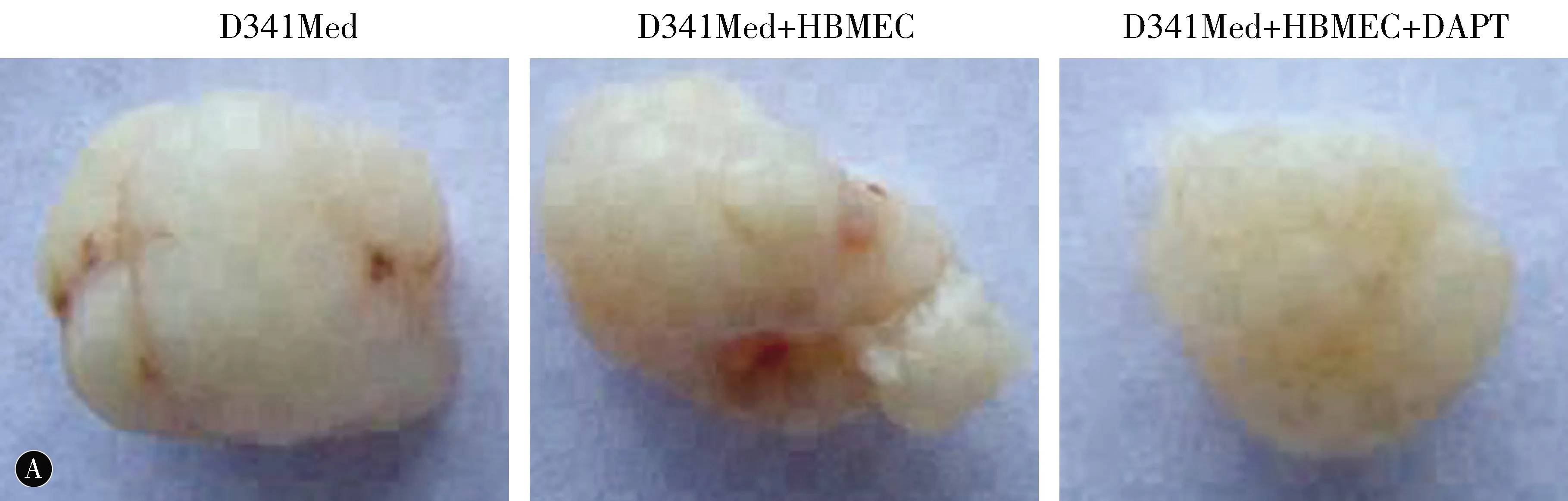
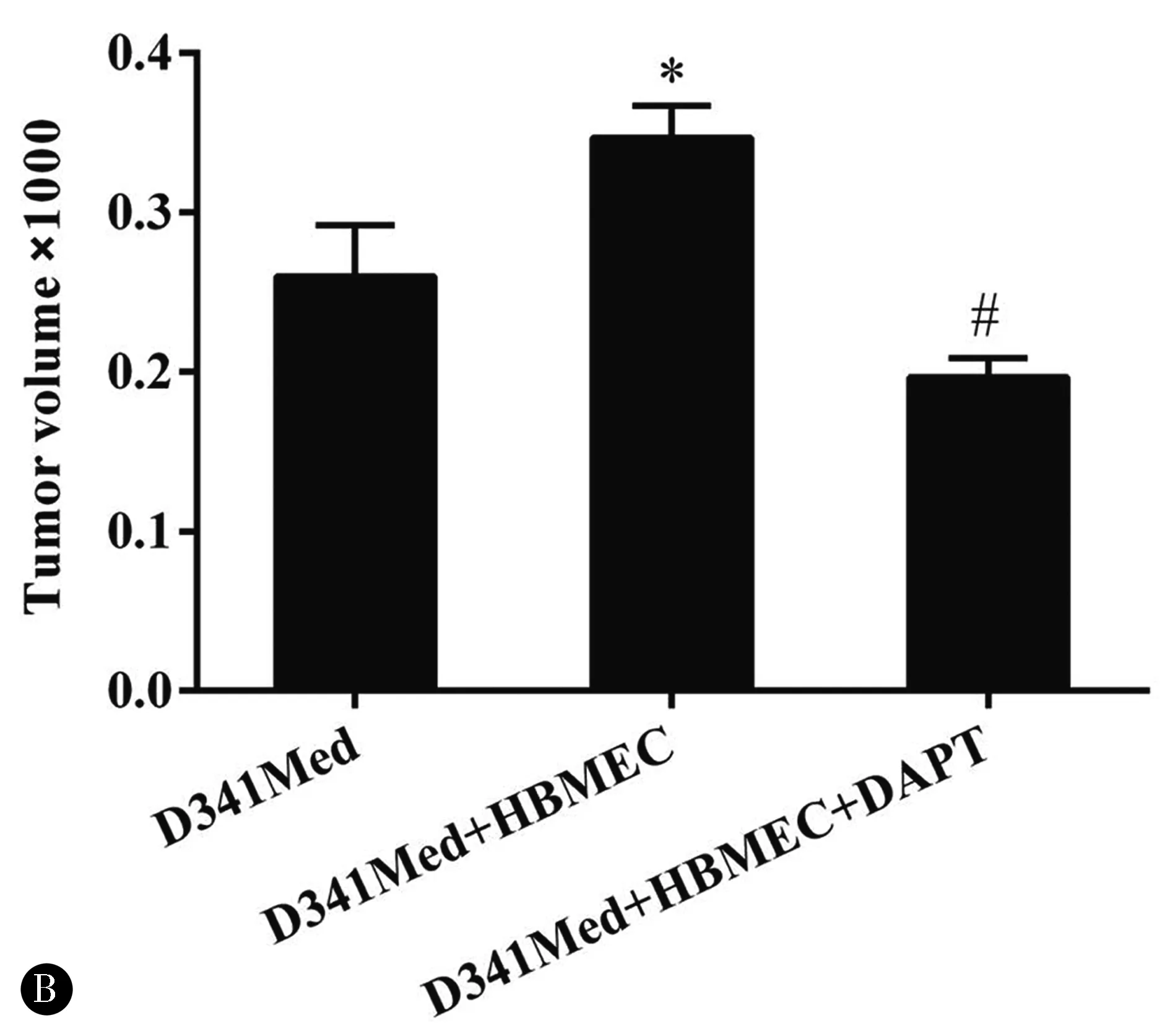
图4 内皮细胞通过Notch通路对肿瘤形态和体积的影响 D341Med+HBMEC组与341Med组相比,*P<0.05;D341Med+HBMEC组与D341Med+HBMEC+DAPT组相比,#P<0.05
免疫荧光染色显示高水平表达Notch 1和Notch 2受体的胶质瘤干细胞位于内皮细胞附近,而内皮细胞表达Notch配体DLL4和Jagged 1,它们可通过细胞间相互接触激活胶质瘤干细胞表面的Notch受体,促进胶质瘤干细胞自我更新[17,24]。另外,内皮细胞还可通过分泌一氧化氮激活Notch信号,从而导致胶质瘤干细胞自我更新和胶质瘤的生长[25-26],通过γ-分泌酶抑制剂(DAPT)可抑制Notch信号,导致胶质瘤干细胞自我更新减少,同时减少了微环境中的内皮细胞[27-28]。本次实验发现,与D341Med组相比,D341Med+HBMECs组提高了Noch 2、Jagded 1、Hes-1和Hey-2的mRNA和蛋白水平的表达(P<0.05),证实HBMEC激活了髓母细胞瘤的Notch系统;反之,通过加入DAPT以阻断Notch信号通路,发现CD133+细胞减少(P<0.05),伴随Noch 2、Jagded 1、hes-1和hey-2的表达下降(P<0.05),提示血管内皮细胞通过激活Notch信号通路诱导髓母细胞瘤干细胞形成。而Transwell侵袭试验显示,D341Med+HBMEC+DAPT组与D341Med+HBMEC组相比,穿膜细胞减少(P<0.05)。体内试验显示前者比后者肿瘤体积明显缩小,说明通过抑制Notch信号,可减少血管内皮细胞对髓母细胞瘤干细胞侵袭能力的影响。
本研究显示内皮细胞和髓母细胞瘤共同培养可明显增加髓母细胞瘤干细胞的比例,同时增加肿瘤的侵袭能力,但在应用Notch信号系统抑制剂后上述作用明显下降,说明内皮细胞可能通过激活Notch通路促进髓母细胞瘤干细胞增殖、自我更新和侵袭能力。

