枸杞内生真菌NQ8GⅡ4菌株原生质体制备及再生条件研究
闫思远,杨富龙,杜 娟,李 金,任苗苗,李嘉泓,顾沛雯
(宁夏大学 农学院,银川 750021)
内生真菌是指在其生活史中某一阶段或全部阶段生活于健康植物内部,且被感染的宿主植物(至少是暂时)不表现出明显病害症状的一类真菌[1]。研究发现药用植物中含有丰富的内生真菌资源,是发现新化合物和获得生物活性代谢产物的重要来源[2]。2017年,魏硕等[3]从冬凌草中分离出1株草酸青霉菌PenicilliumoxalicumCurrie et Thom,通过HPLC-MS和MTT法测定,发现该菌可以产生冬凌草甲素,且对人乳腺癌细胞系MCF-7的细胞活性具有一定抑制作用。2017年,徐全智[4]从枸杞中分离出1株细极链格孢Alternariatenussima,可以产生几丁质酶和 β-1,3葡聚糖酶,且对枸杞炭疽病菌Colletotrichumgloeosporioides、番茄叶霉病菌Fulviafulva、辣椒炭疽病菌C.capsici等病原真菌具有良好的拮抗作用。2018年,孙牧笛等[5]从苦豆子中分离得到1株细极链格孢A.tenussima,其作为真菌诱导子可促进苦豆子组培苗中LDC基因的表达,从而提高宿主氧化苦参碱的含量。但是药用植物内生真菌通过发酵生产天然活性产物的时间较长[6]、产率较低[7]、分离纯化难度较大[8],成本较高[9],目前基本上还停留在实验室的研究阶段,无法实现产业化生产。此外,从药用植物中筛选出的内生真菌,部分性状不太稳定,在培养过程中容易丧失重要功能[10],因此迫切需要对其进行全面的生物学研究和遗传改造。
建立良好稳定的原生质体制备技术是进行分子遗传学操作的关键步骤之一[11]。原生质体诱变[12]、融合[13]、基因组重排[14]、遗传转化[15]、基因组编辑技术[16]等都必须以高浓度、高活力的原生质体为前提,所以优化原生质体的制备和再生条件显得尤为重要。
原生质体是指完整细胞去掉细胞壁结构后所形成的球状单细胞,可以摄取外源大分子,细胞器,细菌和病毒,具有全能型[17]。酶解法是制备原生质体最常使用的方法,菌龄、酶复配体系、酶解时间、稳渗剂等因素均会对原生质体的制备产生影响[18]。2013年,弭宝彬等[19]通过优化菌龄、酶解体系、酶解时间、酶解温度及转速等条件,获得了尖孢镰刀菌辣椒专化型Fusariumoxysporumf.sp.capsicum原生质体制备的最佳条件。2015年,Ramamoorthy等[20]通过单因素试验对拟轮枝镰刀菌F.verticillioides原生质体制备条件进行优化,获得最大原生质体产量为4.2×106mL-1。2016年,贺薇等[21]通过优化培养基、菌龄、β-巯基乙醇预处理、酶解体系、酶解时间等条件,获得尖孢镰刀菌唐菖蒲专化型F.oxysporumf.sp.gladioli原生质体的最大产量为1.4×107mL-1,再生率为57.4%。
笔者前期从健康枸杞根部分离到1株镰刀菌属内生真菌F.nematophilumNQ8GⅡ4,该菌株对枸杞炭疽病菌C.gloeosporioides、葡萄灰霉病菌Botrytiscinerea和玉米大斑病菌Exserohilumturcicum等多种植物病原真菌具有较强的拮抗作用,同时还能产生具有较强抑菌活性的挥发性气体,是1株值得深入研究的高活性功能菌株。为了进一步开展该菌株在原生质体诱变、融合等方面的遗传改造研究,本研究通过单因素试验对影响枸杞内生真菌NQ8GⅡ4菌株原生质体制备的关键因素(菌龄、酶解时间、酶质量浓度、稳渗剂浓度)进行优化,以期通过响应面法获得该菌株原生质体制备的最佳方案。
1 材料与方法
1.1 材 料
1.1.1 菌株和质粒 枸杞内生真菌NQ8GⅡ4菌株(CGMCC No.19721)由宁夏大学植物病理实验室分离、鉴定并保存。载体PDL2(含gfp基因)由西北农林科技大学胡小平教授惠赠。
1.1.2 试剂和仪器 潮霉素B(HygromycinB,HmB)购于德国Roche公司;氨苄青霉素(Ampicillin,Amp)购于北京索莱宝科技有限公司;Miracloth购于美国Calbiochem公司;崩溃酶(Driselase),溶壁酶(Lyticase)购于美国Sigma 公司。
参照张世杰[22]的方法,配置马铃薯葡萄糖琼脂培养基(PDA)、马铃薯葡萄糖肉汤培养基(PDB)、酵母浸出粉胨葡萄糖培养基(YPD)和Bottom Agar培养基。
Simpli Nano超微量分光光度计(GE Healthcare公司,美国);Sigma 3K 15通用台式冷冻离心机(Sigma公司,美国);Mettler-toledo LE204E电子分析天平(Mettler-toledo公司,瑞士)。
1.2 方 法
1.2.1 原生质体制备 参照韩小路[23]的方法,略作调整。将枸杞内生真菌NQ8GⅡ4菌株在PDA培养基上培养5 d后,打取10个直径0.5 cm的菌饼,接种于100 mL的PDB培养基中, 25 ℃、175 r/min的条件下震荡培养4 d。吸取2.5×107个孢子于100 mL YPD培养基中, 25 ℃、175 r/min震荡培养12~20 h。使用无菌miracloth过滤,0.6~1.2 mol/L NaCl冲洗菌丝至白色,称量0.05 g于1 mL 15~35 g/L崩溃 酶+10 g/L溶壁酶的酶解液中,30 ℃、90 r/min酶解0.5~3 h。使用无菌miracloth过滤至50 mL离心管中,4 ℃、2 500 r/min离心20 min。加入10 mL STC缓冲液重新悬浮,2 500 r/min离心20 min(重复1次),加入1 mL STC溶液重悬浮,备用。每个处理设置3个重复。
1.2.2 原生质体再生 参照彭轶楠等[24]的方法,略作调整。将制备好的枸杞内生真菌NQ8GⅡ4菌株原生质体悬浮液稀释3 000倍,吸取70 μL涂布于Bottom Agar培养基上,25 ℃恒温培养2 d,观察再生情况。以无菌水处理原生质体为对照,每个处理设置3个重复。
再生率=(Bottom Agar培养基上长出的菌落数-无菌水处理后Bottom Agar培养基上长出的菌落数)/(原生质体产量/3 000×原生质体涂布体积)×100%,有效原生质体量(mL-1)=原生质体产量×再生率。
1.2.3 单因素试验 按照“1.2.1”制备原生质体的方法,分别考察菌龄(12、14、16、18和20 h)、酶解时间(0.5、1.0、1.5、2.0、2.5和3.0 h)、酶质量浓度(15、20、25、30和35 g/L崩溃酶+10 g/L溶壁酶)、稳渗剂浓度(0.6、0.7、0.8、1.0和1.2 mol/L NaCl)等条件对原生质体产量、再生率、有效原生质体量的影响。
1.2.4 响应面法优化条件 根据单因素试验的试验结果,以酶解时间(A)、酶质量浓度(B)和稳渗剂浓度(C)为自变量,以原生质体产量(Y1)、再生率(Y2)、有效原生质体量(Y3)作为响应值,利用Design Expert 12.0设计Box-Behnken试验,共17个试验点,其中中心点5个,用来估计试验误差[25]。具体试验设计如表1所示。
1.3 统计分析
使用Design Expert 12.0软件进行Box-Behnken试验设计;SPSS 23进行数据分析。

表1 响应面试验设计因素与水平Table 1 Factors and levels in response surface experiment
2 结果与分析
2.1 单因素试验
2.1.1 菌龄对枸杞内生真菌NQ8GⅡ4菌株原生质体制备和再生的影响 由图1可知,随着菌龄的增大,NQ8GⅡ4菌株原生质体产量和再生率呈现先升高后降低的趋势。当菌龄为16 h时,原生质体产量达到最大,为6.94×107mL-1,再生率达到最大,为5.81%,有效原生质体量达到最大,为40.31×105mL-1。因此选择16 h菌龄菌丝作为原生质体制备原料。
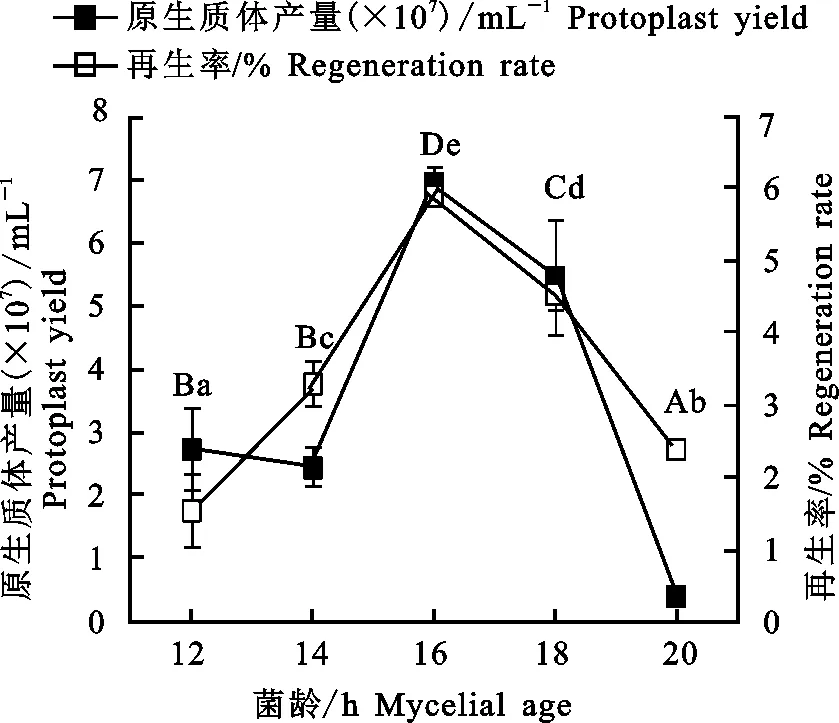
图中不同大写字母表示原生质体产量各水平间差异达显著水平(P<0.05);不同小写字母表示原生质体再生率各水平间差异达显著水平(P<0.05),下同
2.1.2 酶质量浓度对枸杞内生真菌NQ8GⅡ4菌株原生质体制备和再生的影响 由图2可知,随着混合酶液中崩溃酶质量浓度的增加,NQ8GⅡ4菌株原生质体产量和再生率呈现先升高后降低的趋势。使用30 g/L崩溃酶+10 g/L溶壁酶的混合酶液时,原生质体产量达到最大,为 6.97×107mL-1,再生率达到最大,为5.77%,有效原生质体量达到最大,为40.22×105mL-1。因此选择25~35 g/L崩溃酶+10 g/L溶壁酶的混合酶液作为酶解液。

图2 酶质量浓度与枸杞内生真菌NQ8GⅡ4菌株原生质体制备及再生的关系Fig.2 Relationship between enzyme mass concentration with preparation and regeneration of NQ8GⅡ4 strain protoplasts
2.1.3 酶解时间对枸杞内生真菌NQ8GⅡ4菌株原生质体制备和再生的影响 由图3可知,酶解时间为2.5 h时,NQ8GⅡ4菌株原生质体产量达到最大,为6.38×107mL-1;当酶解时间为1.5 h时,原生质体再生率达到最大,为6.89%;综合考虑,当酶解时间为2.5 h时,有效原生质体量达到最大,为37.90×105mL-1。因此,选择2~3 h作为较适酶解时间。
2.1.4 稳渗剂浓度对枸杞内生真菌NQ8GⅡ4菌株原生质体制备和再生的影响 由图4可知,当稳渗剂(NaCl)浓度为0.7 mol/L时,NQ8GⅡ4菌株原生质体产量达到最大,为 6.56×107mL-1,再生率达到最大,为5.86%,有效原生质体量达到最大,为38.44×105mL-1。因此,选择0.6~0.8 mol/L NaCl作为较适稳渗剂。
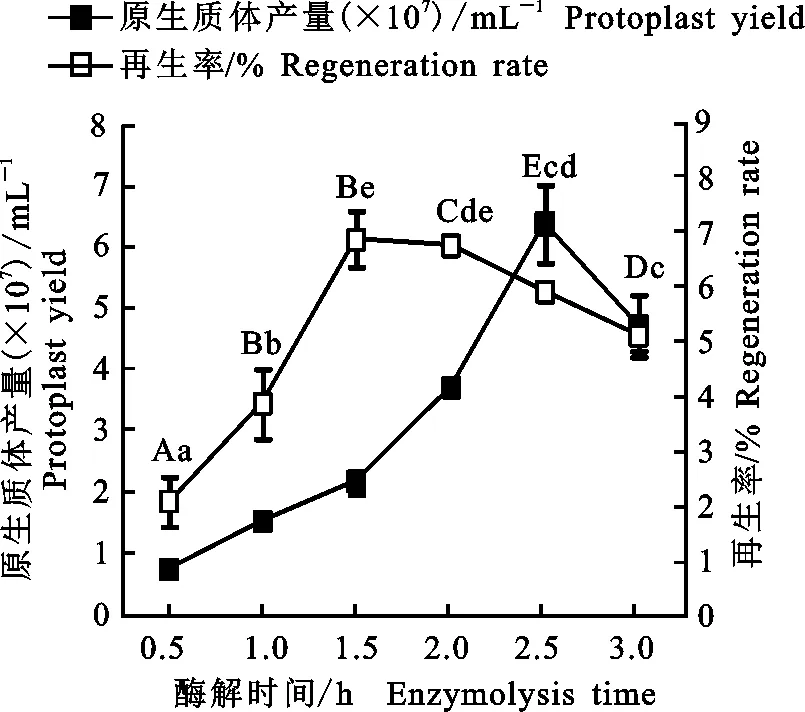
图3 酶解时间与枸杞内生真菌NQ8GⅡ4菌株原生质体制备及再生的关系Fig.3 Relationship between enzymolysis time with preparation and regeneration of NQ8GⅡ4 strain protoplasts

图4 稳渗剂浓度与枸杞内生真菌NQ8GⅡ4菌株原生质体制备及再生的关系Fig.4 Relationship between osmotic pressure stabilizer concentration with preparation and regeneration of NQ8GⅡ4 strain protoplasts
2.2 响应面法优化条件
2.2.1 响应面试验结果 以单因素试验结果为基础,以酶解时间(A)、酶质量浓度(B)、稳渗剂浓度(C)3个因素为自变量,以原生质体产量(Y1)、再生率(Y2)、有效原生质体量(Y3)为响应值,考察因素及因素之间的相互关系对响应值的影响,试验结果见表2。
运用软件Design Expert 12.0分析响应面的回归参数,数学拟合方程及方差分析,并对表2中的数据进行多元回归拟合分析,得到枸杞内生真菌NQ8GⅡ4菌株原生质体产量、再生率和有效原生质体量的二次多项式回归方程模型。
Y1=6.640 0+0.153 8A+0.480 0B+ 1.380 0C-0.092 5AB+0.615 0AC+0.462 5BC-3.350 0A2- 2.560 0B2-2.150 0C2
(1)
Y2=5.820 0+0.2100A-0.027 5B- 0.565 0C+1.650 0AB-0.812 5AC-0.182 5BC- 0.010 0A2-0.722 5B2-4.480 0C2
(2)
Y3=38.840 0+0.3463A+0.881 2B+ 0.415 0C+0.740 0AB-0.057 5AC+0.167 5BC-17.730 0A2-17.67 0 0B2-20.520 0C2
(3)
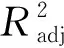
模型(1):一次项中,C为极显著项 (P<0.01),A、B均为不显著项。各因子对原生质体产量影响大小为C>B>A,说明稳渗剂浓度对原生质体产生的影响最大,其次为酶质量浓度,酶解时间对原生质体产生的影响最小。二次项中,A2、B2、C2为极显著项,说明酶解时间,酶质量浓度和稳渗剂浓度对原生质体产生的影响是非线性的。交互项中,AB、AC、BC均为不显著项,说明酶解时间、酶质量浓度、稳渗剂浓度之间的交互影响不明显。
模型(2):一次项中,C为显著项(P<0.05)。各因子对原生质体再生影响大小为稳渗剂浓度>酶解时间>酶质量浓度。二次项中,C2为极显著项。交互项中,BC相关不显著;AC相关显著;AB达到极显著水平,说明酶解时间与酶质量浓度、酶解时间与稳渗剂浓度对原生质体再生的影响具有交互作用而不是简单的线性关系。
模型(3):一次项中,A、B、C均为不显著项。各因子对有效原生质体量影响大小为酶质量浓 度>稳渗剂浓度>酶解时间。二次项中,A2、B2、C2为极显著项。交互项中,AB、AC、BC均为不显著项。
2.2.3 响应面分析试验因素的相互影响 响应面图中曲面的陡峭程度表示各因素对响应值的影响程度[26]。等高线的形状可反映出因素间交互效应的强弱大小,椭圆形表示两因素交互作用显著,而圆形则与之相反[27]。
由图5可知,在酶解时间、酶质量浓度、稳渗剂浓度3个因素中,枸杞内生真菌NQ8GⅡ4菌株原生质体产量和再生率主要受稳渗剂浓度的影响(图A1~B3);有效原生质体量主要受酶质量浓度影响(图C1~C3)。酶解时间与酶质量浓度、酶解时间与稳渗剂浓度的交互作用对原生质体再生率的影响较为显著。上述结果与表3结果一致。
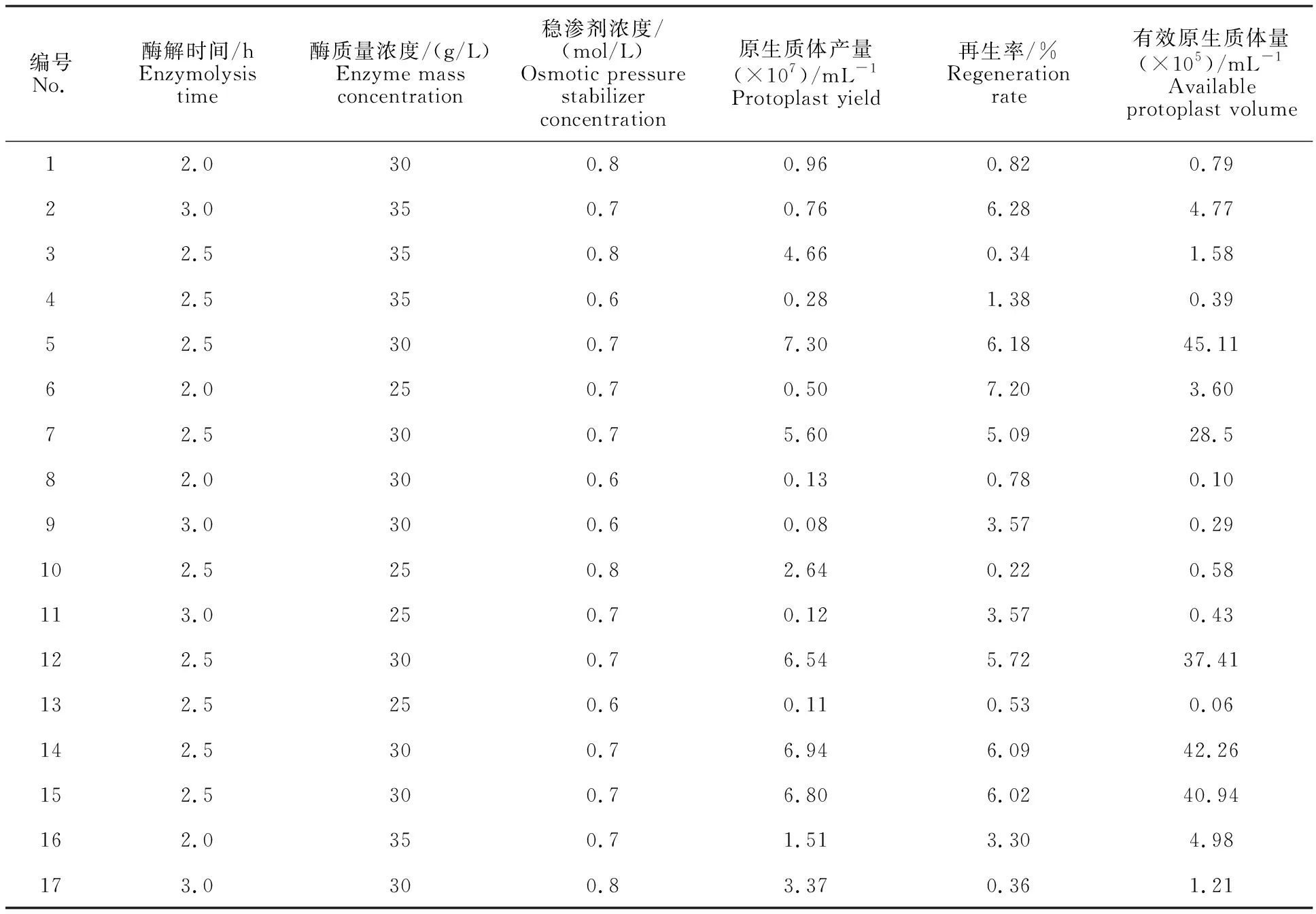
表2 响应面试验设计方案及结果Table 2 Experimental design schemefor response surface methodology and results
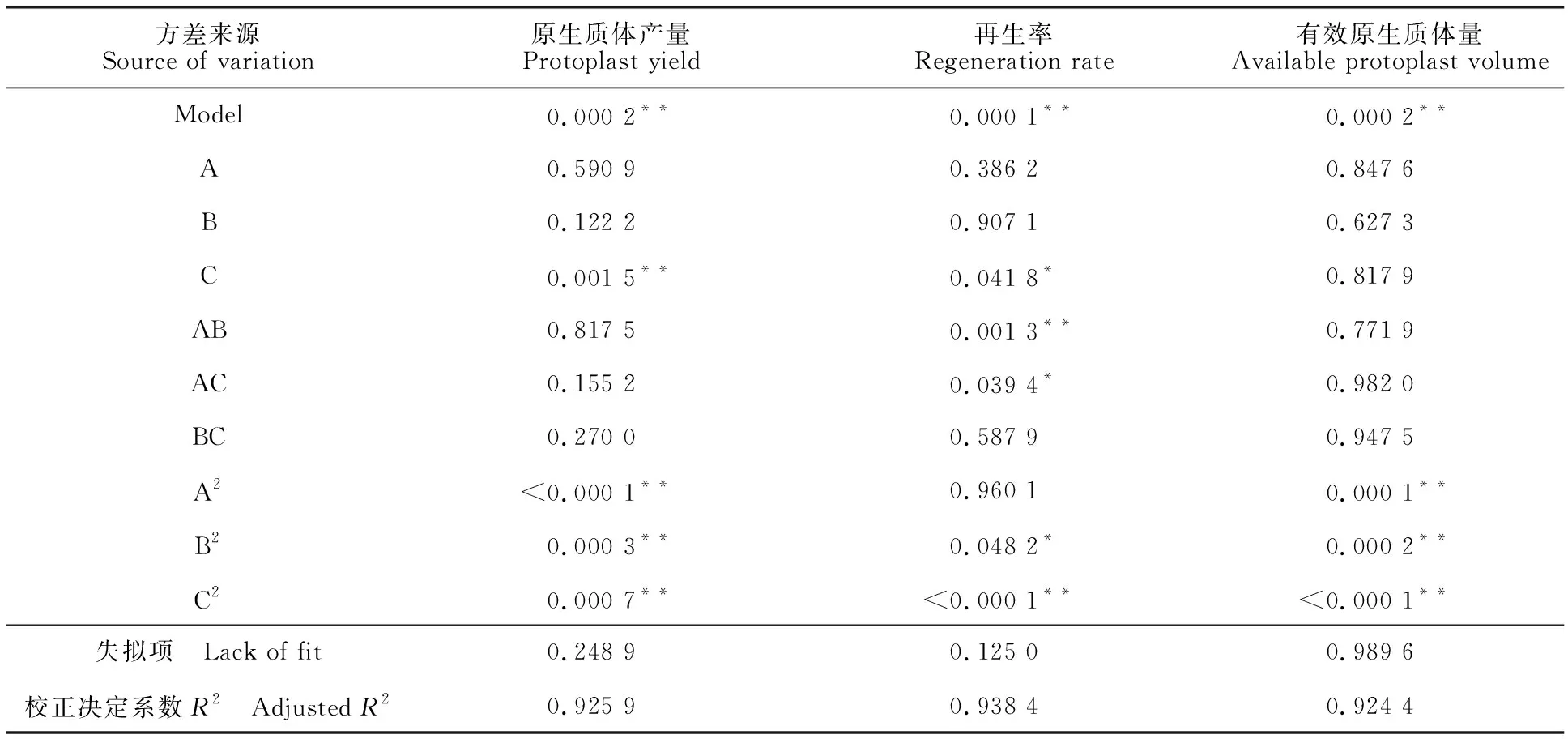
表3 回归方程的显著性检验及方差分析Table 3 Significance test and varianceanalysis of regression equation

图5 各因素交互作用对枸杞内生真菌NQ8GⅡ4菌株原生质体产量(A1~A3)、再生率(B1~B3)、有效原生质体产量(C1~C3)影响的响应面图Fig.5 Response surface graphs for effect of interaction of various factorson protoplast yield (A1~A3), regeneration rate (B1~B3), available protoplast volume (C1~C3) of NQ8GⅡ4 strain
2.2.4 验证试验 根据Design Expert 12.0软件分析结果,得到枸杞内生真菌NQ8GⅡ4菌株最佳原生质体制备条件为,以0.713 mol/L NaCl为稳渗剂,称量0.05 g菌龄为16 h的菌丝于 1 mL 30.30 g/L崩溃酶+10 g/L溶壁酶的混合酶液中酶解2.5 h。在此条件下进行5次试验,结果显示优化后NQ8GⅡ4菌株原生质体平均产量可以达到7.12×107mL-1,与预测值 6.81×107mL-1相差4.56%;再生率平均为 5.56%,与预测值5.67%相差1.98%;有效原生质体量平均为39.59×105mL-1,与预测值 38.53×105mL-1相差2.75%。证明该模型是可靠的。优化后产生的原生质体大小均匀,球体圆润,菌丝很少(图6),可以进行下一步试验。

A.萌发16 h的枸杞内生真菌NQ8GⅡ4菌株菌丝体;B.枸杞内生真菌NQ8GⅡ4菌株原生质体;C.枸杞内生真菌NQ8GⅡ4菌株原生质体再生
3 讨 论
原生质体制备与再生是两个相互联系的过程,原生质体的产量和再生率是评价原生质体制备质量的评价指标[26]。获得一定浓度、纯度和活力的原生质体是进行分子遗传学操作的基础和前提保障之一[28]。关于丝状真菌原生质体制备国内外已有不少的研究报道,但是由于细胞壁结构较为复杂,组成成分较为多样,针对特定的丝状真菌菌株,必须具体分析,综合考虑,方能得到适合该菌株的原生质体制备条件[29]。本研究通过单因素试验,证明菌龄、酶质量浓度、酶解时间、稳渗剂浓度等条件对枸杞内生真菌NQ8GⅡ4菌株原生质体制备和再生均有影响。单因素条件下NQ8GⅡ4菌株原生质体制备的最佳条件为:菌龄16 h的菌丝0.05 g于1 mL 30 g/L崩溃酶+10 g/L溶壁酶的混合酶液中反应2.5 h;以0.7 mol/L NaCl作为稳渗剂,原生质体平均产量为6.71×107mL-1,再生率平均为5.85%,有效原生质体量平均为39.29×105mL-1。其中,菌龄主要影响细胞壁的结构、菌体代谢水平和菌体活力。菌龄过短,菌丝细胞壁太薄,产生的原生质体易破碎,导致原生质体产量和再生率都较低;当菌龄过长时,细胞壁增厚,不易酶解,导致原生质体产量及再生率下降[18]。当酶质量浓度较低时,酶解能力较弱,得不到大量的原生质体;酶质量浓度过高时,过量的酶会继续降解原生质体,导致原生质体产量和再生率降低[30]。酶解时间短,菌丝不能充分酶解产生的大量原生质体;而酶解时间过长,已形成的原生质体被酶解,原生质体上失去再生的细胞残壁引物,导致原生质体产量和再生率下降[31]。稳渗剂不仅会维持原生质体细胞膜的渗透压保护原生质体,对酶的活性也有促进作用。稳渗剂浓度过高,不利于原生质体产生,且会使生成的原生质体失水皱缩;而当稳渗剂浓度过低时,则会使原生质体吸水膨胀,体积变大,易于破裂[32]。
本研究以单因素试验确定的原生质体制备的最适条件为基础,进行响应面多因素优化试验,确定酶解时间、酶质量浓度、稳渗剂浓度三因素对原生质体产量、再生率、有效原生质体量的组合效应;得出枸杞内生真菌NQ8GⅡ4菌株原生质体最佳制备条件为:以0.713 mol/L NaCl为稳渗剂,称量0.05 g菌龄为16 h的菌丝于1 mL 30.30 g/L崩溃酶+10 g/L溶壁酶的混合酶液中酶解2.5 h,原生质体产量平均为7.12×107mL-1,再生率平均为5.56%,有效原生质体量平均为39.59×105mL-1,与模型预测值 38.53×105mL-1拟合较好,相对于单因素试验结果提升 0.76%。这是因为单因素分析中各因素的设定是固定梯度差,只能表现出最佳制备条件的趋势,最佳制备条件不能反映,并且试验处理仅为一个方向,各因素之间的相互作用不能体现出来,而响应面分析不仅可以反映出各因素连续变化对于响应值的作用,还可以反映出各因素之间的相互作用以及各因素相互作用下的理论最佳条件[33]。
4 结 论
建立良好稳定的原生质体制备技术是进行分子遗传学操作的关键步骤之一。本研究在单因素试验的基础上,采用Box-Behnken设计的响应面法进一步优化该菌株原生质体的制备和再生条件,建立以枸杞内生真菌NQ8GⅡ4菌株的原生质体产量、再生率和有效原生质体量为响应值,以酶解时间、酶质量浓度和稳渗剂浓度为自变量的三元二次回归方程。经验证,模型合理可靠,能够准确反映NQ8GⅡ4菌株原生质体产量与再生率。NQ8GⅡ4菌株原生质体最佳制备条件为:以 0.713 mol/L NaCl为稳渗剂,菌龄16 h的菌丝 0.05 g于1 mL 30.30 g/L崩溃酶+10 g/L溶壁酶的混合酶液中酶解2.5 h,原生质体产量平均为7.12×107mL-1,再生率平均为5.56%,有效原生质体量平均为39.59×105mL-1。本研究结果为枸杞内生真菌NQ8GⅡ4菌株遗传改造和后续的分子遗传学研究奠定基础。

