外源反硝化菌投加对湖水细菌群落的影响
杨 康,王路逸,吴泽宇,童 蕾,冯 亮
(1.中国地质大学(武汉)生物地质与环境地质国家重点实验室,湖北 武汉 430074;2.中国地质大学(武汉)环境学院,湖北 武汉 430074;3.湖南农业大学食品科学技术学院,湖南 长沙 410128)
湖泊污染会对湖泊水生生态系统和社会服务功能造成严重影响。由于多数湖泊与外部系统处于半连通甚至不连通状态,物质循环效率降低,大量污染物质排放到湖泊后会产生富集,使湖泊水体的颜色和透明度发生改变,产生异味。宏观上会引起生态系统内动植物的死亡,降低物种多样性,带来恶性循环;微观上会改变湖泊水体和沉积物中微生物的群落结构,进一步影响物质的生物地球化学循环过程[1-3]。

自然作用输入到湖泊生态系统中的氮元素通过生物地球化学循环可以保持动态的稳定,其中30%~50%的氮可以通过微生物反硝化作用去除。反硝化过程大多发生在湖泊深水—底泥界面,主要因为反硝化细菌多为异养兼性厌氧细菌,深水—底泥界面存在有氧—无氧的环境,有利于细菌的生长。随着城镇化发展,城市湖泊中人为输入了大量的氮元素,造成水体和沉积物中氮元素富集,所以对污染湖泊沉积物中的反硝化过程和细菌群落特征的动态变化有较多的研究,但在治理湖泊污染过程中,特别是加入外源反硝化细菌后,反硝化细菌在水体中的作用时间以及水体中细菌群落的变化特征还没有明确的研究结果[14-16]。
为此,本试验利用江汉平原某湖泊现场治理项目,将地衣芽孢杆菌菌粉添加到湖水中设置的3根试验管中,利用基因定量和高通量测序技术对外源菌种加入后的有效作用时间以及对湖水中原位细菌群落组成的影响进行研究。
1 材料与方法
1.1 研究区域概况
本研究的污染湖泊位于江汉平原中南部,水域面积约0.24 km2,平均水深为2 m,蓄水量为40万~54万m3,属平原浅水型湖泊,以泥沙沉积为主,水体较为独立。湖泊北岸为生态公园和住宅区,南岸及西岸为耕种区和林区,通过调查发现该湖泊主要污染源为生活废水和农业活动。
1.2 样点设置及采样
于2018年8月份展开试验,以湖泊北岸作为试验区,区域内平均水深为1.9 m,在湖水中插入3根长度为2 m、直径为50 cm的波纹管(每根管中湖水体积约为0.37 m3),于8月19日向其中分别添加地衣芽孢杆菌菌粉0 g、2 g、20 g,使加入菌数分别约为0 CFU/m3(A管)、5.4×1010CFU/m3(B管)、5.4×1011CFU/m3(C管),分别于8月20日、22日、24日、26日取波纹管中的水样样品用于后续研究(A0表示20日在A管中采集的样品,A2表示22日在A管中采集的水样样品,依此类推)。
根据《水质采样技术规程》(SL 187—96),使用水样采集器分别从3根试验管中采集表层(0.5 m处)水样6 L左右,并使用正压过滤器让水样通过6张直径为100 mm、孔径为0.22 μm的水系微孔滤膜(Whatman,英国),将带有细菌生物量的滤膜装入50 mL无菌离心管中冷冻保存,之后运往中国地质大学(武汉)地质微生物实验室,于-80℃保存,用于后续分析。
1.3 试验材料
试验材料有地衣芽孢杆菌菌粉(1×1010CFU/g,购自武汉科诺生物科技股份有限公司)、50 cm波纹管、正压过滤器、0.22 μm水系微孔滤膜、50 mL康宁无菌离心管。
1.4 荧光定量PCR
按照Mag-BindSoil DNA Kit(OMEGA,美国)试剂盒的使用说明从3张滤膜提取样品总DNA。试验选取细菌的napA和nosZ两种反硝化基因进行定量分析,其中引物设计为napA:F(5′-AAYATGGCVGARATGCACCC-3′),R(5′-GRTTRAARCCCATSGTCCA-3′)[17];nosZ: F(5′-CGCRACGGCAASAAGGTSMSSGT-3′),R(5′-CAKRTGCAKSGCRTGGCAGAAT-3′)[18]。各基因定量均使用Power qPCR PreMix(GENEray,GK8020)试剂盒。
构建15 μL的PCR反应体系:1 μL DNA模板,各0.7 μL(10 μmol/L)上游引物和下游引物、7.5 μL 2×SYBR Green Mix (Takara),5.1 μL超纯水。荧光定量PCR仪(BIO-RAD MJ Mini TM,美国)程序为:95.0 ℃预变性5 min,94.0℃变性10 s,退火(napA57 ℃,nosZ58 ℃)30 s,72.0 ℃延伸1 min,40个循环后72.0 ℃延伸10 min。PCR仪联机用CFX Manager Software进行实时数据采集与分析,并依据文献[19]制作标准曲线,计算得出目的基因的拷贝数(copies/μL)。
1.5 高通量测序
1.5.1 DNA提取与测序
按照QIAamp Fast DNA Stool Mini Kit(上海赛百盛公司)说明书从含生物量的3张微孔滤膜提取样品总DNA,并通过0.8%琼脂糖凝胶电泳检测提取质量,采用紫外分光光度计对DNA定量。以提取的总DNA为模板,对细菌16S rDNA基因的V4区进行PCR扩增,扩增引物为细菌16S rDNA V4区特异性引物520F(5′-AYTGGGYDTAAAGNG-3′)和802R (5′-TACNVGGGTATCTAATCC-3′),前引物设计一条7个碱基的寡核苷酸序列作为barcode用以区分同一文库中的不同样品。PCR反应体系为:2 μL DNA模板,10 μL 5×PCR Buffer(Promega),2 μL dNTPs,正、反向引物各1 μL,8.75 μL无菌水,0.25 μL高保真DNA聚合酶,共25 μL。PCR反应条件为:98℃预变性30 s,98℃变性30 s,50℃退火30 s,72℃延伸30 s,共25个循环,循环完成后72℃延伸5 min。扩增产物经2%琼脂糖凝胶电泳检测后对目标条带使用AxyPrep DNA Gel Extraction Kit (Axygen,美国)试剂盒进行切胶回收、纯化。
根据电泳初步定量结果,采用Quant-iT PicoGreen dsDNA Assay Kit蓝色荧光试剂对PCR产物进行荧光定量,仪器为Microplate reader(BioTek, FLx800)。通过Axyprep DNA Gel Extraction Kit对PCR扩增产物进行纯化,检测合格的PCR纯化产物进行16S rDNA基因高通量测序,由上海派森诺生物科技股份有限公司完成。每个样本获得双端序列数据为3万~5万个Reads。根据测序Reads之间Overlap关系进行拼接(Merge),同时对Reads质量和Merge效果进行质控过滤,根据序列首尾两端的Barcode和引物序列区分,优化有效序列,并进行后续分析。
1.5.2 数据处理与统计分析
利用Usearch 7.1(http://drive5.com/uparse/)平台,按照97%相似性对非重复序列(不含单序列)划分不同的可操作分类单元(operational taxonomic unit, OTU),得到OTU代表序列,并参照SILVA数据库(v132 NR)进行物种注释[20-21]。将OTU表细化为每个样本的等序数(n=24 805),重复1 000次,并使用QIIME在97%的同一性水平上计算α多样性和ANOSIM值,对样本内细菌群落多样性变化和样本组间差异显著性进行分析。使用R语言软件Vegan包,Vegdist及Hclust进行距离计算和聚类分析,并构建Heatmap图,距离算法为Bray-Curtis,聚类方法为Complete。
2 结果与分析
2.1 基因定量分析
napA和nosZ两种反硝化基因在环境中都广泛存在,但因为nosZ基因目前没有在革兰氏阳性细菌中发现,所以可以用这两种基因表征投加了地衣芽孢杆菌后水体反硝化能力的变化趋势。napA和nosZ反硝化基因在3组试验中的表达数量,见图1。

图1 napA和nosZ反硝化基因在3组试验中的表达数量Fig.1 Copy numbers of denitrification genes napA and nosZ in three experiments
由图1可见,空白对照组中,napA基因的拷贝数远多于nosZ基因,而且通过连续取样发现,nosZ基因拷贝数没有明显的变化趋势,对比napA基因拷贝数的变化趋势可以发现,其厌氧反硝化能力与投加地衣芽孢杆菌之间没有明显的相关关系,说明湖泊浅层水体中以好氧反硝化过程为主,厌氧反硝化过程在湖泊浅层水体中不占主导;加入2 g和20 g细菌菌粉后,湖泊浅层水体中napA基因拷贝数的增加与细菌菌粉投加量有关,其投加量越多,好氧反硝化基因的增加也越明显;整体变化趋势显示,加入2 g和20 g细菌菌粉在稳定水体中napA基因的拷贝数没有太大差别,且随着时间的推移,napA基因的拷贝数在后两次取样时已经趋于平稳,表明外源反硝化细菌在湖泊浅层水体中的存活时间约为4~6 d。
2.2 微生物群落多样性及组成分析
不同水样样品的细菌群落多样性指数,见表1。
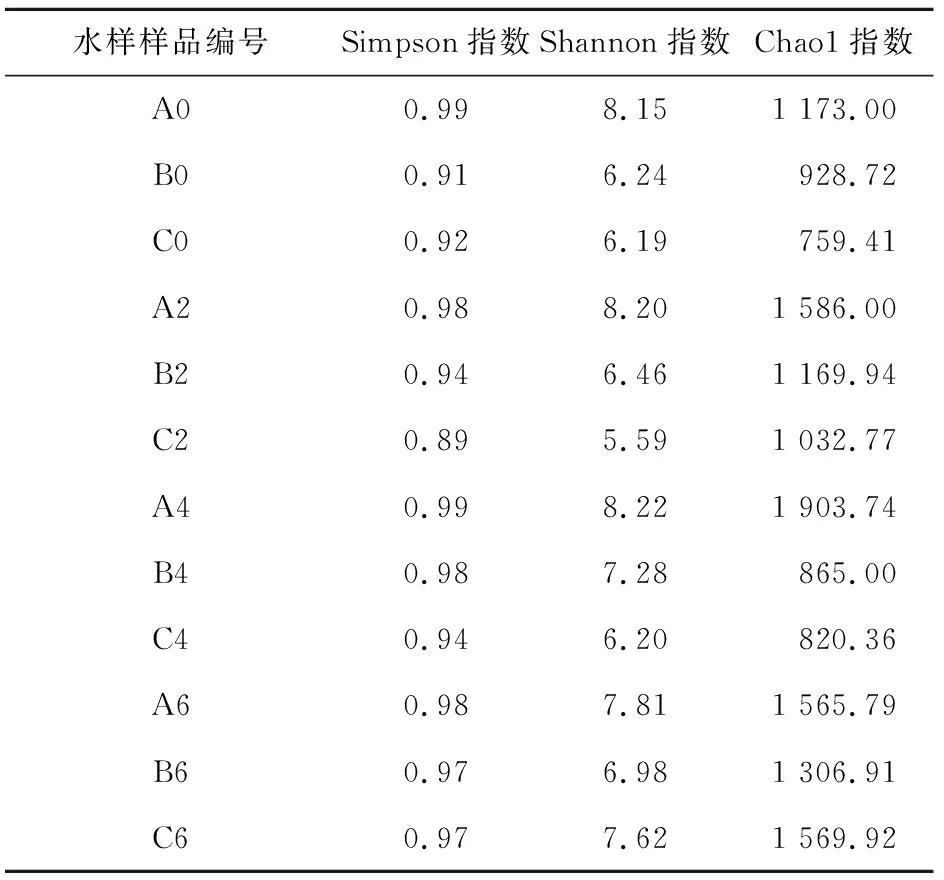
表1 不同水样样品的细菌群落多样性指数Table 1 Diversity index of bacterial communities ofdifferent water samples
根据样本组间差异性检验(p<0.05)和表1可知:对照组中细菌群落多样性最高,Simpson指数平均值为0.985,在加入外源反硝化细菌后,其细菌群落多样性出现下降,其中加入2 g细菌菌粉试验组的Simpson指数最先降到最低值,第一次取样时为0.91,加入20 g细菌菌粉试验组的Simpson指数降幅最大,第二次取样时为0.89,表明群落中优势物种的多样性在降低;Shannon指数的变化结果与Simpson指数一致,分别为6.24、5.59,表明群落的丰富度在减少,而且添加外源反硝化细菌的量越多,降低细菌群落多样性的效果越明显,这在Chao1指数中也有所体现。
图2显示了在加入地衣芽孢杆菌菌粉后湖泊水体中细菌群落在纲水平上的相对丰度变化。

图2 加入地衣芽孢杆菌菌粉后湖泊水体中细菌 群落在纲级别上的相对丰度变化Fig.2 Relative abundance change of bacterial community at class level in the lake after adding Bacillus licheniformis powder
由图2可以看出:
(1) Gammaproteobacteria虽然随时间的延长占比逐渐下降,但对比3组试验结果发现投加的细菌菌粉越多,其在细菌群落中的占比越高,相比之下,投加地衣芽孢杆菌菌粉则会抑制Betaproteobacteria和Alphaproteobacteria的生长,而且其投加量越多,它们在各自群落中的占比越少;Acidimicrobiia和Actinobacteria在对照组中的占比最高,投加细菌菌粉降低了它们在细菌群落中的相对丰度,而且添加的细菌菌粉量越多其降低的也越多。虽然投加的地衣芽孢杆菌属于Bacilli,但Bacilli的相对丰度在投加细菌菌粉后并没有随细菌数量的增多而上升,后面其相对丰度虽有上升,但没有表现出与细菌菌粉投加量的相关性。
(2) 不同的细菌类群在投加细菌菌粉后的相对丰度随取样时间的变化表现出不同的变化趋势。加入2 g细菌菌粉后,Gammaproteobacteria的相对丰度由76.3%下降到39.6%和6.3%,之后上升到59.7%,表现为先下降后增长;Betaproteobacteria的相对丰度由5.67%上升到10.47%和11.97%,之后下降到2.27%;Alphaproteobacteria的相对丰度由0.27%增长到1.3%,随后又下降到0.63%,表现为先增长后下降;Acidimicrobiia的相对丰度由24%下降到0.2%,之后上升到1.1%;Actinobacteria的相对丰度由14%下降到0.13%,之后上升到0.97%和1.67%;Bacilli的相对丰度由7.63%下降到3.13%和1.83%,之后增长并保持在2.0%的水平,都表现为先下降后增长的变化趋势。
(3) 加入20 g细菌菌粉后,Gammaproteobacteria的相对丰度表现出与前一个试验组相反的变化趋势,其由69.83%增长到77.13%,随后下降到18.93%和3.17%,表现为先增长后下降;Betaproteobacteria的相对丰度由8.63%下降到5.07%,随后增长到10.2%和11.23%;Alphaproteobacteria的相对丰度由3.4%下降到0.43%,随后上升到1.13%和13.8%,表现为先下降后增长;Actinobacteria的相对丰度下降到0.07%,之后增长到0.17%、0.47%和15.87%;Actinobacteria的相对丰度下降到0.13%,之后增长到1.07%和25.77%;Bacilli的相对丰度下降到3.67%和0.23%,之后增长并保持在2%的水平,均表现为先下降后增长的变化趋势。
2.3 细菌群落代谢功能预测
在了解了外源反硝化细菌对表层湖水细菌群落的影响后,进一步探究湖水细菌群落所具备的代谢功能对了解外源反硝化细菌带来的湖水细菌群落代谢功能变化具有重要的指示意义。
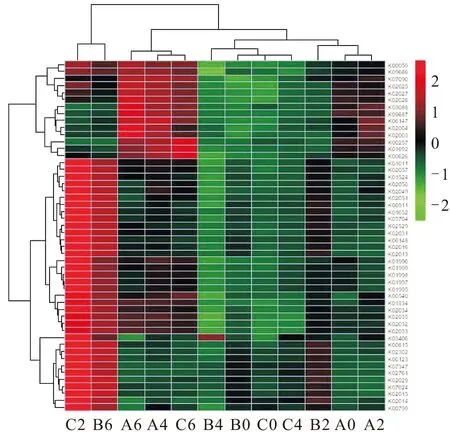
图3 湖泊细菌群落功能类群聚类丰度热图Fig.3 Heatmap of cluster analysis of bacterial community metabolism functions
通过对湖水细菌群落丰度前50位的功能类群分布进行聚类并制作丰度热图(见图3),结果发现:在加入2 g细菌菌粉后,湖水细菌群落反硝化能力呈现出逐步增强的趋势,到第8 d取样时硝酸盐代谢占主导地位,表明湖水细菌群落功能以反硝化过程为主;在加入20 g细菌菌粉4 d后,与反硝化过程相关的蛋白数量增多,如K02050、K02049、K02051等与硝酸盐转运相关的结合蛋白,说明湖水细菌群落参与反硝化过程的能力增强,在第8 d取样时,烯酰辅酶A(K01692)和乙酰辅酶A酰基转移酶(K00626)增多,表明湖水细菌群落代谢转为以有机氮代谢为主。
3 讨 论
经过一段时间的治理后该湖泊污染状况有了明显的好转(总氮含量由治理前的2.67 mg/L降为治理后的1.03 mg/L)。通过一段时间的取样、试验和分析,添加外源反硝化细菌用以增强湖水中细菌除氮能力也得到验证。
本项目所处湖泊浅层水体中细菌群落以Proteobacteria、Actinobacteri、Firmicutes和Bacteroidetes 4个门类的细菌为主,其中Proteobacteria主要包括Betaproteobacteria(21.4%)、Gammaproteobacteria(12.0%)、Alphaproteobacteria(7.6%)3个纲,Actinobacteria主要包括Acidimicrobiia(29.7%)、Actinobacteria(7.4%)2个纲,Firmicutes以Bacilli为主。这与前人对富营养化湖泊水体中关于细菌群落的研究结果相一致[22]。
添加不同量的外源反硝化细菌对湖泊浅层水体中不同类群微生物相对丰度的影响有所不同,Gammaproteobacteria的相对丰度在加入2 g细菌菌粉后先下降后上升,而在加入20 g细菌菌粉后则其先上升后下降,Betaproteobacteria和Alphaproteobacteria的相对丰度的变化趋势则与之相反,Acidimicrobiia、Actinobacteria、Bacilli的相对丰度在两组试验组中的变化趋势均为先下降后增长。同时,添加不同量的细菌菌粉对湖泊浅层水体中细菌群落反硝化能力的影响也不同,尽管Bacilli是群落中好氧反硝化的优势物种,但物种相对丰度与细菌菌粉添加量之间没有明显的相关性,使得湖泊浅层水体中细菌群落反硝化能力与细菌菌粉添加量和时间之间也没有明显的相关性。
基因定量的结果显示,添加的地衣芽孢杆菌在湖泊浅层水体中的维持周期仅为4 d左右,细菌群落多样性也显示在加入细菌菌粉后第4 d,细菌群落物种数有上升的趋势,且多样性指数可以恢复到对照组的水平。前文已述,微生物反硝化过程主要发生在深水—底泥界面,本研究关注于湖泊浅层水体中微生物群落的变化,没有对湖泊深层水体和湖泊沉积物中微生物群落进行深入研究,因而无法确定添加的地衣芽孢杆菌在湖泊水体中的垂直分布和定殖情况,以及对湖泊深层水体和沉积物中原有微生物群落的影响。有前人利用富营养湖泊沉积物研究其中的好氧反硝化细菌的群落特征发现,淡水环境下水库、湖泊的沉积物中以厚壁菌门(Firmicutes)为主,湖水的一些理化性质是影响湖泊深层水体和沉积物中微生物群落的主要因素[23-24]。因为本研究中添加的地衣芽孢杆菌细菌菌粉含有培养基成分,水体的物理化学性质,如pH值、无机盐、氮磷含量等在细菌菌粉被溶解后会发生改变,细菌菌粉中的营养元素在为地衣芽孢杆菌生长繁殖提供需要的同时也促进了细菌群落中其他微生物的生长繁殖,增加了地衣芽孢杆菌的生长竞争,这从湖泊水体中藻类的数量统计结果和Bacilli纲细菌的群落变化特征中可以看出。对于此类因素的影响在本研究中没有体现,这是在以后的湖泊治理和研究中需要特别关注的,只有这样才能更全面地了解利用反硝化细菌治理地表水污染时水体反硝化能力的变化。
4 结 论
通过控制外源反硝化细菌(地衣芽孢杆菌)添加量,利用基因定量和16S rDNA测序技术研究其对污染湖泊浅层水体中细菌群落组成结构和代谢类群的影响,得到以下主要结论:
(1) 在污染湖泊水体治理过程中,添加外源反硝化细菌是利用微生物去除水体中氮素的有效方法之一,但添加的外源反硝化细菌地衣芽孢杆菌不能长时间在湖泊浅层水体中聚集,聚集时间通常在4 d左右。
(2) 湖泊浅层水体中细菌群落主要由属于Proteobacteria、Actinobacteria、Firmicutes和Bacteroidetes 4个门的细菌组成,添加外源细菌后对湖泊水体中原位细菌群落的影响包括降低细菌群落多样性、改变群落组成和增强群落反硝化能力。
(3) 添加2 g细菌菌粉(约5.4×1010CFU/m3)可以持续增强污染湖泊水体中细菌群落的反硝化能力,添加20 g细菌菌粉(约5.4×1011CFU/m3)可以短时间内(2 d)增强污染湖泊水体中细菌群落的反硝化能力,但从实际应用情况来看,更多的外源菌种的加入,其反硝化能力并没有随之增强,因此需通过试验选取适当的投加浓度。

