甜叶菊中莱苞迪苷D、莱苞迪苷A含量测定方法的优化及应用
郭志龙 陈 任 马 茜 孙 放 张 虹 张自萍,*
(1 宁夏大学西部特色生物资源保护与利用教育部重点实验室,宁夏 银川 750021; 2 宁夏大学生命科学学院,宁夏 银川 750021)
随着生活水平的不断提高,低糖健康饮食逐渐成为人们所追求的目标,甜菊糖苷因具有高甜度、低热量的特性引起了高度关注[1-2]。甜叶菊[Steviarebaudiana(Bertoni) Hemsl.]含有莱苞迪苷(rebaudioside,R)A、C、D、E,甜菊苷(stevioside,ST)以及杜尔可苷(dulcoside,D)A、C等多个种类甜菊糖苷[3]。由于不同种类甜菊糖苷在甜菊醇骨架上所连糖残基种类、数量不同[4],因此表现出不同的甜度和口感,其中RD、RA甜味品质较好[5]。另外,RD和RA含量的占比是目前衡量甜叶菊品质的主要指标之一。不同品种甜叶菊生产的甜菊糖苷产品的糖苷组成及含量不同,导致产品的甜味品质也不同,因此选择适宜的甜叶菊品种进行产品开发显得极为重要。

传统C18柱是一种键合十八烷基官能团的色谱柱,对弱极性物质具有较好的保留能力;HSS T3色谱柱为Waters公司采用T3 bonding以及先进的封端技术获得的一款新型C18色谱柱,极性范围跨度大,可100%兼容水相且对极性化合物有很好的保留能力;Amide色谱柱属亲水作用液相色谱,其以强极性官能团为固定相,高比例有机相为流动相,保留机理虽与氨基键合相色谱柱类似,却具有比氨基键合相色谱柱更长的柱寿命,也避免了氨基柱中重复性较差、柱平衡耗时长的问题[20]。由于甜菊糖苷是一类极性较强的化合物,本研究尝试以传统C18、HSS T3和Amide 3种类型色谱柱为固定相,建立并优化适用于甜叶菊中RA、RD不同种类甜菊糖苷的HPLC分析测定方法,通过对12个扦插培育的不同品系甜叶菊中甜菊糖苷进行含量测定与分析,旨在为实际应用中选择适宜的甜叶菊品种进行产品开发利用提供借鉴和指导。
1 材料与方法
1.1 试验材料与试剂
12个甜叶菊品系均由宁夏优势特色作物现代分子育种重点实验室提供,利用植物培养专用智能温室(光照:自然光照;温度:25±5℃;湿度:70%±20%)同时扦插培育,将各品系甜叶菊叶片于相同时间(2018年8月6日,开花前)分别采摘,自然阴干后,粉碎过40目筛备用。
甜菊苷(ST)、莱苞迪苷A(RA)、莱苞迪苷B(RB)、莱苞迪苷C(RC)、莱苞迪苷D(RD)标准品,纯度98%,甜茶苷(rubusoside, RBS),纯度≥98%,上海甄准生物科技有限公司;莱苞迪苷E(RE),纯度Grade P,美国Chromadex公司;莱苞迪苷F(RF),纯度72.5%,杜尔可苷A(DA)、甜菊双糖苷(steviolbioside, SB),纯度98%,日本Wako公司;甲醇、乙腈(色谱纯),美国Fisher公司。
1.2 主要仪器与试剂
CQ-250-DST超声波清洗机,上海跃进医用光学器械厂;RE-52A旋转蒸发仪,上海亚荣生化仪器厂;Visiprep真空固相萃取装置,美国Supelco公司;Waters XBridge®C18色谱柱(250 mm×4.6 mm,5 μm)、Waters Xselect®HSS T3色谱柱(250 mm×4.6 mm,5 μm)、Waters XBridge®BEH Amide色谱柱(250 mm×4.6 mm,5 μm)、2695高效液相色谱仪,美国Waters公司。
1.3 试验方法
1.3.1 样品溶液的制备 取0.2 g甜叶菊叶片粉末,加入5 mL 70%乙醇,于60℃水浴超声提取30 min,2 400 r·min-1离心10 min。重复提取2次,合并上清液常压过滤,收集滤液于45℃减压浓缩至5 mL,经0.22 μm滤膜过滤后进行固相萃取(solid-phase extraction,SPE)纯化处理。
参考Bovanová等[21]和Woelwer-Rieck等[22]的SPE处理方法并略做改进,具体操作如下:先用10 mL甲醇活化SPE C18小柱(Waters Sep-Pak®Vac 6cc,1 g),然后加入5 mL水置换甲醇,取样品溶液2.5 mL上样,依次用5 mL水和8 mL 25%乙腈淋洗,最后加入2.5 mL 80%乙腈解析,收集解析液,经0.22 μm滤膜过滤后进行HPLC分析。
1.3.2 HPLC方法的建立及优化
1.3.2.1 色谱柱的选择 通过对比分析C18、HSS T3和Amide 3种不同色谱柱对甜叶菊中甜菊糖苷的分离效果,选择确定适宜的色谱柱为固定相建立并优化色谱分析条件。
1.3.2.2 色谱分析条件的建立及优化 在1.3.2.1试验结果的基础上确定适宜的色谱柱为固定相,摸索建立甜叶菊中甜菊糖苷含量测定的色谱分析条件,并对流动相组成、柱温、洗脱方式、流速等色谱条件进行优化,从而确定适用于甜叶菊中甜菊糖苷分离测定的HPLC方法。
1.3.2.3 色谱分析方法学评价
(1)线性关系。依次配制100、500、1 000、3 000、6 000 μg·mL-1浓度梯度的RA标准品溶液;93.75、187.50、375.00、750.00、1 500.00 μg·mL-1浓度梯度的ST标准品溶液;187.5、375.0、750.0、1 500.0、3 000.0 μg·mL-1浓度梯度的RC标准品溶液;135.94、271.88、543.76、1 087.50、2 175.00 μg·mL-1浓度梯度的RF标准品溶液,之后进行HPLC分析;依次配制31.25、62.50、125.00、250.00、500.00 μg·mL-1浓度梯度的RD标准品溶液,之后进行HPLC分析。
(2)精密度。取甜菊糖苷混合标准品溶液分别在色谱柱上重复进样5次,以峰面积计算RA、ST、RF、RC、RD甜菊糖苷的相对标准偏差(relative standard deviation, RSD)。
(3)重复性。分别取0.2 g甜叶菊叶粉末共6份,平行制备6份样品溶液,进行HPLC分析,以峰面积计算各甜菊糖苷组分的RSD。
(4)稳定性。取甜菊糖苷样品溶液,分别于4℃放置0、4、8、12、24 h后进行HPLC分析,考察样品溶液的稳定性。
(5)准确度。分别取0.2 g甜叶菊样品粉末共5份,平行制备5份样品溶液,分别添加适量的RA、ST、RC、RF、RD标准品溶液后进行HPLC分析,计算各甜菊糖苷的平均回收率。
(6)检测限和定量限。依次取RA、ST、RC、RF、RD标准品溶液进行HPLC分析,测其保留时间处的响应值与基线噪音值,计算信噪比,以信噪比约为3∶1时的浓度作为检测限,以信噪比约为10∶1时的浓度作为定量限。
1.3.3 不同品系甜叶菊中甜菊糖苷含量测定与分析 取12个品系甜叶菊叶粉末各0.2 g,按1.3.1方法制备样品溶液,依次进行HPLC分析。
1.4 数据分析
采用 Microsoft Excel 2016 进行试验数据的整理和计算,采用Empower 2软件以及GIMP 2软件进行图像处理。
2 结果与分析
2.1 HPLC方法的建立及优化
2.1.1 色谱柱的确定 本试验首先参照GB 8270-2014[11]中HPLC条件考察了传统反向C18色谱柱对RA的分离能力,结果表明,RA标准品(图1-A)与甜叶菊中RA(图1-B)均不能在C18色谱柱上与ST基线分离,表明C18色谱柱对甜菊糖苷的选择性较差,不适用于测定甜叶菊中的RA。
为改善RA的分离效果,选择了对极性化合物保留能力比较强的新型反向HSS T3色谱柱,结果表明,RA标准品(图1-C)以及甜叶菊中RA(图1-D)均能在HSS T3色谱柱上与ST基线分离,而且色谱峰整体分离度也优于C18色谱柱,解决了C18色谱柱上RA和ST分离度差的问题,表明HSS T3色谱柱可用于测定甜叶菊中的RA。

图1 RA、ST标准品以及甜叶菊中RA、ST在C18(A、B)色谱柱和HSS T3(C、D)色谱柱上的HPLC效果Fig.1 HPLC chromatograms of RA, ST in reference standard and Stevia rebaudiana Bertoni on C18 (A, B) and HSS T3 (C, D) columns
进一步试验发现HSS T3色谱柱可同时分离RA、ST、RF、RC、DA、RBS、RB、SB 8种标准物(图2-A),还可同时分离甜叶菊中RA、ST、RF、RC、RBS、RB、SB 7种甜菊糖苷(图2-B)。
但RD在HSS T3柱上的分离效果并不理想,RD出峰时间过于靠前,不仅标准品RD、RE之间分离度较差(图3-A),而且由于甜叶菊中RD含量较低,杂峰干扰严重(2~4 min),无法采用HSS T3对甜叶菊中的RD含量进行测定(图3-B)。
Amide为一种亲水作用色谱(hydro philic interaction liquid chromatography, HILIC)模式的色谱柱,其保留机理与传统正相液相色谱类似,通过试验发现Amide柱上不仅可以避免标准品RD和RE间分离度较差的问题(图3-C),而且甜叶菊中RD也可与其他杂质成分达到基线分离(图3-D)。因此,后续试验采用Amide色谱柱对甜叶菊中RD含量进行测定。

Note:1: RA. 2: ST. 3: RF. 4: RC. 5: DA. 6: RBS. 7: RB. 8: SB.图2 多个种类甜菊糖苷标准品(A)和甜叶菊(B) 在HSS T3柱上的HPLC效果Fig.2 HPLC chromatograms of various steviol glycosides referencestandards (A) and Stevia rebaudiana Bertoni (B) on HSS T3 column
2.1.2 色谱分析条件的确定 对比分析C18、HSS T3、Amide 3种色谱柱对甜叶菊中甜菊糖苷的分离效果,选择HSS T3和Amide色谱柱为固定相,通过对流动相组成、柱温、洗脱方式、流速等色谱条件进行优化,确定甜叶菊中甜菊糖苷类化合物的色谱分析条件为:
以HSS T3色谱柱为固定相,乙腈∶0.01%磷酸=32∶68(v∶v)为流动相,等度洗脱,柱温40℃,检测波长210 nm,进样量10 μL,流速1.0 mL·min-1,采用该HPLC方法可对甜叶菊中RA、ST、RF、RC、RBS、RB、SB 7种甜菊糖苷进行检测分析。
以Amide色谱柱为固定相,乙腈∶水=76∶24(v∶v)水为流动相,等度洗脱,柱温40℃,检测波长210 nm,进样量10 μL,流速0.8 mL·min-1,采用该HPLC方法对甜叶菊中RD进行检测分析。
2.1.3 色谱分析方法学评价 以质量浓度为横坐标,峰面积为纵坐标进行线性回归分析,得RA回归方程为y=1 419.2x+133 826,r=0.999 1,线性范围100.00~6 000.00 μg·mL-1;ST回归方程为y=2 437.9x+44 502,r=0.999 5,线性范围93.75~1 500.00 μg·mL-1; RC回归方程为y=530.49x-6 288.8,r=0.999 7,线性范围187.50~3 000.00 μg·mL-1;RF回归方程为y=1 745.6x+ 3 933.9,r=0.999 4,线性范围135.94~2 175.00 μg·mL-1;RD回归方程为y=456x+6 511.1,r=0.999 7,线性范围31.25~500.00 μg·mL-1, 结果表明该色谱分析条件下RA、ST、RC、RF、RD的线性关系良好。
由表1可知,精密度、重复性、稳定性试验结果RSD值均小于3%,表明该色谱分析条件精密度、重复性、稳定性良好;该色谱分析条件准确度良好。经测定分析,RA、ST、RC、RF、RD的检测限依次为30.00、25.33、56.85、41.78、9.98 μg·mL-1,RA、ST、RC、RF、RD的定量限依次为100.00、93.75、187.50、135.94、31.25 μg·mL-1。
2.2 不同品系甜叶菊中甜菊糖苷含量测定与分析
采用以HSS T3色谱柱和Amide色谱柱分别为固定相的HPLC方法对12个扦插培育的不同品系甜叶菊中甜菊糖苷进行分析测定。由表2可知,12个品系中均含有RA、ST、RF、RC;编号为1、2、3、4、5、6、7、8、10的9个品系中含有RD;编号4、6、9、10中含有DA;编号1、3、5、7中含有RB;编号2、3、5、6、7、8、11中含有SB;含有RBS的只有编号5和编号10两个品系,在12个品系中均未检测出RE。表明不同品系甜叶菊所含甜菊糖苷种类有所差异。

表1 精密度、重复性、稳定性以及准确度试验结果Table 1 The result of precision, repeatability, stability and accuracy /%

表2 12个甜叶菊品系中所含甜菊糖苷种类Table 2 The species of steviol glycosides in 12 different Stevia rebaudiana Bertoni strains
对12个甜叶菊品系中含量相对较多的RA、ST、RF、RC、RD进行定量分析,由表3可知,12个不同品系中甜菊糖苷总量介于63.36~167.31 mg·g-1之间,其中RA含量介于23.10~113.22 mg·g-1之间,ST含量介于1.47~40.13 mg·g-1之间,RC含量介于5.44~31.57 mg·g-1之间,RF含量介于4.22~15.40 mg·g-1之间,RD含量介于0~10.28 mg·g-1之间。
甜叶菊中的RD占比、RA占比以及RD+RA占比可作为衡量甜叶菊品质的主要指标之一。编号1、8中RA+RD占比较高,RA+RD占比分别为73.60%和73.69%,RA占比分别为66.14%、63.92%,RD占比分别为7.46%、9.77%,提示以编号1和8的甜叶菊品系为材料生产甜菊糖苷产品甜味品质较好;编号为11、7、5、3的4个品系中甜菊糖苷总量及RA占比较高,甜菊糖苷总量分别为167.31、145.88、153.71、140.71 mg·g-1, RA含量分别为113.22、101.18、100.06、95.16 mg·g-1, RA占比分别为67.67%、69.36%、65.10%、67.63%;编号2、8、1甜叶菊品系中RD含量较高,分别为10.28、8.02、5.40 mg·g-1,且RD占比分别为16.22%、9.77%、7.46%,以编号2甜叶菊品系中RD含量及占比最高,说明以编号2的甜叶菊品系为原材料可生产高含量的RD。综上,12个扦插培育的不同品系甜叶菊中RD、RA含量组成有较大差异,实际产生中应根据需要选择适宜的甜叶菊品种加以应用。
3 讨论

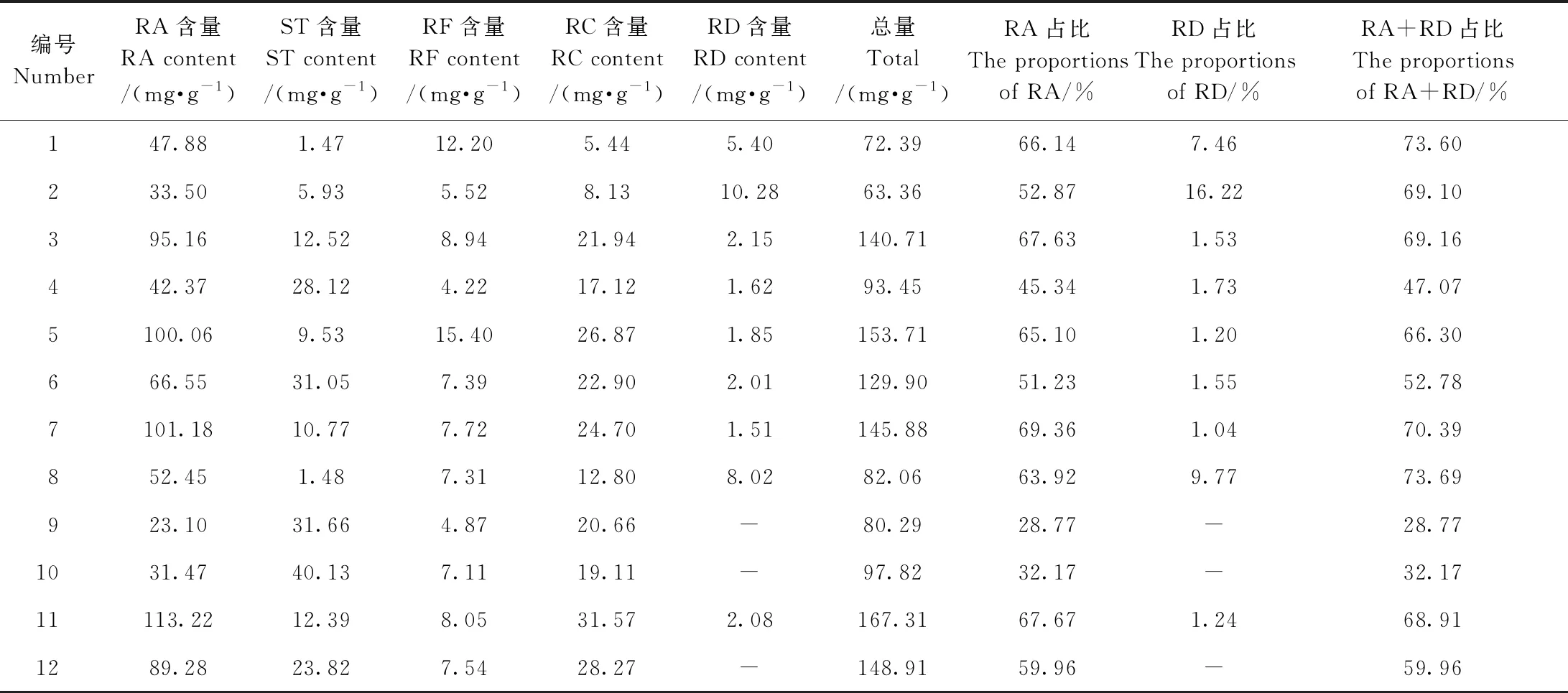
表3 12个甜叶菊品系中所含甜菊糖苷含量Table 3 The contents of steviol glycosides in 12 different Stevia rebaudiana Bertoni strains
不同种类甜菊糖苷甜味品质不同,甜叶菊中以RA甜味品质较好且含量较高[23-24],但研究发现100%纯度的RA仍是甜中带有苦涩后味[25];RD在甜叶菊中含量虽然比较少,却具有比RA更佳的甜味品质[26]。目前常采用酶法分子修饰[27-28]、微生物转化[26-29]等方式增加甜菊糖苷组合物中RA、RD含量,但存在产物活性不明、成本高等问题。不同品种甜叶菊中所含RA、RD含量比例具有差异,通过选择恰当品种的甜叶菊为原材料可以改善甜菊糖苷产品的味道,也可减少企业加工工序、提高生产效益。本研究比较分析了12个扦插培育的甜叶菊品系中RA、RD含量及其占比,结果提示以甜叶菊品系编号2为原材料可获得高产量RD,以甜叶菊品系编号1、8为原材料生产的甜菊糖苷产品甜味品质较好,而甜叶菊品系编号3、5、7、11富含RA且甜菊糖苷产量高,该结果可为实际应用中选择适宜的甜叶菊品种提供参考依据。
4 结论
甜菊糖苷是一类极性比较强的化合物,本研究在C18、HSS T3、Amide 3种不同色谱柱中选择确定Amide和HSS T3为较优色谱柱,并以其为固定相建立2种不同的HPLC分析测定方法,结果表明,本研究所建立的HPLC方法可适用于甜叶菊中RD、RA甜菊糖苷的分析研究。12个扦插培育的甜叶菊品系中所含甜菊糖苷有所差异,编号2的甜叶菊品系中RD含量及占比高,编号3、5、7、11的甜叶菊品系中甜菊糖苷总含量较高(主要为RA),编号1、8的甜叶菊品系中RA+RD占比较高,本研究结果可为实际应用中选择适宜的甜叶菊品种进行产品开发利用提供借鉴和指导。

