欧洲缬草不定根悬浮培养及其有效成分的测定
李文杰 宫 惠 李美阳
(延边大学农学院,吉林 延吉 133002)
欧洲缬草(ValerianaofficinalisL.)属于败酱科(Valerianaceae)缬草属(Valeriana)多年生草本植物,以根和根茎入药[1],具有镇静安神、解痉止痛的功效,多用于治疗神经衰弱、失眠、癫痫等病症[2]。现代药理研究表明,缬草三酯类(环烯醚萜酯类)成分是缬草镇静止痛的主要活性成分[3],同时还具有抗肿瘤、抗氧化和舒张血管活性的作用[4]。近年来,人们对缬草提取物及其制剂的需求日益增加,缬草活性成分的开发前景十分广阔。但该属植物自然生长十分缓慢,野生资源急剧下降,人工栽培缓慢,优质高产的遗传稳定性难以保持[5]。另外,缬草活性成分含量很低,提取成本高,结构复杂,化学合成尚不成功[6],极大限制了其市场开发与应用。因此,解决缬草三酯类活性化合物的药源问题十分必要。
国内外研究表明,许多物种的不定根可以稳定合成次生代谢物质,且已在何首乌[5]等药用植物中成功应用。缬草三酯类有效成分主要存在于缬草根和根茎中,因此,采用组织培养技术结合诱导调控手段大量繁殖缬草不定根,获得大量有效成分,是解决缬草资源开发和缬草提取物及其制剂供应不足等问题的有效手段。虽然国内外学者先后开展了缬草有效成分分析和组织培养方面的研究,但大多集中于缬草属某品种的成分分析或缬草愈伤组织诱导和组培快繁类研究[7],对缬草不定根培养的研究很少,需要缬草不定根培养和有效成分测定方面的研究。
前期已经筛选得到不定根悬浮培养的理想培养基为根培养基(root culture medium, RCM)以及理想生长调节剂浓度为0.5 mg·L-1萘乙酸(1-Naph thalene acetic acid, NAA)[8]。在此基础上,本研究以欧洲缬草不定根为试验材料,进一步分析pH值、碳源种类、糖浓度、盐浓度、总氮(N)浓度、总磷(P)浓度等因素对不定根悬浮培养的影响,确定不定根悬浮培养条件,同时考察此条件下不定根的生长情况以及正常不定根、褐化不定根和无菌苗根中缬草三酯、乙酰缬草三酯、缬草烯酸等成分的含量,以期为缬草有效成分的规模化生产提供参考。
1 材料与方法
1.1 材料与试剂
欧洲缬草种子购自美国犹他州立大学农学院,其开花植株经延边大学农学院全雪丽教授鉴定为败酱科缬草属欧洲缬草(V.officinalis)。悬浮培养试验材料为RCM+0.5 mg·L-1NAA培养液中多次悬浮继代培养的不定根,不定根由欧洲缬草种子繁殖的无菌苗茎段诱导而来;有效成分含量测定的试验材料为经低温干燥的欧洲缬草正常不定根(培养28 d的不定根)、褐化不定根(培养70 d未继代的不定根)和培养2个月的无菌苗根。
RCM培养基由实验室配制(见附表1);缬草三酯标准品(批号:wkq19012404,纯度≥98%)购自四川维克奇生物;乙酰缬草三酯标准品(批号:wkq19012505,纯度≥98%)购自四川维克奇生物;缬草烯酸标准品(批号:Z12J10H78323,纯度≥98%)购自上海源叶生物;乙腈(色谱纯)和甲醇(色谱纯)购自美国Fisher公司。其他试剂均为国产分析纯(天津科密欧化学试剂有限公司)。
1.2 主要仪器与设备
Agilent 1260型高效液相色谱仪,美国安捷伦公司;SW-CJ-2FD超净工作台,上海新苗医疗器械制造有限公司;THZ-300恒温培养摇床,上海一恒科学仪器有限公司;Centrifuge 5804R 台式冷冻离心机,德国艾本德公司;JYD-650L超声波细胞粉碎机,上海之信仪器有限公司;KQ-300VDE型三频数控超声波清洗器,昆山市超声仪器有限公司;PURELAB claffic 超纯水器,英国埃尔格公司。
1.3 试验方法
1.3.1 pH值对欧洲缬草不定根悬浮培养的影响 以RCM为基本培养基,设置4种不同pH值,分别为4.5、5.0、5.7、6.5,并制作培养液(不加植物生长调节剂)。每个50 mL三角瓶中加入30 mL培养液,121℃高温高压灭菌15 min备用。选取粗细均匀的不定根,将其从根尖部位切取1 cm,接种到含有配制好培养液的三角瓶中,每种处理设10次重复。接种前后称量培养基总重量,计算接种量,接种后移至100 r·min-1摇床培养,培养温度为25±2℃,暗培养30 d后收获。收获后分别称量不定根的鲜重和干重,并计算干物率和增殖倍数:
接种量(g·L-1)=接种后培养基总重量-接种前培养基总重量
(1)
干物率=收获干重/收获鲜重×100%
(2)

(3)
收获量:将培养的不定根取出,用滤纸吸干水分,置于分析天平称重,即为收获量。
1.3.2 碳源种类对欧洲缬草不定根悬浮培养的影响 在1.3.1试验结果基础上,用果糖、麦芽糖、葡萄糖、半乳糖4种碳源分别取代蔗糖,添加量均为30 g·L-1,配制培养液,灭菌后备用。其他操作同1.3.1。
1.3.3 蔗糖浓度对欧洲缬草不定根悬浮培养的影响 在1.3.2试验结果基础上,分别配制10、20、30、40、50、60 g·L-16种蔗糖浓度的培养液,灭菌后备用。其他操作同1.3.1。
1.3.4 盐浓度培养对欧洲缬草不定根悬浮培养的影响 在1.3.3试验结果基础上,设1/2X、3/4X、X、2X、3X(设原RCM大量元素的盐浓度为X)5种盐浓度,配制培养液,灭菌后备用。其他操作同1.3.1。
1.3.5 总N浓度对欧洲缬草不定根悬浮培养的影响 在1.3.4试验基础上,设0、16.15、32.31、48.46、64.61、96.93 mmol·L-16种总N浓度,配制培养液,灭菌后备用。其他操作同1.3.1。
1.3.6 总P浓度对欧洲缬草不定根悬浮培养的影响 在1.3.5试验结果基础上,设0、0.5、1.0、1.5、2.0、3.0、4.0 mmol·L-17种总P浓度,配制培养液,灭菌后备用。其他操作同1.3.1。
1.3.7 悬浮培养条件下欧洲缬草不定根的生长情况 以RCM为基本培养基,将上述筛选所得最优培养条件综合,并添加0.5 mg·L-1NAA,配制培养液,灭菌后备用。选取粗细均匀的不定根,接种于三角瓶中,保证每瓶接种量相同,每个处理设30次重复。接种后移至摇床培养,转速为100 r·min-1,培养温度为25±2℃,暗培养,每隔7 d取样一次,每次取样5瓶。参照1.3.1测定收获不定根的鲜重作为生物量,并绘制不定根的生长曲线。
1.3.8 欧洲缬草不定根中有效成分的测定 供试品溶液制备:低温干燥的欧洲缬草药材粉碎过60目筛,分别称量1.00 g正常不定根、0.23 g褐化不定根、0.27 g 2个月无菌苗根,然后依次加入25、10、10 mL甲醇,称重后,分别超声(500 W,25 kHz)处理40 min,再称重,用甲醇补足减失重量,摇匀后离心20 min,保留上层清液。上层清液过0.22 μm有机滤膜,作为供试品溶液。
标准品溶液制备:称取20 mg缬草三酯标准品、10 mg缬草烯酸,分别加入80 mL甲醇制成浓度为0.250、0.125 mg·mL-1的标准品溶液;称取3 mg乙酰缬草三酯,加入20 mL甲醇,制成浓度为0.150 mg·mL-1的标准品溶液。
有效成分测定参考侯文慧等[9]的方法,并根据实际情况略作修改。
色谱条件:Agilent ZRBAX SB-C18色谱柱(4.6 mm×150 mm,5 μm,美国安捷伦公司);流动相为乙腈-水(8∶2),等度洗脱20 min,流速1 mL·min-1,柱温25℃,检测波长235 nm,进样量10 μL。
1.4 数据统计与分析
采用WPS 2019整理试验数据,用SPSS 17.0统计分析软件进行方差和差异显著性分析。
2 结果与分析
2.1 欧洲缬草不定根悬浮培养pH值的筛选
由表1可知,随着pH值的升高,欧洲缬草不定根收获鲜重先升高后降低,当pH值为5.7时,欧洲缬草不定根生长最旺盛,收获鲜重达1.88 g·L-1,增殖倍数为7.91,收获干重为0.27 g·L-1,干物率为14.31%,且其收获鲜重、干重显著高于其他pH值,说明适宜欧洲缬草不定根悬浮培养的pH值为5.7。
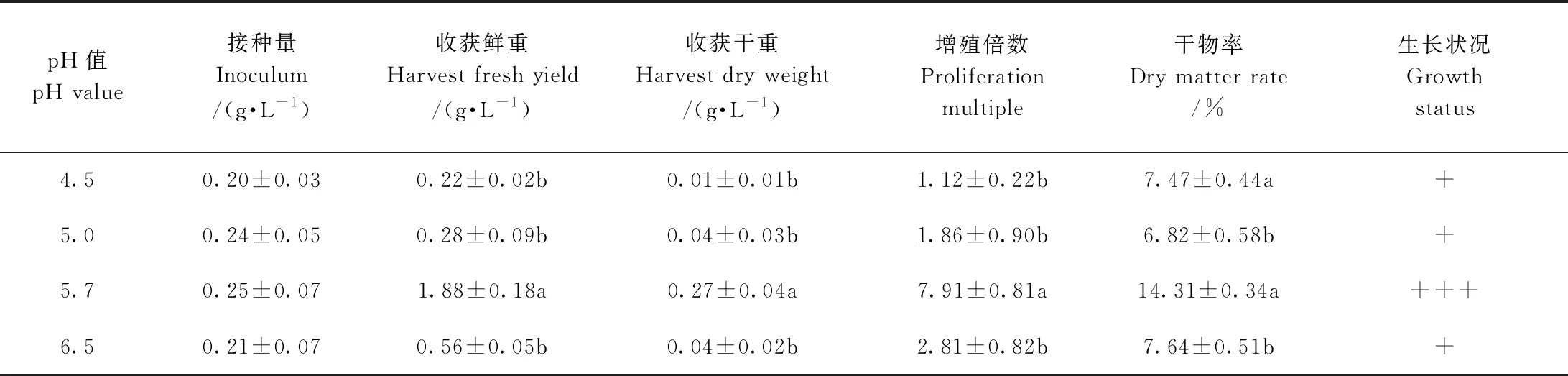
表1 悬浮培养下pH值对欧洲缬草不定根生长的影响Table 1 Effect of pH on adventitious roots growth of V. officinalis under suspension culture
2.2 欧洲缬草不定根悬浮培养碳源的筛选
由表2可知,碳源为蔗糖时,欧洲缬草不定根生长最旺盛,收获鲜重为4.32 g·L-1,收获干重为0.89 g·L-1, 增殖倍数为12.64,干物率为19.00%,均显著高于其他碳源。此外,以果糖和半乳糖为碳源的悬浮液中欧洲缬草不定根几乎不生长。综合分析,蔗糖是欧洲缬草不定根悬浮培养的适宜碳源。
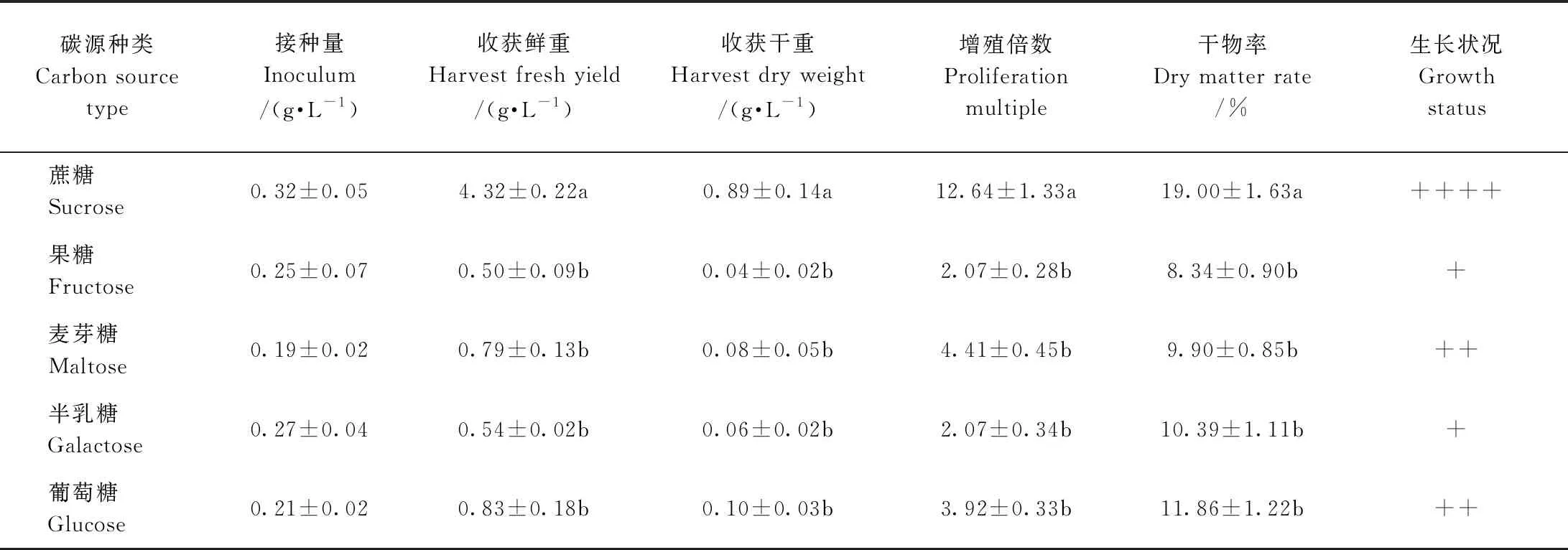
表2 悬浮培养下碳源对欧洲缬草不定根生长的影响Table 2 Effects of carbon sources on adventitious roots growth of V. officinalis under suspension culture
2.3 欧洲缬草不定根悬浮培养糖浓度的筛选
由表3可知,随着蔗糖浓度的增加,欧洲缬草不定根的收获鲜重先增加后减少,当蔗糖浓度为40 g·L-1时,不定根生长最旺盛,收获鲜重为7.68 g·L-1,收获干重为1.73 g·L-1,增殖倍数为26.72,干物率为22.69%,除干物率外,其他指标均显著高于其他蔗糖浓度。蔗糖浓度为50、60 g·L-1时,欧洲缬草不定根生长次之。因此,欧洲缬草不定根悬浮培养的适宜蔗糖浓度为40 g·L-1。
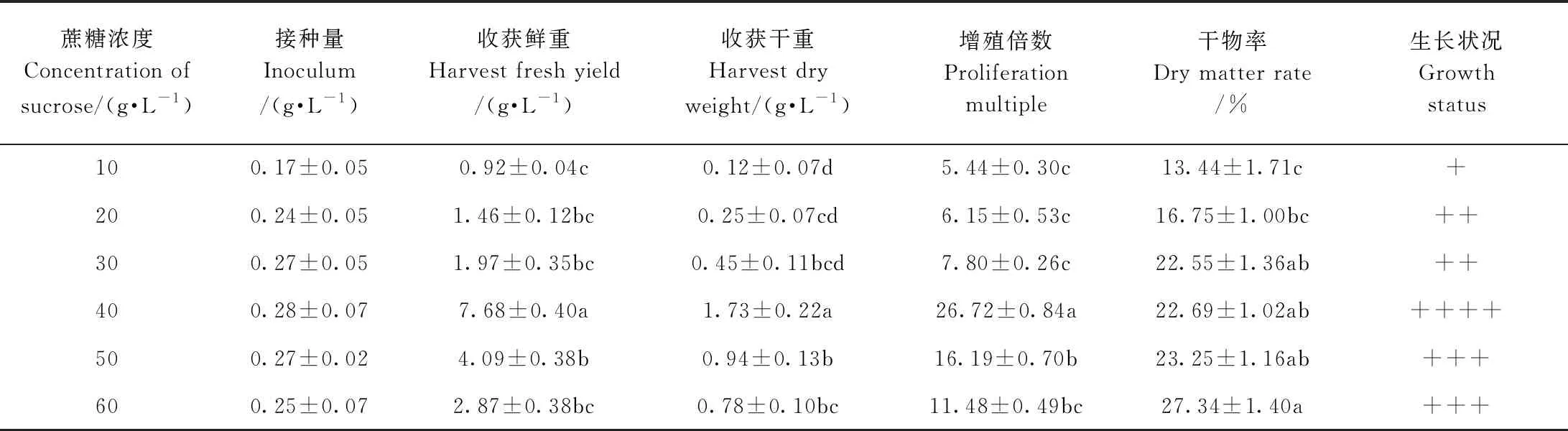
表3 悬浮培养下蔗糖浓度对欧洲缬草不定根生长的影响Table 3 Effect of sucrose concentration on adventitious roots growth of V. officinalis under suspension culture
2.4 欧洲缬草不定根悬浮培养盐浓度的筛选
由表4可知,随着盐浓度的增加,欧洲缬草不定根的鲜重呈先增加后减少的趋势。当盐浓度为2X时,欧洲缬草不定根生长最旺盛,收获鲜重为1.92 g·L-1, 收获干重为0.30 g·L-1,增殖倍数为7.39,干物率为15.64%,其中收获鲜重与干重均显著高于其他盐浓度。盐浓度为X时,欧洲缬草不定根生长次之。因此,欧洲缬草不定根悬浮培养的适宜盐浓度为2倍RCM基础大量元素。
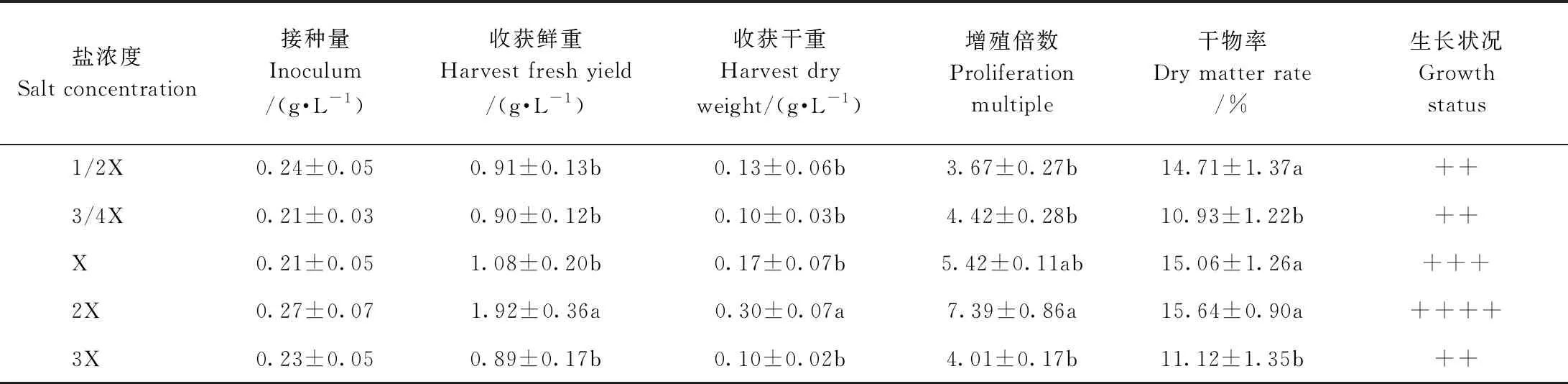
表4 悬浮培养下盐浓度对欧洲缬草不定根生长的影响Table 4 Effect of salt concentration on adventitious roots growth of V. officinalis under suspension culture
2.5 欧洲缬草不定根悬浮培养总N浓度的筛选
由表5可知,随着总N浓度的增加,欧洲缬草不定根的鲜重呈先增加后减少的趋势,当总N浓度为48.46 mmol·L-1时,欧洲缬草不定根生长最旺盛,收获鲜重为7.68 g·L-1,收获干重为0.49 g·L-1,增殖倍数为7.52,干物率为22.03%,各指标显著高于其他总N浓度组。因此,适宜欧洲缬草不定根悬浮培养的总N浓度为48.46 mmol·L-1。
2.6 欧洲缬草不定根悬浮培养总P浓度的筛选
不定根在不同总P浓度的培养液中悬浮培养30 d后(表6),随着总P浓度的增加,不定根的鲜重先增加后降低,在总P浓度为1.5 mmol·L-1时,不定根生长最旺盛,收获鲜重为4.76 g·L-1, 收获干重为0.89 g·L-1, 增殖倍数为18.37,干物率为18.74%,除干物率外,其他指标物均显著高于其他处理。因此,适于欧洲缬草不定根悬浮培养的总P浓度为1.5 mmol·L-1。
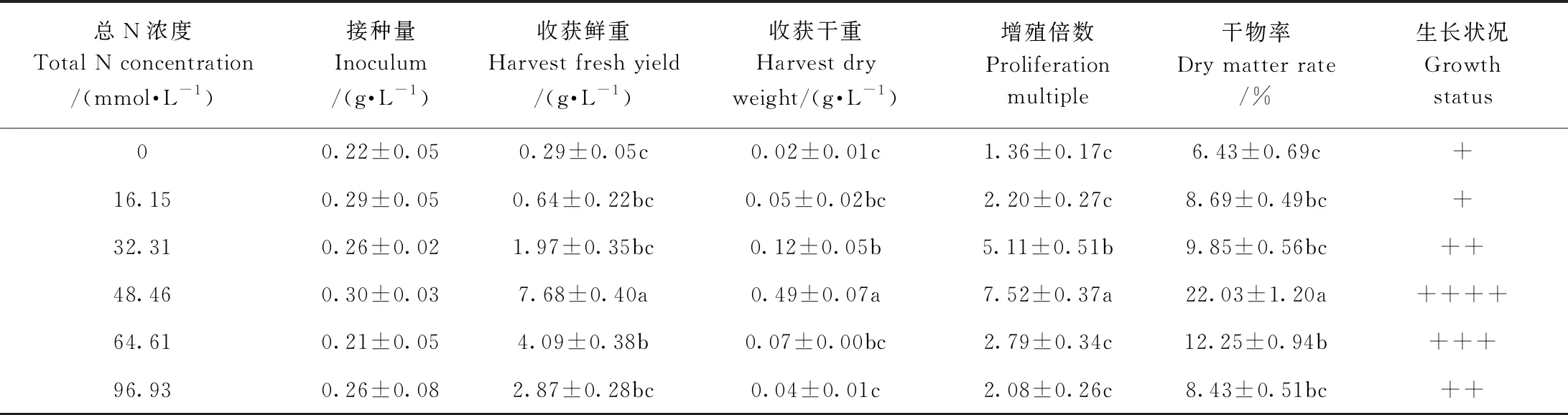
表5 悬浮培养下总N浓度对欧洲缬草不定根生长的影响Table 5 Effect of total N concentration on adventitious roots growth of V. officinalis under suspension culture
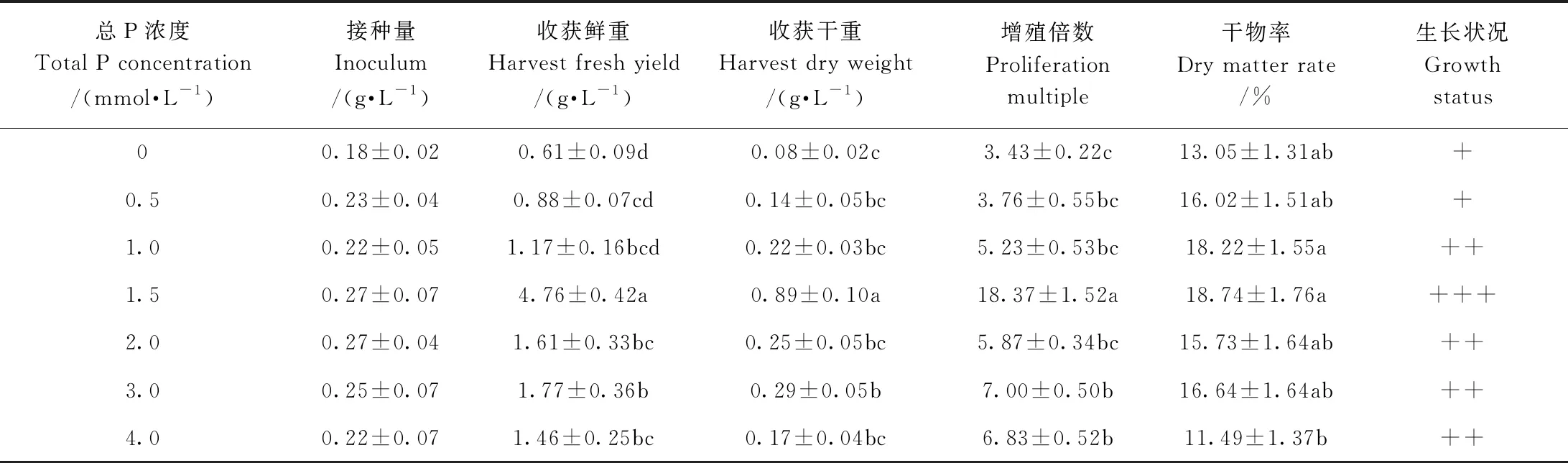
表6 悬浮培养下总P浓度对欧洲缬草不定根生长的影响Table 6 Effect of total P concentration on adventitious roots growth of Ⅴ. officinalis under suspension culture
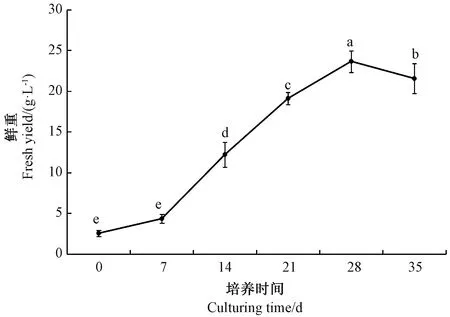
注:不同小写字母表示差异显著(P<0.05)。Note: Different lowercase letters indicate significant difference at 0.05 level.图1 悬浮培养下欧洲缬草不定根生长曲线Fig.1 Adventitious root growth curve of V. officinalis under suspension culture
2.7 悬浮培养条件下欧洲缬草不定根的生长
由图1可知,悬浮条件下欧洲缬草不定根的生长曲线基本呈“S”型。随着培养时间的延长,欧洲缬草不定根生物量先增加后小幅度减少,在接种后0~7 d不定根生长基本处于迟缓期,生物量增加缓慢(图2-A);接种后7 d,欧洲缬草不定根分化出小侧根(图2-B),其生物量开始较快增长;接种后7~21 d,欧洲缬草不定根增长速度快,基本处于对数期(图2-C、D);接种后21~28 d,欧洲缬草不定根增长速度下降,处于缓慢增长期,接种后28 d,欧洲缬草不定根生长量最大,处于基本稳定期(图2-E);接种后28~35 d,欧洲缬草不定根生物量有小幅度下降,处于衰退期(图2-F)。因此,接种后7~28 d为欧洲缬草不定根生物量增加的关键时期,接种28 d时欧洲缬草不定根生物量最大,此时适宜收获。
2.8 欧洲缬草的有效成分测定
2.8.1 欧洲缬草不定根中有效成分的HPLC图 根据1.3.8色谱条件测得3种标准品出峰时间的先后顺序为乙酰缬草三酯、缬草三酯、缬草烯酸(图3-A),同时欧洲缬草不定根中缬草三酯、乙酰缬草三酯、缬草烯酸与其他组分均能达到较好分离(图3-B)。
2.8.2 回归方程 以峰面积(y)为纵坐标,进样量(x,μg)为横坐标,得到3种成分的回归方程和相关系数(表7),3种成分在相应范围内线性关系良好。
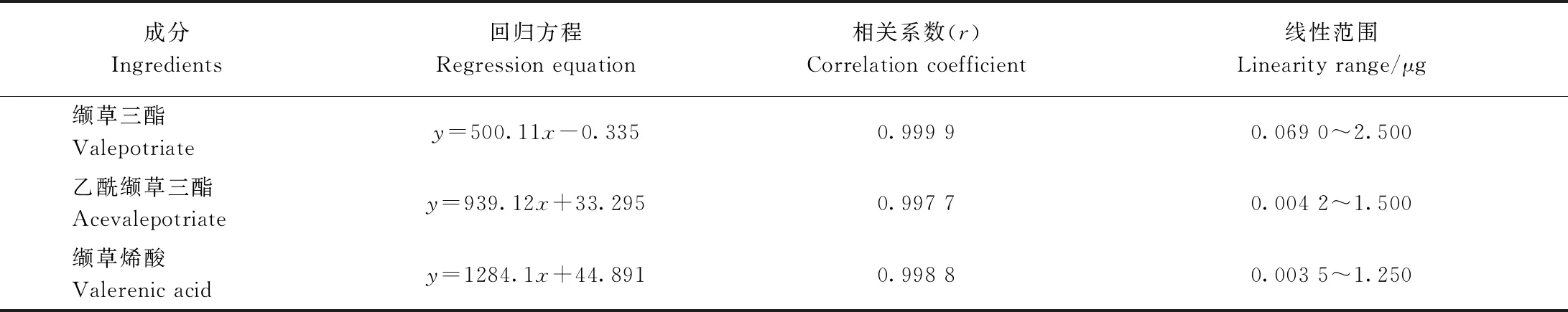
表7 欧洲缬草有效成分的回归方程和相关系数Table 7 Regression equations and correlation coefficients secondary metabolites of Ⅴ. officinalis
2.8.3 欧洲缬草有效成分含量分析 悬浮条件下培养的欧洲缬草3种类型根中有效成分的总含量表现为正常不定根>褐化不定根>无菌苗根,褐化现象显著降低了不定根中有效成分的含量,其中,正常不定根中缬草三酯含量最高,为7.222 mg·g-1,无菌苗根中缬草三酯含量最低,为2.688 mg·g-1;正常不定根中乙酰缬草三酯含量最高,为0.355 mg·g-1,褐化不定根中乙酰缬草三酯含量最低,为0.036 mg·g-1;正常不定根中缬草烯酸含量最高,为4.016 mg·g-1,无菌苗根中缬草烯酸含量最低,为1.393 mg·g-1。欧洲缬草正常不定根中缬草三酯、乙酰缬草三酯、缬草烯酸含量均显著高于褐化不定根和无菌苗根。综上表明,在悬浮培养条件下大量培养正常不定根是高效繁殖欧洲缬草有效成分的有效手段。

表8 欧洲缬草三种根类型有效成分的含量Table 8 Content of active ingredients of three root types of V. officinalis /(mg·g-1)
3 讨论
3.1 欧洲缬草不定根悬浮培养体系
通过组织培养生产次生代谢产物时,如何提高培养物的增长量和目标产物的产量是首要解决的问题[10]。不同的培养基中含有不同浓度的碳源、无机盐、维生素和有机酸等物质,这些因素会影响培养物生长和次生代谢产物的合成效果。
不同的植物、器官或组织对培养基pH值的要求也不尽相同。不同植物、器官或组织生长都有其最适pH值。本研究中,欧洲缬草不定根悬浮培养的最适pH值为5.7。曲伟红等[11]研究发现瓦松愈伤组织培养的适宜pH值为5.8,与本研究的结果相似。魏振园等[12]研究发现pH值为6.6左右时,国槐悬浮细胞生长状况好,且细胞黄酮类化合物含量较高,这与本研究结果不同。
不同植物有不同的适合碳源,不同的碳源会对生长效果产生不同影响。本试验结果表明,以蔗糖为碳源时,欧洲缬草不定根生长效果最好,生物量最大,而欧洲缬草不定根在果糖和半乳糖中几乎不生长。类似的现象在雷公藤[13]、柽柳[14]和荞麦[15]等植物中也存在,可能是不定根不能直接吸收果糖和半乳糖。一般认为,蔗糖作为很好的碳源,是由于蔗糖更容易被植物细胞壁内的蔗糖酶分解为葡萄糖和果糖,进而被细胞吸收和利用[13]。此外,本研究发现,蔗糖浓度为40 g·L-1时,欧洲缬草不定根生长效果最好,生物量最大。尹双双[16]研究发现在4%蔗糖浓度下,太子参不定根生长最好;Lee等[17]研究发现在3%蔗糖浓度下,匙羹藤生物量最大;黄韬等[18]研究发现40 g·L-1的蔗糖浓度最有益于人参不定根的生长,低于或者高于此蔗糖浓度对不定根的生长差。这与本试验结果相似。
盐浓度对不定根生物量的增加及其次生代谢产物的合成具有很大的影响。本试验发现在盐浓度为2X(即2倍的RCM大量元素)时,欧洲缬草不定根生长效果最好,生物量最大。在低盐浓度下,营养物质不够,导致了不定根生长较差,生物量低,但盐浓度超过2X时,会抑制不定根生长,可能是渗透压过高抑制了细胞对水分和养分的吸收,影响了细胞生长。尹双双[16]研究发现,太子参不定根在1 MS盐强度下生物量最大;Baque等[19]发现低盐浓度最适宜诺丽果不定根生长及代谢产物积累;Zhang等[20]发现杠柳不定根在1/2 MS条件下不定根的生物量达到最大。这些研究均表明盐浓度会影响不定根的生长。
N不仅是植物体必需的营养元素,还是构成蛋白质、核酸等多种具有重要生理功能物质的主要成分。培养基中N不可缺少,但N浓度过高和过低都不利于其增殖生长和次生代谢产物的合成。本试验结果表明,总N浓度为48.46 mmol·L-1时,欧洲缬草不定根生长效果最好,生物量最大。氮源浓度在细胞生长和次生代谢产物合成上起着关键的作用[21]。吴春华等[22]发现当培养基氮浓度为45 mmol·L-1时,白色紫锥菊不定根生物量、酚和黄酮含量均达到最大值。李慧娟[23]发现东北刺人参不定根生长的最适N浓度为60 mmol·L-1。
磷是植物生长所必需的营养元素之一,也是植物新陈代谢最重要的矿质元素之一,在植物生长发育和次生代谢产物积累中起着至关重要的作用[24]。本研究中,总P浓度为1.5 mmol·L-1时,欧洲缬草不定根生长效果最好,生物量最大,显著优于其他总P浓度。李慧娟[23]发现1.5 mmol·L-1的P浓度可以使东北刺人参生物量达到最大值;王洪秋[25]发现1.88 mmol·L-1的P浓度最适宜白色紫雏菊不定根生物量积累。
本试验获得的欧洲缬草理想悬浮培养体系:2倍大量元素浓度、48.46 mmol·L-1总N浓度、1.5 mmol·L-1总P浓度的RCM培养基,添加40 g·L-1蔗糖、0.5 mg·L-1NAA,pH值5.7,于25±2℃、100 r·min-1条件下暗培养时,欧洲缬草不定根的生长曲线基本呈“S”型,接种后7~28 d为其生物量积累的关键时期,宜于接种后28 d收获。这与尹双双[16]、史昆等[26]的研究结果相似。
3.2 欧洲缬草次生代谢产物含量
本研究利用HPLC测定了欧洲缬草理想悬浮培养条件下正常不定根、褐化不定根和无菌苗根中缬草三酯、乙酰缬草三酯、缬草烯酸的含量,发现正常不定根中3种有效成分含量最多,褐化不定根中成分含量严重降低,且显著低于正常不定根,无菌苗根中成分含量最低。本研究中,接种后28 d,欧洲缬草不定根缬草烯酸含量为4.012 mg·g-1,高于梁朝锋等[27]测得的黑龙江产黑水缬草根及根茎的中的含量,推断对于欧洲缬草来说,给予充足的养分、适宜的条件,容易促进缬草烯酸的合成和积累,这可能是由于液体培养中某种营养物质会促进缬草烯酸的合成,而土壤中具有促进作用的物质含量较低,导致缬草烯酸含量较低,养分充足生长时间短的不定根中缬草烯酸含量高于两年生根,养分充足生长时间短的无菌苗根中缬草烯酸含量也接近于两年生根,这也间接证明了此推断;不定根中缬草三酯含量为7.222 mg·g-1,高于梁朝锋等[27]测得的黑龙江产黑水缬草和侯文慧等[9]测得的云南师宗和大理等地产蜘蛛香中的含量,低于狄宏晔等[28]测得的云南师宗地产蜘蛛香药材的含量,可见同一品种、同一产地因储藏时间过长而使得缬草三酯类成分含量大幅降低,缬草三酯成分的不稳定和易降解特性显现[29];不定根乙酰缬草三酯含量为0.355 mg·g-1,高于侯文慧等[9]测得的云南永平、昆明、四川雅安、峨眉山等地产蜘蛛香药材中的含量,低于云南师宗、大理和宝山等地产蜘蛛香药材的含量。可见,产地、气候环境、储存时间、种间差异等因素会使缬草三酯、缬草烯酸、乙酰缬草三酯等成分的含量有所不同。此外,在本试验过程中甲醇根粉末溶液的超声波细胞粉碎处理会使溶液温度升高,有效成分降解,离心取上清液后的残留物中也会存在一些有效成分,这些都会使得试验测量的有效成分含量值低于实际值。
4 结论
本研究筛选到的欧洲缬草理想悬浮培养条件为2倍RCM大量元素浓度、48.46 mmol·L-1总N浓度、1.5 mmol·L-1总P浓度的RCM培养基,添加40 g·L-1蔗糖、0.5 mg·L-1NAA,pH值5.7,此条件下接种后培养28 d,收获得到的欧洲缬草不定根中缬草三酯、乙酰缬草三酯分别为7.222、0.355 mg·g-1,2种有效成分总含量为7.577 mg·g-1,约占不定根总干重的0.76%,与2010版中国药典规定的蜘蛛香药材干燥品中缬草三酯和乙酰缬草三酯的总含量不得少于0.80%的要求相差不大[30]。此外,在本研究筛选得到的悬浮培养条件下,欧洲缬草不定根繁殖速度快,为欧洲缬草不定根和有效成分的规模化生产提供了依据。
附表1 RCM培养基成分及浓度 Schedule 1 Composition and concentration of RCM
成分Composition浓度Concentration/(mg·L-1)蔗糖Sucrose30 000KNO380Ca(NO3)2·4H2O288MgSO4·7H2O370NaH2PO412Na2SO499ZnSO4·7H2O2.65H3BO31.5KCl65KI0.75Na2MoO4·2H2O0.25CuSO4·5H2O0.02MnCl2·4H2O6Na2EDTA7.4FeCl33.2甘氨酸Glycine3烟酸Nicotinic acid0.5盐酸吡哆醇Pyridoxine hydrochloride0.1盐酸硫胺素Thiamine hydrochloride0.1
[3] 张宁宁, 丁广治. 蜘蛛香中的环烯醚萜类成分及其生物活性研究进展[J]. 中国中药杂志, 2015, 40(10): 1893-1897
[4] 王茹静, 黄青, 雍妍, 李鸿翔, 张仕瑾, 陈宝华, 朱利霞, 陈银, 唐鑫, 宋珊珊, 董小萍, 谭玉柱, 张海. 缬草属植物的化学成分及生物活性研究概况[J]. 中国中药杂志, 2016, 41(8): 1405-1414
[5] 黄和平, 高山林, 王键, 黄璐琦, 黄鹏. 何首乌不定根的离体诱导及悬浮培养研究[J]. 中国中药杂志, 2013, 38(22): 3857-3860
[6] 崔磊. 缬草细胞培养合成缬草素的研究[D]. 哈尔滨: 哈尔滨工业大学, 2013
[7] 李美阳. 培养条件对缬草不定根生长及次生代谢产物的影响[J]. 安徽农业科学, 2013, 41(27): 10956-10957, 10959
[8] 李文杰, 李美阳, 宫惠. 欧洲缬草不定根诱导与悬浮培养的研究[J]. 中国农业科技导报, 2020(1): 179-186
[9] 侯文慧, 刘勇, 王春国, 刘国林, 刘倩佟, 昶国平, 刘洁, 史淑宁, 石晋丽. HPLC法同时测定蜘蛛香药材中缬草三酯类化合物及其降解产物的含量[J]. 世界科学技术—中医药现代化, 2014, 16(12): 2658-2663
[10] 李琰, 温鹏飞, 崔蕾, 雷嘉敏, 张兴. 微量元素对雷公藤不定根生长和次生代谢产物含量的影响[J]. 林业科学, 2014, 50(2): 134-138
[11] 曲伟红, 赵建国. 瓦松愈伤组织诱导研究[J]. 时珍国医国药, 2010, 21(11): 2832-2833
[12] 魏振园, 汤若风, 王晋飞, 董倩倩, 范亚丽, 刘忠华. pH对槐角愈伤组织黄酮类化合物产量的影响[J]. 广西植物, 2013, 33(2): 203-207
[13] 李琰. 雷公藤组织培养生产次生代谢产物及其代谢调控研究[D]. 杨凌: 西北农林科技大学, 2008
[14] 王思瑶, 崔曈肸, 翟睿, 林香雨, 李欣, 孙璐, 詹亚光, 尹静. 不同碳源对柽柳丛生芽生长、三萜及黄酮物质积累的影响[J]. 植物生理学报, 2017, 53(12): 2189-2196
[15] 王鹏姬, 高金锋, 苏旺, 高小丽, 王鹏科, 冯佰利. 培养条件对荞麦愈伤组织生长及黄酮合成的影响[J]. 核农学报, 2013, 27(5): 591-597
[16] 尹双双. 太子参、杠柳和甘草不定根培养的研究[D]. 天津: 天津大学, 2013
[17] Lee E J, Mobin M, Hahn E J, Pack K Y. Effects of sucrose, inoculum density, auxins, and aeration volume on ceil growth ofGymnemasylvestre[J]. Journal of Plant Biology, 2006, 49(6): 427-431
[18] 黄韬, 高文远, 王娟, 曹宇. 离体培养条件对人参不定根生长及其活性成分合成的影响[J]. 中国中药杂志, 2010, 35(1): 13-17
[19] Baque M A, Lee E J, Paek K Y. Medium salt strength induced changes in growth, Physiology and secondary metabolite content in adventitious roots ofMorindacitrifolia: The role of antioxidant enzymes and Phenylalanine ammonia lyase[J]. Plant Cell Reports, 2010, 29(7): 685-694
[20] Zhang J, Gao W Y, Wang J, Li X L. Effects of explant types and media salt strength on growth and secondary metabolite accumulation in adventitious roots ofPeriplocasepiumBunge[J]. Acta Physidogiae Plantarum, 2011, 33(6): 2447-2452
[21] Kim S H, Kim S K. Effect of sucrose level and nitrogen source on fresh weight and anthocyanin production in cell suspention culture of ‘Sheridan’ grape (Vitisspp)[J]. Journal of Plant Biotechnology, 2002, 4(1):23-27
[22] 吴春华, 王淼, 宋杭霖, 崔锡花. 无机盐和蔗糖浓度对白色紫锥菊不定根生长及次生代谢产物积累影响[J]. 天然产物研究与开发, 2013, 25(9): 1167-1171
[23] 李慧娟. 东北刺人参不定根反应器培养及其抗氧化活性的研究[D]. 延吉: 延边大学, 2012
[24] 张悦. 磷缺乏及6-BA对黄瓜毛状根生长及其形态影响的机理研究[D]. 广州: 华南师范大学, 2007
[25] 王洪秋. 白色紫锥菊不定根培养及抗炎特性的研究[D]. 延吉: 延边大学, 2018
[26] 史昆, 杨模华, 李志辉, 张冬林, 王茜,丁贵杰. 马尾松胚性细胞悬浮增殖培养体系的建立[J]. 中南林业科技大学学报, 2014, 34(1): 64-68
[27] 梁朝锋, 都晓伟, 闫梅. RP-HPLC同时测定黑水缬草药材中缬草烯酸和缬草素含量[J]. 药物分析杂志, 2011, 31(4): 671-673
[28] 狄宏晔, 石晋丽, 闫兴丽, 赵仁, 刘勇, 肖培根. HPLC法测定蜘蛛香中缬草素、乙酰缬草素及其分解产物baldrinal[J]. 中草药, 2007(12): 1892-1894
[29] 陈玉娟, 石晋丽, 闫兴丽, 刘勇, 肖培根. 蜘蛛香中缬草素在不同溶媒中的稳定性研究[J]. 北京中医药大学学报, 2009, 32(5): 349-350
[30] 国家药典委员会. 中华人民共和国药典 (2010版, 一部) [M]. 北京: 中国医药科技出版社, 2010: 345-346

