运动改善APP/PS1小鼠海马白质的机制研究
闫清伟,李亚楠,赵 娜,徐亚涛,李百侠,夏 杰,徐 波
随着人口平均寿命的增高,阿尔茨海默病(Alzheimer's disease,AD)日益成为威胁老年人群生存和健康的重要因素。AD于1901年被正式提出,至今已有100多年的历史。在这百余年的历程中,学术界对AD的研究不断深入。然而至今仍未找到理想的治疗办法,关于AD病理机制及其关键作用靶点的认识仍不充分。合理的体育运动可增进身体机能,促进健康水平。近年来研究证实,运动在预防和改善AD病理进程中发挥了积极作用(Cui et al.,2018;Meng et al.,2020),但具体机制仍未探明。有研究证实,AD脑内存在明显的白质损伤(Klosinski et al.,2015;Nasrabady et al.,2018)。白质受损会严重危害神经系统的信号传导功能,这可能与AD病人海马功能受损、认知功能下降密切相关。
对AD患者或模式动物脑(以下简称AD脑)内能量代谢方面的研究发现,在AD病理进程中,伴随脑内葡萄糖代谢供能减退现象,同时伴随着脑内酮体代谢供能水平增强(Brinton et al.,2015;Yao et al.,2011)。葡萄糖是健康大脑的主要能源物质,脑内葡萄糖源自血糖的跨血脑屏障转运,葡萄糖转运载体1和3(glucose transporters,GLUT1/3)是负责葡萄糖跨血脑屏障转运的关键载体。在老龄大脑和AD脑内,葡萄糖转运能力及代谢水平降低,酮体代偿性供能水平增高(Tondo et al.,2020;Ding et al.,2013)。AD脑内酮体主要源自脑内髓鞘磷脂的分解代谢,而髓鞘磷脂的分解可造成脑白质结构破坏,这可能是AD脑白质损伤的重要原因。正常情况下,髓鞘磷脂不参与代谢供能,当脑内葡萄糖代谢供能不足时,髓鞘磷脂在多种因子的作用下参与代谢供能,如胞质磷脂酶A2(cytosolic phospholipases A2,cPLA2)可促进髓鞘磷脂代谢分解;羟烷基辅酶A脱氢酶(hydroxyacyl-CoA dehydrogenase,HADHA)是线粒体三功能蛋白的关键亚基,负责长链脂肪的β-氧化,β-氧化产生的乙酰乙酸是磷脂代谢生成酮体的前体物质(Deng et al.,2020;Li et al.,2014;Schaeffer et al.,2010);琥珀酰辅酶A:3酮酸辅酶A转移酶(succinyl-CoA:3-ketoacid CoA transferase,SCOT)可催化酮体代谢的供能反应,酮体转运载体蛋白1、2和4(monocarboxylic acid transporters,MCT1/2/4)负责酮体的跨膜转运等(Al et al.2020;Zhang et al.,2018)。髓鞘磷脂的分解供能反应可导致髓鞘完整性破坏,而髓鞘碱性蛋白(myelin basic protein,MBP)是髓鞘的关键蛋白,其蛋白质表达水平可直接反映髓鞘完整性,常用于评价脑白质损伤情况(Ferrer et al.,2020)。研究证实,适当运动可对AD病理起到积极的预防效应,然而这一效应的内在机制是否与运动对AD海马白质的改善有关,目前的研究尚不充分。近期有研究证实,适当运动对脑白质有积极影响。运动对血脑屏障破坏的幼龄大鼠和抑郁模型大鼠的脑白质均有积极的改善效应,同时可以提高大鼠的认知功能(Chen et al.2016;Lee et al.2017),对10月龄 APP/PS1小鼠研究证实,跑台运动可抑制APP/PS1小鼠的脑白质体积萎缩,延缓白质毛细血管减少(Zhang et al.,2017),跑台运动可改善10月龄APP/PS1小鼠认知功能,抑制脑白质有髓鞘神经纤维的脱髓鞘改变(Zhang et al.,2017)。另有研究证实,运动可改善10月龄APP/PS1小鼠空间记忆能力,抑制脑白质有髓鞘神经纤维长度和直径的缩短(Zhou et al.,2018)。以上研究均提示,运动改善AD病理的机制可能与运动对脑白质的改善有关,但具体机制不明。然而,人体实验研究显示,6个月的有氧运动对健康老龄大脑全脑的脑白质影像学相关指标改善效应不显著(Clark et al.,2019)。造成运动对上述AD脑白质和健康老龄脑白质不同影响的原因尚不清楚。分析认为,脑白质改变作为AD病理的一个早期特征,其最先变化可能表现在学习记忆关键脑区的海马部位,早期阶段全脑白质损伤程度可能尚不明显;另外,老龄健康大脑和AD脑的认知功能存在差异,因此其脑白质结构的退变损伤可能也存在不同的时间变化规律。APP/PS1小鼠自3月龄开始认知功能逐渐下降,6月龄时表现出显著的认知功能障碍。因此,为探讨运动对AD脑白质的影响机制,本研究采用6月龄APP/PS1小鼠为研究对象,通过对小鼠学习记忆关键脑区海马白质代谢相关指标的检测,探讨运动对APP/PS1小鼠海马白质的影响机理。
1 材料与方法
1.1 实验动物分组及干预
采用3月龄APP/PS1小鼠为研究对象,将小鼠随机分为安静对照组(ADC组,n=18)和运动干预组(ADE组,n=18)。各组小鼠正常饲养,饲养条件同文献(闫清伟等,2019)。于正式实验开始前1周,将所有小鼠置入实验环境使其适应,为期1周。适应期运动干预方案为:每天18:00-20:00将ADE组小鼠置入小鼠专用跑台进行跑台运动适应,每天起始速度5 m/min,逐级递增至12 m/min,适应期第1~2天运动时间15 min,之后每天增加10 min逐级递增,至适应期结束(适应期1周训练5天,休息2天,周四和周日为休息日),单次运动时间增加至45 min之后进入正式实验阶段。正式实验阶段每天按同样的运动方案干预,即每天运动1次,时间45 min,起始速度5 m/min,逐级递增至12 m/min,干预周期为12周,其他条件均与适应期相同。为降低两组之间的环境因素差异,ADC组小鼠在适应期和正式干预期每天相同时间段内,置入静止跑台中进行适应,每天置入跑台的时间与运动组时间相同。
1.2 核磁共振弥散张量成像实验
分别从ADC组和ADE组随机取6只小鼠,置于核磁共振仪内(德国Bruker公司,型号:Biospec70/20USR,7.0T)进行弥散张量成像(diffusion tensor imaging,DTI)实验测试,检测小鼠海马各向异性分数(fractional anisotropy,FA)。FA用于评价各组小鼠海马白质完整性,FA降低可反映白质损伤,白质完整性下降。检测过程:小鼠禁食10 h,吸入异氟烷(isoflurane,瑞沃德生命科技,217160701;2% isoflurane:98% O2)麻醉后置入核磁共振仪检测装置(装置内维持1.5% isoflurane:98.5% O2的麻醉环境)开始实验,整个测试开启仪器水循环加热装置,使小鼠体温保持37℃,实验参数:SI:0.60/0.60 mm、FOV:1.92 cm、TR:4 000.0 ms、TE:26.0 ms、NXS:4。方法参考周津如等(2017)研究。
1.3 免疫荧光学实验
分别从ADC组和ADE组随机取6只小鼠,取海马组织,经石蜡包埋、制片、脱水、抗原修复、抗体孵育(一抗:MBP,1:5 000,ab218011;二 抗 :羊 抗 兔 ,1:5 000,ab205718)、细胞核复染、封片、拍照等步骤进行免疫组织荧光学实验(赵娜等,2019),采用Image-Pro Plus 6.0采集两组小鼠海马MBP的积分光密度值(integrated optical density,IOD)进行统计处理。
1.4 蛋白质印迹实验
各组随机取6只小鼠,取海马组织,制备总蛋白质组织液,进行蛋白质印迹实验,检测髓鞘磷脂代谢和葡萄糖转运相关蛋白质的表达情况。蛋白印迹实验总体流程为:取海马组织,制备总蛋白样本,经电泳、转膜、封闭、抗体孵育、显影成像等步骤,获取各组目标蛋白条带,运用AlphaEaseFC蛋白成像系统软件进行图像处理,采集蛋白表达数据,之后进行统计分析。所用抗体:一抗为MBP,1/1 000,ab218011;c-PLA2,1/1 000,AF6329;HADHA,1/1 000,ab203114;SCOT,1/10 000,ab241125;MCT1,1/1 000,ab90582;MCT2,1/1 000,DF9633;MCT4,1/1 000,ab234728;GLUT1,1/100 000,ab115730;GLUT3,1/2 000,ab191071;β-actin,1/3 000,T0022。 二 抗 为 羊 抗 兔 ,1/5 000,ab205718;羊抗鼠,1/5 000,ab205719。
1.5 正电子发射断层扫描/计算机断层扫描实验
将各组进行弥散张量成像实验的小鼠恢复1周后进行正电子发射断层扫描/计算机断层扫描实验(positron emission tomography/computed tomography,PET/CT),先将小鼠禁食10 h以上,尾静脉注射氟代脱氧葡萄糖(2-氟-2-脱氧-D-葡萄糖,即18F-FDG,剂量:47.56±9.35 MBq/kg)后,小鼠静置于一安静、洁净鼠笼40 min。之后使小鼠吸入异氟烷(2% isoflurane/98% O2混合)麻醉,将小鼠置入PET/CT仪器内进行测试,同时以1.5% isoflurane/98.5% O2混合气体维持其麻醉状态,水加热系统维持小鼠体温37℃,每只小鼠CT定位扫描7 min,PET扫描18 min,空间分辨率1.35 mm,视野(FOV)12.7 cm。之后进行图像处理并采集数据,计算海马区对18F-FDG的相对摄取水平(relative Standard Uptake Value,SUVr)进行统计分析。
1.6 统计学方法
利用Graphpad Prism 7.0软件对实验数据进行处理,各指标以Mean±SEM进行数据呈现,采用独立样本t检验进行数理统计,两组间数据以P<0.05和P<0.01分别表示差异达显著性水平和极显著性水平。
2 结果
2.1 跑台运动上调小鼠海马FA值和MBP蛋白质表达
实验结果显示,与ADC组相比,ADE组小鼠海马FA值显著增高(P<0.05,图1A),免疫组织荧光学实验中MBP蛋白质表达水平显著上调(P<0.01,图1B,图1C)。蛋白质印迹实验同样证实,ADE组小鼠海马MBP表达量较ADC组小鼠显著增高(P<0.01,图1D)。
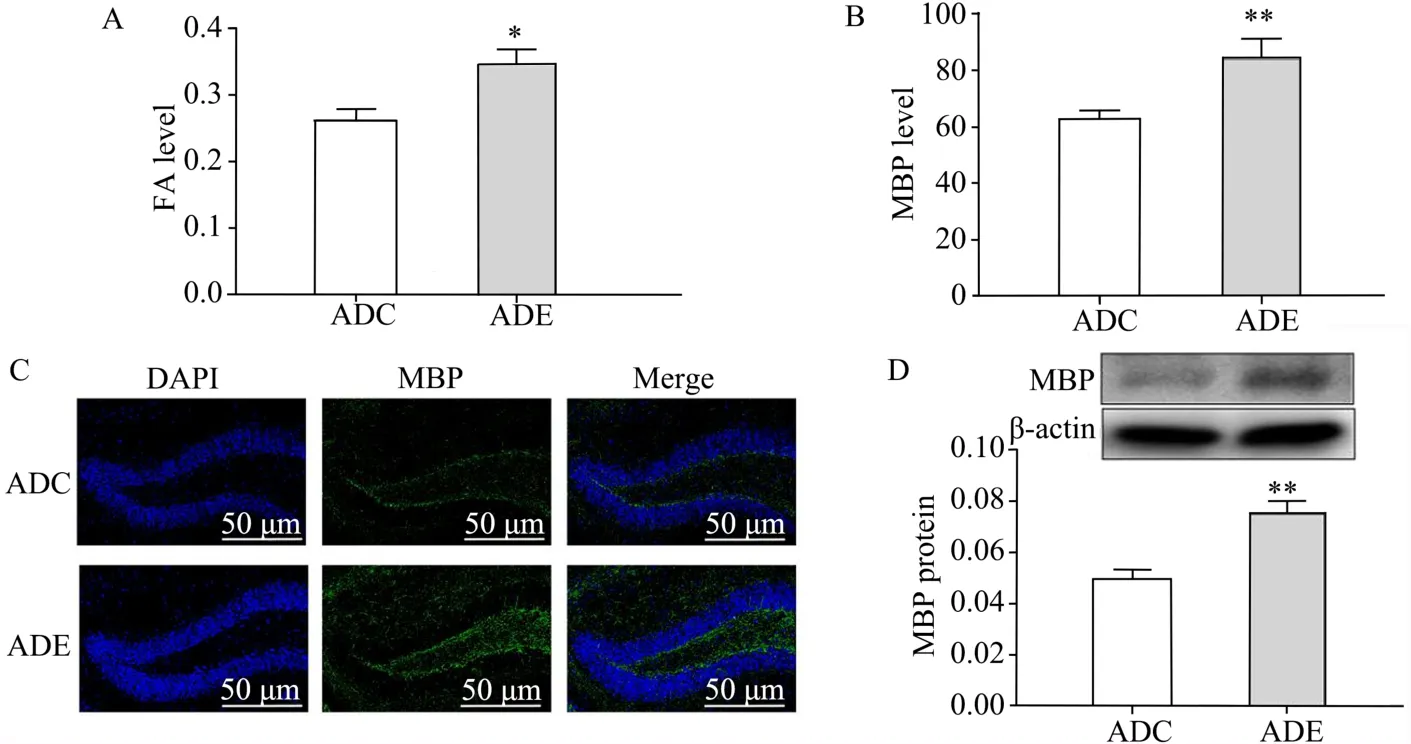
图1 各组小鼠海马FA值及MBP蛋白表达Figure 1.FAValue and MBPProtein Expression in Hippocampus of Mice in Each Group
2.2 跑台运动抑制磷脂蛋白降解相关基因的蛋白质表达
与ADC组相比,ADE组小鼠海马cPLA2蛋白质表达显著降低(P<0.01,图2A),HADHA蛋白质表达显著降低(P<0.01,图2B),SCOT蛋白质表达显著降低(P<0.01,图2C)。
2.3 跑台运动抑制小鼠海马酮体转运载体的蛋白质表达
与ADC组相比,ADE组小鼠海马酮体转运载体MCT1、MCT2、MCT4的蛋白质表达均降低(P<0.05,图3A、3B、3C)。
2.4 跑台运动上调海马葡萄糖摄取水平和GLUT1、GLLUT3蛋白质表达
实验结果显示,与ADC组相比,ADE组小鼠海马葡萄糖相对标准摄取水平显著增高(P<0.01,图4A),葡萄糖转运载体GLUT1和GLUT3蛋白质表达量均显著增高(P<0.01,图4B、4C)。
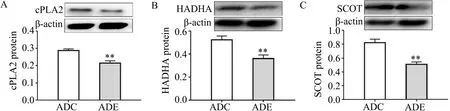
图2 各组小鼠海马磷脂蛋白降解基因cPLA2、HADHA、SCOT蛋白质表达Figure 2.Protein Expression of Phospholipid Degradation Genes cPLA2,HADHAand SCOT in Hippocampus of Mice in Each Group
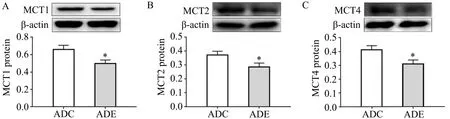
图3 各组小鼠海马酮体转运载体基因MCT1、MCT2、MCT4蛋白质表达Figure 3.Protein Expression of MCT1,MCT2 and MCT4 in Hippocampus of Mice in Each Group

图4 各组小鼠海马葡萄糖相对摄取量及葡萄糖载体GLUT1、GLUT3蛋白质表达Figure 4.Relative Uptake of Glucose and Expression of GLUT1/3 Protein in Hippocampus of Mice in Each Group
3 讨论与分析
海马是负责学习记忆功能的重要脑区,海马受损可导致学习记忆能力下降,诱发AD病理。白质是中枢神经系统重要的组成部分,对神经信号的传导过程发挥重要作用,白质结构受损,可导致认知功能障碍。近期研究显示,AD患者海马白质存在不同的损伤,且损伤程度随着AD病理临床分级的增高而加剧,DTI结果表现为FA值降低(Kantarci et al.,2017)。FA值是核磁共振弥散张量成像实验评价白质完整性的一个重要指标,代表扩散各向异性和整体扩散的比值,FA值介于0~1,FA值越趋向1代表整个弥散运动越趋向各向异性,FA值越趋向0则弥散运动越趋向各向同性,FA值越高,则白质完整性越高。对AD经典动物模型APP/PS1小鼠的研究证实,6月龄APP/PS1小鼠海马FA值比对照组小鼠显著降低,白质完整性下降(Liu et al.,2020)。本研究结果证实,ADE组小鼠海马FA值显著高于ADC组,提示12周跑台运动干预可抑制6月龄APP/PS1小鼠海马白质损伤,改善白质完整性。白质损伤在组织病理上表现为髓鞘的变化(Erten-Lyons et al.,2013)。MBP是评价髓鞘变化及完整性的生物学指标(Silva et al.,2019;Zhao et al.,2019)。为进一步验证FA值结论,检测APP/PS1小鼠海马白质状态,本研究进一步对APP/PS1小鼠海马白质关键指标进行了免疫组织荧光实验和蛋白质印迹实验检测。结果均证实,ADE组小鼠海马MBP蛋白质表达增高,与前人8月龄APP/PS1小鼠研究结果一致,MBP表达降低的结果与本研究中FA值降低的结果相互印证,进一步提示,12周跑台运动可以改善APP/PS1小鼠海马白质完整性。
髓鞘磷脂的分解代谢是脑白质损伤的重要形式,为探讨运动抑制6月龄APP/PS1小鼠海马白质损伤的机制,本研究对海马髓鞘磷脂代谢关键指标做了进一步检测。cPLA2是髓鞘磷脂代谢过程中的关键酶,常作为评价髓鞘损伤的关键指标,cPLA2表达量增高可提示髓鞘的损伤。近期研究证实,AD脑内cPLA2表达量增高(Klosinski et al.,2015),这可能是AD脑内白质下降的重要原因。本研究显示,ADE组小鼠海马cPLA2蛋白质表达量显著低于ADC组,提示12周跑台运动可通过抑制cPLA2蛋白表达,抑制海马髓鞘磷脂代谢降解。这可能是12周跑台运动改善APP/PS1小鼠海马白质完整性的一个重要原因。HADHA是线粒体三功能蛋白的关键亚基,负责长链脂肪的β-氧化,β-氧化是磷脂代谢生成酮体的关键反应。SCOT是酮体代谢的关键酶,其表达量的增高可反映酮体代谢水平的增高。近期有研究显示,髓鞘磷脂降解的生酮效应是白质损伤的原因(Yao et al.,2010)。本研究结果显示,ADE组小鼠HADHA和SCOT的蛋白质表达均低于ADC组,与cPLA2的结果相互印证。进一步提示,APP/PS1小鼠海马髓鞘磷脂降解作用增强,而12周跑台运动可抑制APP/PS1小鼠海马磷脂代谢,降低酮体代谢水平。MCT是酮体转运的关键载体,其表达增高反映酮体转运通量的增强。本研究结果显示,ADE组小鼠海马MCT1、MCT2、MCT4蛋白质表达量均低于ADC组,提示12周跑台运动可抑制APP/PS1小鼠海马酮体的生成与转运,与上述结果相互印证。综上结果提示,12周跑台运动可抑制APP/PS1小鼠海马髓鞘磷脂代谢,继而改善小鼠海马白质完整性。然而对于运动抑制APP/PS1小鼠海马髓鞘磷脂代谢,改善海马白质结构的具体机制仍不清楚。
血液葡萄糖是正常脑的主要能源物质,大脑葡萄糖摄取和供应不足,会导致脑能量缺乏,影响大脑正常的生理功能。研究表明,AD大脑葡萄糖代谢供能水平下降(Takahashi et al.,2017;Thientunyakit et al.,2020)。提示脑葡萄糖代谢水平下降与AD病理密切相关。氧化分解代谢方式是葡萄糖为大脑提供能源物质ATP的主要方式。然而近年来的乳酸穿梭学说认为,葡萄糖也可先在星形胶质细胞内发生糖酵解,生成的乳酸可再穿梭转运至神经元细胞内进行氧化供能,并认为乳酸穿梭与脑的认知功能有关(Jakoby et al.,2013;Mason,2017)。研究显示,AD脑内葡萄糖代谢存在类似癌细胞中的瓦博格效应(warburg effect),即在AD脑内,葡萄糖即使在有氧条件下仍以糖酵解供能为主,并认为糖酵解所产生的乳酸对Aβ沉积有一定的抑制效应(Atlante et al.,2017),但机制尚不明确。提示乳酸可能是大脑对抗AD病理的一种应激性中介物质,AD病理进程中表现的葡萄糖代谢水平下降,可抑制乳酸生成,加剧AD病理进程。研究证实,3月龄APP/PS1小鼠海马和皮层乳酸含量均低于同龄野生对照组小鼠,且海马Aβ水平增高,MBP表达显著降低(Zhang et al.,2018)。提示葡萄糖代谢水平下降,乳酸生成降低可能与AD脑白质损伤有关。4周的姜黄素干预可提高4.5月龄APP/PS1小鼠海马和大脑皮层的乳酸水平,提高小鼠认知功能(Lu et al.,2019)。提示改善AD脑内能量代谢状态,可改善AD病理。综上研究提示,AD脑内葡萄糖代谢水平下降,乳酸含量不足,可导致脑内能量供应不足,加剧AD病理。为满足大脑的高能量需求,AD脑内开始进行其他方式的能量代偿,这可能是AD脑内髓鞘磷脂代谢增强,造成白质损伤的重要原因。为进一步探讨12周跑台运动抑制海马磷脂代谢的机制,本研究进一步检测了APP/PS1小鼠海马葡萄糖代谢的关键指标。结果显示,ADE组小鼠海马的葡萄糖相对摄取量高于ADC组,且ADE组小鼠海马葡萄糖转运载体GLIUT1和GLUT3蛋白表达增高。结果表明,6月龄APP/PS1小鼠海马葡萄糖摄取水平降低,其原因可能和葡萄糖转运载体表达降低有关,海马葡萄糖代谢水平下降,则可引起乳酸水平下降,神经元能量供应不足,为满足海马内的较高能耗,脑内进行了白质代谢,继而对脑内的能量不足进行代偿;而12周跑台运动促进了APP/PS1小鼠海马葡萄糖的摄取,改善了小鼠海马能量代谢状态,继而降低了白质代谢供能水平,最终抑制海马白质的损伤。而运动增强APP/PS1小鼠海马葡萄糖摄取水平的机制可能和运动上调葡萄糖转运载体的蛋白质表达有关。综上提示,海马葡萄糖代谢水平降低可能是导致6月龄APP/PS1小鼠海马白质损伤的重要原因,而12周跑台运动可通过改善APP/PS1小鼠海马葡萄糖代谢水平,抑制海马酮体的代偿性供能水平,继而抑制髓鞘磷脂的代谢生酮作用,最终发挥对海马白质的保护效应。
4 结论
12周跑台运动可改善APP/PS1小鼠海马白质髓鞘完整性,抑制白质损伤。运动改善APP/PS1小鼠海马白质的机制可能与运动上调APP/PS1小鼠海马葡萄糖代谢,促进能量代谢稳态,继而抑制髓鞘磷脂代谢有关。

