脂自噬通过减少巨噬细胞脂质含量抑制泡沫细胞形成*
郑舒展, 陈茂, 杜延飞, 陈雨露, 张伟
脂自噬通过减少巨噬细胞脂质含量抑制泡沫细胞形成*
郑舒展1△, 陈茂2, 杜延飞1, 陈雨露1, 张伟1
(1西南医科大学附属医院心血管内科,四川 泸州 646000;2四川大学华西医院心内科,四川 成都 610000)
观察泡沫细胞形成不同时间脂自噬的水平,探讨脂自噬是否参与调节泡沫细胞脂质含量从而抑制泡沫细胞的形成。体外培养THP-1单核细胞,采用佛波酯诱导THP-1单核细胞48 h分化成为巨噬细胞,再用50 mg/L氧化低密度脂蛋白(oxLDL)诱导形成泡沫细胞。油红O染色脂质观察泡沫细胞形成,计算脂质含量;采用胆固醇含量测定试剂盒测量泡沫细胞内的总胆固醇(TC)和游离胆固醇(FC)含量,计算胆固醇酯(CE)含量及CE/TC比值;胆固醇外流试剂盒检测泡沫细胞的胆固醇外流率; Western blot检测自噬相关蛋白5 (Atg5)、微管相关蛋白1轻链3 (LC3)和P62的表达。荧光染料分别标记脂滴(LD)和LC3抗体,激光共聚焦显微镜检测细胞中LD与LC3的共定位以确定脂自噬水平,再分别采用自噬诱导剂雷帕霉素(Rap)和阻断剂3-甲基腺嘌呤(3MA)干预泡沫细胞,观察细胞内脂自噬水平、胆固醇含量及胆固醇外流的变化。50 mg/L oxLDL作用24 h后细胞内LD大量聚集, CE/TC比值大于50%,泡沫细胞形成。泡沫细胞形成24 h内胆固醇外流率升高,在48 h胆固醇外流率下降(<0.05)。Western blot结果显示, oxLDL作用24 h, Atg5表达及LC3-II/LC3-I比值升高, P62表达降低(<0.05);在48 h, Atg5和LC3-II/LC3-I均下降, P62表达增加(<0.05)。免疫荧光结果显示, oxLDL作用24 h, LC3与LD共定位水平升高,而在48 h下降(<0.05)。自噬诱导剂Rap上调泡沫细胞Atg5表达,提高LC3II/LC3-I比值,降低P62水平,提高泡沫细胞内LC3与LD的共定位水平(<0.05),促进胆固醇外流,降低泡沫细胞内TC和CE含量及CE/TC比值(<0.05);自噬抑制剂3MA作用则相反,可抑制Atg5表达,降低LC3-II/LC3-I比值,同时升高P62的水平,降低LC3与LD的共定位水平(<0.05),抑制胆固醇外流,增加泡沫细胞内胆固醇的含量(<0.05)。泡沫细胞形成24 h内伴有脂自噬水平的增加,在48 h脂自噬能力减弱,胆固醇外流减少。脂自噬减少泡沫细胞内胆固醇含量,增加胆固醇外流率,参与调节泡沫细胞的脂质含量,从而抑制泡沫细胞的形成。
自噬;脂自噬;巨噬细胞;泡沫细胞;胆固醇外流
动脉粥样硬化性疾病发病率高,极大地危害人类健康。粥样斑块的形成是动脉粥样硬化的主要病理改变,其主要成分为泡沫细胞,泡沫细胞以富含脂滴(lipid droplets, LD)为特征。单核细胞分化的巨噬细胞是泡沫细胞的主要来源,巨噬细胞通过A型清道夫受体吞噬大量的氧化修饰低密度脂蛋白(oxidized low-density lipoprotein, oxLDL)形成泡沫细胞,后者分泌多种炎症因子及基质代谢酶引起炎症反应,导致粥样斑块不稳定和急性心血管事件的发生[1],因此如何减轻泡沫细胞的形成是防治动脉粥样硬化的关键环节。
自噬(autophagy)是细胞在自噬相关蛋白(autophagy-related protein, Atg)调控下利用溶酶体降解自身受损细胞器和大分子物质的过程,自噬降解细胞长寿命蛋白质和受损细胞器,具有维持细胞代谢平衡及内环境稳定的作用。研究表明,动脉粥样硬化的发生与自噬有关,动脉粥样硬化斑块中存在自噬标志物与巨噬细胞共存,动脉粥样硬化晚期自噬功能减弱,同时自噬缺陷可导致胆固醇酯(cholesteryl ester, CE)的致命性堆积和促进动脉粥样硬化的发生[2]。自噬影响动脉粥样硬化的具体机制并不十分清楚,可能机制之一与脂自噬(lipophagy)有关。脂自噬是一种以LD为自噬对象发生的自噬过程,具有影响细胞能量稳态和调节细胞内脂质含量的作用[3]。目前研究显示,脂自噬缺陷可导致细胞内脂质的堆积,引起脂肪肝和肥胖的发生[4]。Quimet等[5]初步报道巨噬细胞存在脂自噬现象,脂自噬参与了巨噬细胞的胆固醇代谢,有利于胆固醇的逆向转运。泡沫细胞存在脂代谢紊乱,其形成过程中是否存在脂自噬的异常,通过调节脂自噬能否影响泡沫细胞的形成尚不清楚。因此,本项工作应用细胞体外培养实验,从脂自噬的角度研究泡沫细胞内脂质含量的调节,进一步探讨泡沫细胞参与动脉粥样硬化发生发展的病理机制。
材料和方法
1 主要试剂
人单核细胞株THP-1购自武汉普诺赛生命科技有限公司。oxLDL购自广州奕源生物科技有限公司;雷帕霉素(rapamycin, Rap)购自MedChemExpress; 3-甲基腺嘌呤(3-methyladenine, 3MA)购自Sigma; RPMI-1640培养液和胎牛血清购自Thermo Fisher Scientific;油红O染色液购自北京索莱宝科技有限公司;抗自噬相关蛋白5(autophagy-related protein 5, Atg5)、微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3, LC3)和P62抗体及Alexa Fluor 647标记的II抗均购自Cell Signaling Technology;胆固醇测定试剂盒购自北京普利莱基因技术有限公司;荧光标记胆固醇外流分析试剂盒购自BioVison;其余试剂为国产分析纯产品。
2 主要方法
2.1泡沫细胞模型建立培养THP-1细胞并传代,取其对数生长期,接种于6孔板中,于含160 nmol/L 佛波酯的无血清RPMI-1640培养液中培养48 h,诱导其分化为巨噬细胞。再将细胞培养液更换为含终浓度为50 mg/L oxLDL的无血清培养液培养24、48和72 h,观察泡沫细胞的形成情况,以细胞内CE与总胆固醇(total cholesterol, TC)的比值大于或等于50%作为泡沫细胞模型成功标准[6]。
2.2油红O染色将密度为1×108/L的THP-1细胞接种于铺有无菌盖玻片的6孔板,每孔接种2×106个进一步培养和处理,首先用佛波酯诱导分化48 h成巨噬细胞后,加入oxLDL干预,分别作用24、48和72 h,然后丢弃培养液,取出贴附有细胞的盖玻片。各组分别处理步骤如下:预冷的PBS冲洗3次,每次5 min;10%甲醛室温固定5 min;60%异丙醇清洗;PBS冲洗3次后加入油红溶液(60%油红∶40%去离子水)在室温下作用20 min;再次60%异丙醇清洗1次,换蒸馏水冲洗掉剩余染料。光镜下观察细胞形态,观察红染颗粒计数,计算单个细胞内平均脂质含量。
2.3细胞内胆固醇含量的检测取各组细胞悬液加入离心管, 211×离心10 min;弃上清液,收集细胞后加入PBS,重新混匀离心,条件如上。弃上清液,保留底部的细胞沉渣;加入细胞裂解液吹打,使细胞充分得到裂解,13 523×离心5 min;收集上清液,按照胆固醇测定试剂盒采用比色法(吸收波长为570 nm)测定TC和游离胆固醇(free cholesterol, FC)的含量,每组样本重复3次。CE含量按公式“CE=TC-FC”计算。
2.4胆固醇外流率的检测泡沫细胞胆固醇外流按照荧光检测试剂盒说明书进行,计算公式:胆固醇流出率(%)=细胞上清液荧光测值/(细胞上清液荧光测值+细胞裂解液荧光测值)×100%。
2.5Western blot实验细胞裂解法提取蛋白,酶标仪测定蛋白浓度,蛋白上样量为20μg。SDS-PAGE分离后,转至PVDF膜上, 5%脱脂牛奶封闭,加入I抗(抗Atg5、LC3、P62和GAPDH抗体,均按1∶1 000稀释), 4℃过夜; TBST清洗3次后加入辣根过氧化物酶标记的II抗,室温孵育2 h;再次TBST清洗后增强化学发光试剂显影。以Quantity One图像分析软件对图片进行分析,以目的蛋白与内参照GAPDH的比值表示蛋白相对表达量。
2.6免疫荧光实验药物干预结束后,吸除培养液,加入适量Bodipy染液至终浓度1 μmol/L,继续避光孵育10 min。吸除染液,PBS清洗1次, 4%多聚甲醛固定细胞15 min。PBS洗涤细胞爬片3次,吸干,6%山羊血清封闭30 min。加入抗LC3抗体(1∶200), 4℃孵育过夜后,再与Alexa Fluor 647标记的Ⅱ抗(1∶800) 37℃孵育60 min。细胞核采用DAPI染料避光孵育15 min,抗荧光淬灭剂封片。激光扫描共聚焦显微镜下观察采集图像,荧光信号分析及重叠系数采用ImageJ软件进行分析。
3 统计学处理
使用SPSS 20.0和OriginPro 8.0软件进行统计学分析及绘图。所有数据以均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析。以<0.05为差异有统计学意义。
结果
1 油红O染色观察泡沫细胞的形成
50 mg/L oxLDL作用于THP-1细胞源性巨噬细胞24、48和72 h,油红O染色结果显示,与0 h组比较,oxLDL作用24 h可使细胞内大量红染的颗粒聚集,单个细胞平均脂质含量显著增加(<0.05);随着时间的延长,细胞内红色颗粒呈增多趋势,48 h红染颗粒显著增加,到72 h细胞内红染颗粒最多,见图1。
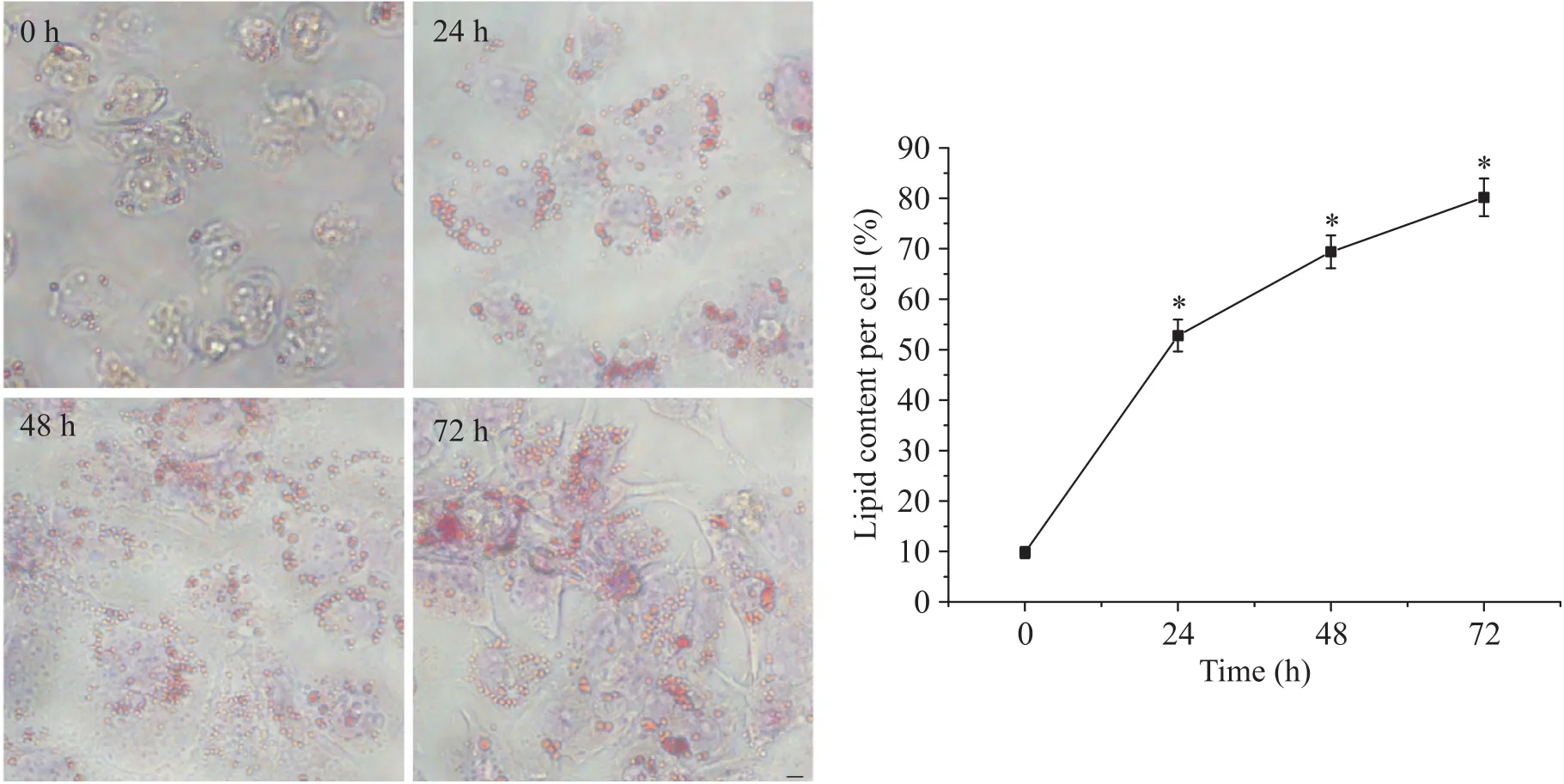
Figure 1. Lipid content in the macrophages stimulated by oxLDL at different time points (oil red O staining, scale bar=50 μm). Mean±SD. n=3. *P<0.05 vs 0 h group.
2 oxLDL诱导泡沫细胞形成不同时点细胞内胆固醇含量的变化
胆固醇含量检测结果如表1所示, oxLDL作用于巨噬细胞24 h,细胞内TC及CE含量明显增加,在48 h TC及CE含量达最高(<0.05)。oxLDL作用不同时间, TC及CE含量各组间比较有显著差异(<0.05)。与0 h组比较, oxLDL作用24 h细胞内CE/TC比值显著升高(<0.05),见表1。

表1 oxLDL诱导泡沫细胞形成不同时点细胞内的胆固醇含量
*<0.050 h group;△<0.0524 h group.
3 oxLDL诱导泡沫细胞形成不同时点细胞胆固醇外流的变化
胆固醇外流检测结果显示,随着oxLDL作用时间的延长, 12及24 h细胞的胆固醇外流均增加,在24 h达高峰,与0 h组比较差异均有统计学意义(<0.05);至48 h胆固醇外流出现下降趋势,与24 h组比较差异有统计学意义(<0.05),见图2。
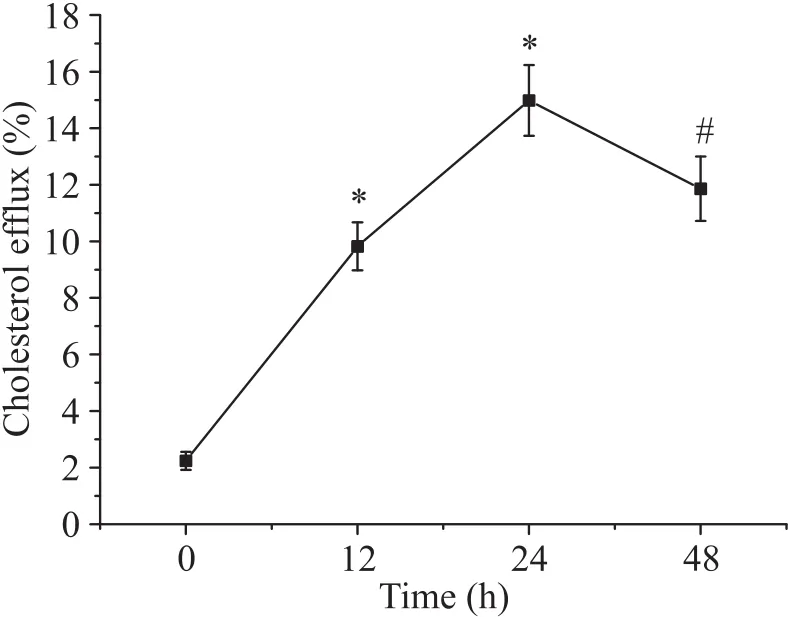
Figure 2. Cholesterol efflux in foam cells at different time points. Mean±SD. n=3. *P<0.05 vs 0 h group; #P<0.05 vs 24 h group.
4 oxLDL诱导泡沫细胞形成不同时点Atg5、LC3和P62的表达变化
Western blot结果显示, 50 mg/L oxLDL作用于THP-1细胞源性巨噬细胞12和24 h,自噬标志蛋白Atg5和LC3表达均增加,到24 h作用最明显(与0 h组比较<0.05),到48 h LC3-Ⅱ/LC3-Ⅰ比值和Atg5水平均显著下降(<0.05); 24 h以内P62蛋白的表达则随着时间的增加呈下降趋势,到48 h P62蛋白水平较24 h显著升高(<0.05),见图3。
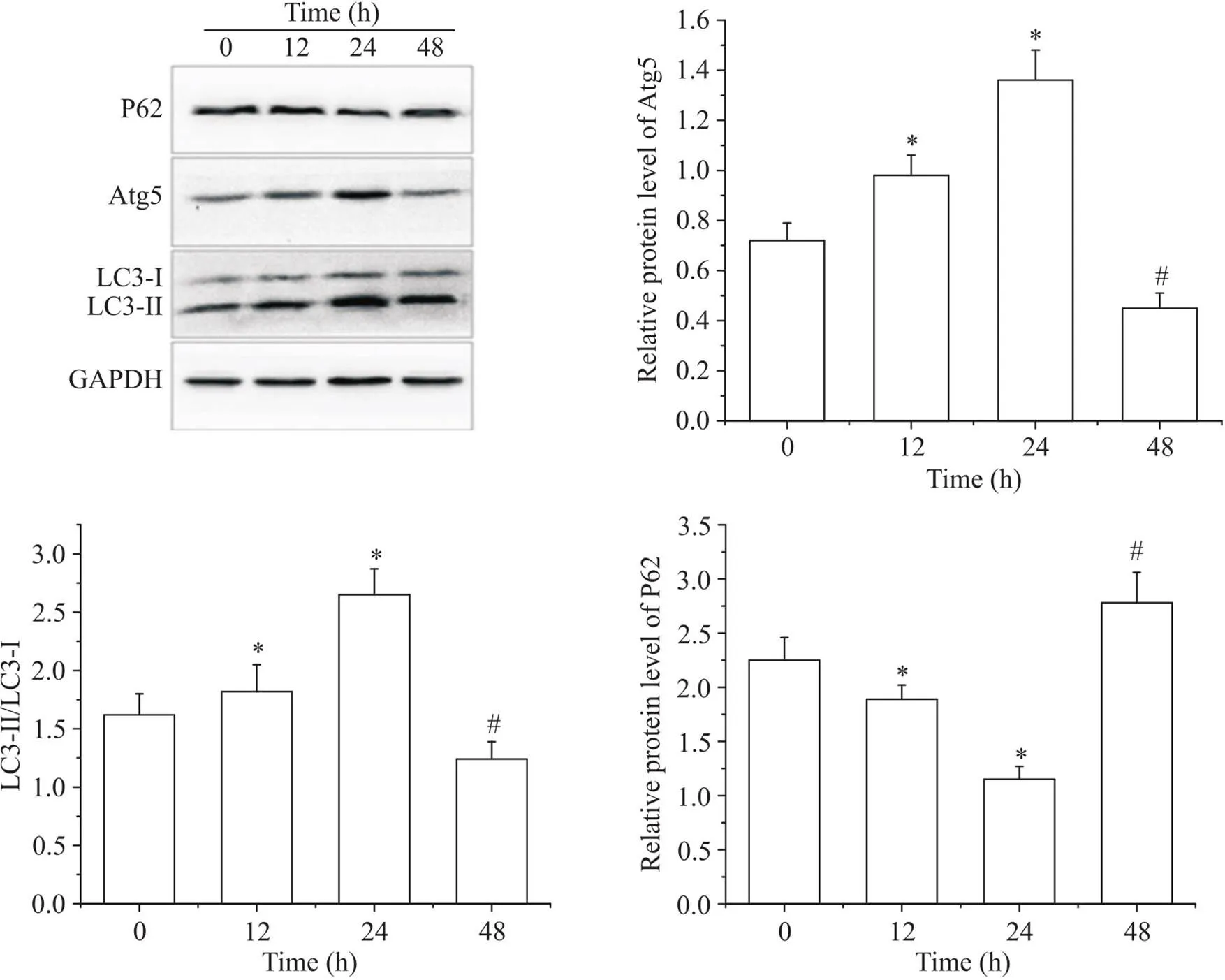
Figure 3. The relative protein expression of Atg5, LC3 and P62 in foam cells at different time points. Mean±SD. n=3. *P<0.05 vs 0 h group; #P<0.05 vs 24 h group.
5 泡沫细胞脂自噬水平的变化
免疫荧光结果显示,在基础状态下,巨噬细胞内LC3的荧光信号比较弥散,有少量红色LC3荧光信号与LD的绿色荧光信号相重叠; oxLDL作用24 h后, LC3红色荧光信号和LD绿色荧光信号均增加,与0 h组比较,两者重叠系数显著升高(<0.05);与24 h组比较,48 h泡沫细胞LC3与LD的荧光信号重叠系数显著下降(<0.05),见图4。
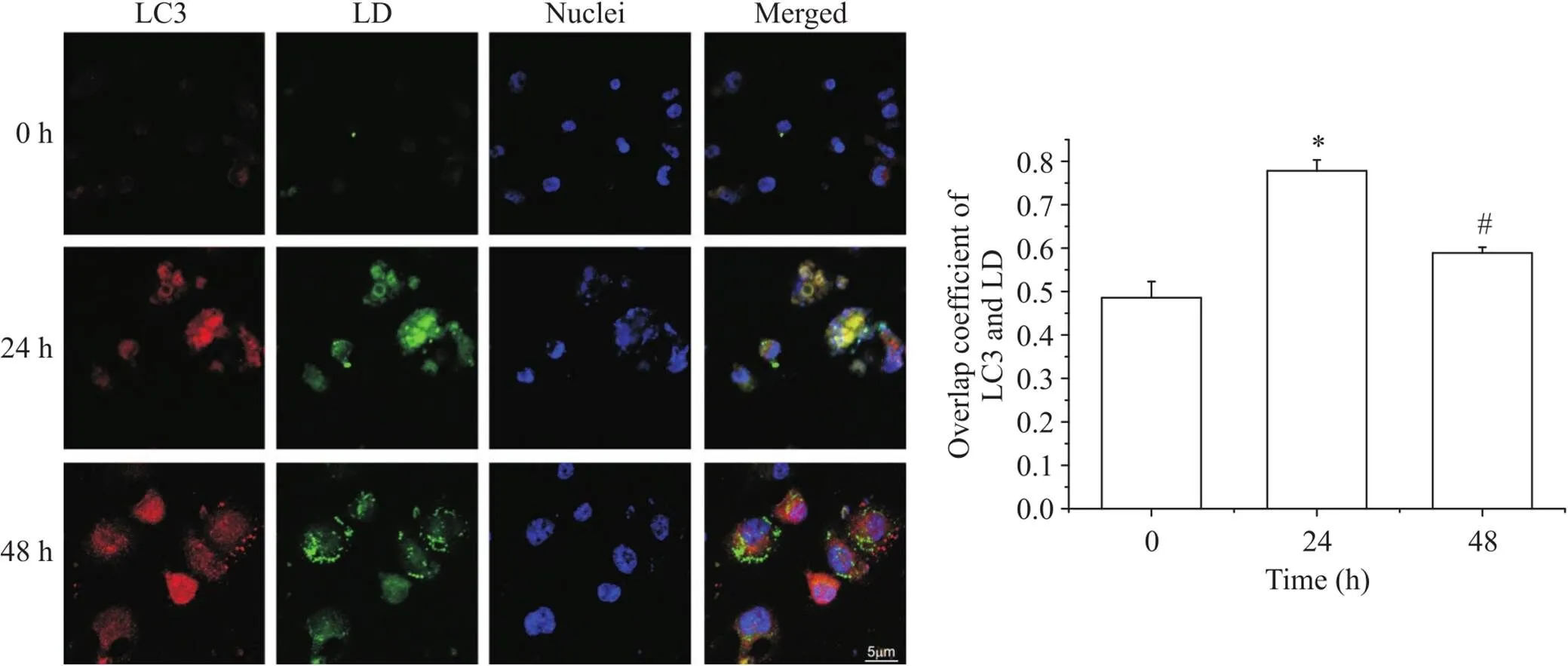
Figure 4. Lipophagy in foam cells at different time points. Scale bar=5 μm. LD: lipid droplets. Mean±SD. n=3. *P<0.05 vs 0 h goup; #P<0.05 vs 24 h group.
6 自噬诱导剂及阻断剂对泡沫细胞内Atg5、LC3和P62表达的影响
Western blot结果显示,与对照组相比, oxLDL组泡沫细胞的Atg5表达降低,LC3-Ⅱ/LC3-Ⅰ比值降低,P62水平升高(<0.05);与oxLDL组相比, oxLDL+Rap组泡沫细胞内Atg5表达增加, LC3-Ⅱ/LC3-Ⅰ比值升高, P62表达降低(<0.05);而3MA的作用相反,进一步下调泡沫细胞的Atg5表达,降低LC3-Ⅱ/LC3-Ⅰ比值,增加P62的水平(<0.05),见图5。
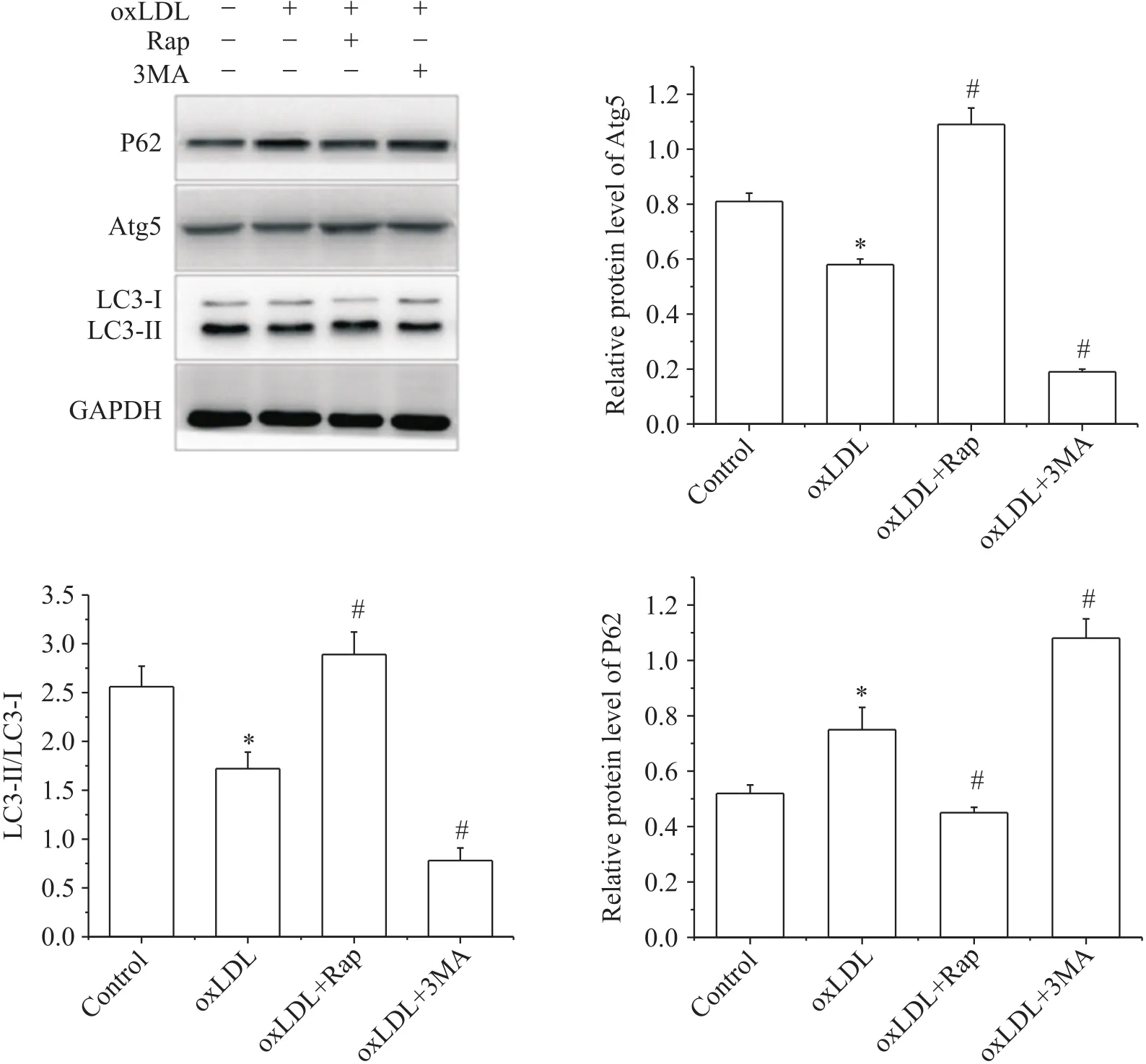
Figure 5. The effect of rapamycin (Rap) and 3-methyladenine (3MA) on Atg5, LC3 and P62 expression in foam cells treated with 50 mg/L oxLDL for 48 h. Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs oxLDL group.
7 自噬诱导剂和阻断剂对泡沫细胞脂自噬水平的影响
激光共聚焦结果显示,与空白组相比, oxLDL组LC3红色荧光信号与LD绿色荧光信号重叠系数显著升高(<0.05);与oxLDL组相比, Rap增强泡沫细胞内的LC3的红色荧光信号,同时红色LC3荧光信号与LD的绿色荧光信号重叠系数显著升高(<0.05);3MA的作用与之相反,表现为LC3与LD的荧光信号重叠系数显著降低(<0.05),见图6。

Figure 6. Lipophagy in foam cells treated with rapamycin (Rap) or 3-methyladenine (3MA). Scale bar=5 μm. LD: lipid droplets. Mean±SD. n=3. *P<0.05 vs blank group; #P<0.05 vs oxLDL group.
8 自噬诱导剂和阻断剂参与泡沫细胞内胆固醇含量及胆固醇外流的调节
如表2所示, oxLDL作用前预防性加入Rap可抑制泡沫细胞内TC和CE含量的增加,引起CE/TC比值下降(与oxLDL组相比,<0.05); 3MA的作用则相反,增加泡沫细胞内TC和CE含量,引起CE/TC比值升高(与oxLDL组相比<0.05)。与oxLDL组相比, oxLDL+Rap组胆固醇外流率显著升高(<0.05);与oxLDL组相比,预防性加入3MA明显抑制泡沫细胞的胆固醇外流(<0.05),见图7。
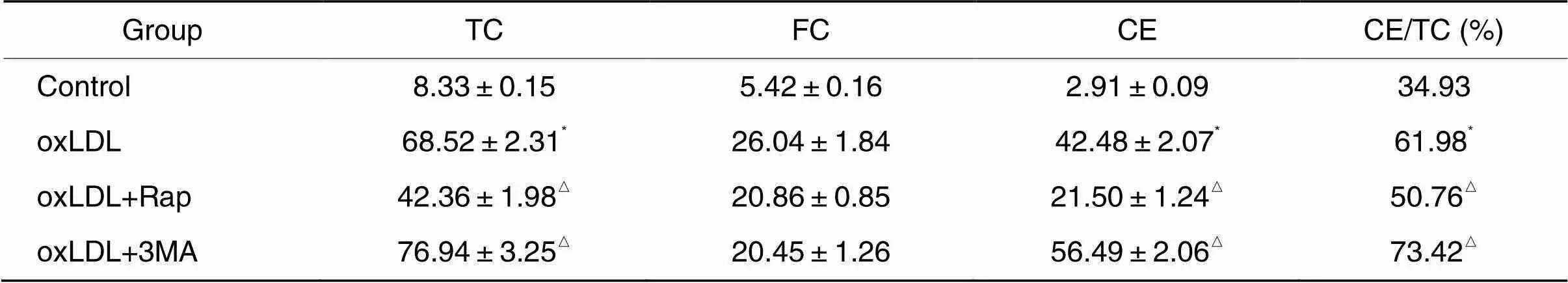
表2 自噬诱导剂Rap及阻断剂3MA对泡沫细胞内胆固醇含量的影响
*<0.05control group;△<0.05oxLDL group.

Figure 7. The effects of rapamycin (Rap) and 3-methyladenine (3MA) on cholesterol efflux of foam cells. Mean±SD. n=3. *P<0.05 vs oxLDL group.
讨论
正常情况下,巨噬细胞内胆固醇的代谢是一个动态平衡的过程,依赖于胆固醇的摄入和流出。泡沫细胞的产生是由于脂质负荷导致巨噬细胞不受调控的摄入脂质,同时胆固醇的外流受损,从而造成细胞内CE聚集,并形成LD[7]。
泡沫细胞中的主要脂质成分为游离或酯化的胆固醇。oxLDL被巨噬细胞摄取并运送至溶酶体,存在于溶酶体中的水解酶将CE水解成FC;为了避免过多FC产生细胞毒性, FC又在内质网的乙酰辅酶A乙酰转移酶1 (acetyl-coenzyme A acetyltransferase 1, ACAT1)作用下酯化成CE,储存在胞浆的LD中,因此FC和CE的比例平衡对于泡沫细胞调节其细胞内胆固醇的含量至关重要[8]。本实验通过油红O染色及细胞内胆固醇含量的测定显示, oxLDL呈时间依赖性地增加巨噬细胞内LD含量,主要增加TC和CE含量,升高CE比例。50 mg/L oxLDL作用于THP-1细胞源性巨噬细胞24 h后CE/TC比值大于50%,提示泡沫细胞形成。正常功能的巨噬细胞,即使在脂质负荷的情况下摄取脂质成分增加,但细胞可通过代偿性地增加CE的水解和外流,来达到细胞内脂质含量的稳态。若oxLDL摄取增加而胆固醇外流受损,则会导致CE堆积和泡沫细胞形成[9]。本实验观察到,泡沫细胞形成早期, oxLDL作用于THP-1细胞源性巨噬细胞24 h内,胆固醇外流增加,说明泡沫细胞形成早期可代偿性地增加胆固醇外流,从而减少细胞内CE堆积;但48 h的泡沫细胞出现胆固醇外流的减少,胆固醇外流能力受损是引起细胞内脂质聚积的重要原因。
自噬是细胞进化中的一种相对保守的自我保护机制,是将胞内物质运送到溶酶体进行降解和再利用的过程。自噬过程受30余种自噬相关基因的调控,其中Atg5主要参与自噬的启动;LC3是吞噬体双膜形成的重要组成部分,LC3有LC3-Ⅰ和LC3-Ⅱ两种形式,细胞质中LC3-Ⅰ在酶切作用下转变成LC3-Ⅱ,与自噬体膜相结合,其水平可反映自噬体的数量,LC3-II/LC3-Ⅰ升高意味着自噬过程的活化[10]。另外,SQSTM1/P62蛋白复合物(简称P62)可连接LC3和泛素化底物蛋白,被自噬过程所降解,与自噬流呈负相关[11]。目前主要通过检测这些自噬相关标志物的表达来反映自噬的水平。一般情况下,细胞自噬是非选择性的过程,其对象可以是胞内错误折叠蛋白、细胞器或胞吞物质等,但在特定的情况下,自噬的发生可以是选择性的[12],其中,脂自噬是细胞选择性针对LD发生的自噬过程,富含LC3的吞噬膜结构可包绕或局部发生于LD表面,然后双层膜逐渐向LD中心延伸、弯曲、闭合,完成LD的隔离后形成自噬体[13]。因此, LC3和LD的共定位可反映脂自噬水平。脂质含量的变化及持续的饥饿状态可诱导脂自噬的发生[13]。为了确定泡沫细胞脂自噬的水平,我们使用红色荧光标记的LC3抗体和使自噬体作用的LD染色的绿色荧光染料,通过免疫荧光的方法观察LD和LC3的共定位情况。
目前, oxLDL对巨噬细胞自噬的影响结论不一。有研究认为oxLDL可通过氧化应激诱导巨噬细胞自噬的发生[14];另一方面,oxLDL作用于巨噬细胞后存在自噬关键蛋白Atg5及LC3B表达的降低[15]。而且,在oxLDL诱导泡沫细胞形成过程中其对特异性脂自噬的影响暂未见相关报道。本研究显示,在泡沫细胞形成24 h内, Atg5表达增加, LC3-II/LC3-I比值升高,伴随有LC3与LD的共定位水平增加,说明脂自噬水平增加;同时胆固醇外流率增加,说明早期脂自噬可能作为代偿机制减少泡沫细胞内的胆固醇水平。到48 h,泡沫细胞自噬相关蛋白表达下降,LC3与LD共定位减少,说明此时脂自噬水平开始降低。另一方面,我们观察到泡沫细胞形成24 h内P62水平降低,至48 h表达增加,说明自噬流先增加后受阻,可能是脂自噬水平变化的一个重要原因。因此,对于文献报道的oxLDL对巨噬细胞产生诱导或者抑制自噬的相反作用,我们分析可能与oxLDL作用时间不一以及使用的浓度不同有关。有研究表明,高浓度的脂质水平对于自噬产生抑制作用[16]。对于脂自噬的变化,持续的脂质负荷可造成细胞内脂质超载,引起脂自噬的降解工具溶酶体的损伤[17],可能也是脂自噬能力下降的原因之一。
Quimet等[5]的研究显示,自噬参与了巨噬细胞的胆固醇代谢过程,缺乏的巨噬细胞不能有效清除胆固醇,胆固醇逆向转运受到抑制,这一过程与脂自噬有关。为进一步证实泡沫细胞内胆固醇含量受脂自噬过程调节,我们使用自噬诱导剂Rap和阻断剂3MA分别干预泡沫细胞。Rap是经典的哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)抑制剂,主要解除mTOR对自噬启动复合物的抑制作用,可诱导自噬,诱导脐静脉内皮细胞对oxLDL的自噬性降解[18]。3MA是Ⅲ型磷脂酰肌醇3-激酶的抑制剂,实验中常被用来抑制自噬早期自噬体前体的形成[19]。本研究结果显示,自噬诱导剂Rap增强泡沫细胞自噬相关蛋白表达的同时降低泡沫细胞内胆固醇含量,促进胆固醇外流,而3MA抑制自噬后,细胞内胆固醇含量增加,胆固醇外流减少,说明干预自噬可调节泡沫细胞内胆固醇的代谢,与既往文献结论一致[20]。为证实这一效果与具体影响脂自噬的过程有关,我们观察LC3与LD共定位水平的变化,自噬诱导剂能增加LC3与LD的共定位,而3MA则起抑制作用,说明脂自噬通过特异性针对LD的自噬作用参与LD的代谢,促进胆固醇外流,减少细胞内胆固醇的含量,具有抑制泡沫细胞形成的作用。
本研究结果表明,脂自噬参与泡沫细胞内胆固醇的调节,泡沫细胞形成的晚期伴有脂自噬能力的受损,增强脂自噬可抑制泡沫细胞的形成。但是,脂自噬参与泡沫细胞在动脉粥样硬化过程的具体作用及调控机制还需进一步的研究。
[1] Clement C, Alma Z. Macrophages in vascular inflammation and atherosclerosis[J]. Pflugers Arch, 2017, 469(3/4):485-499.
[2] Martinet W, De Meyer GR. Autophagy in atherosclerosis: a cell survival and death phenomenon with therapeutic potential[J]. Circ Res, 2009, 104(3):304-317.
[3] Zechner R, Madeo F, Kratky D. Cytosolic lipolysis and lipophagy: two sides of the same coin[J]. Nat Rev Mol Cell Bio, 2017, 18(11):671-684.
[4] Kounakis K, Chaniotakis M, Markaki M, et al. Emerging roles of lipophagy in health and disease[J]. Front Cell Dev Biol, 2019, 7:185.
[5] Ouimet M, Franklin V, Mak E, et al. Autophagy regulates cholesterol efflux from macrophage foam cells via lysosomal acid lipase[J]. Cell Metab, 2011, 13(6):655-667.
[6] Fogelman AM, Shechter I, Seager J, et al. Malondialdehyde alteration of low density lipoproteins leads to cholesteryl ester accumulation in human monocyte- macrophages[J]. Proc Natl Acad Sci U S A, 1980, 77(4):2214-2218.
[7] Chistiakov DA, Melnichenko AA, Myasoedova VA, et al. Mechanisms of foam cell formation in atherosclerosis[J]. J Mol Med (Berl), 2017, 95(11):1153-1165.
[8] Yu XH, Fu YC, Zhang DW, et al. Foam cells in atherosclerosis[J]. Clin Chim Acta, 2013, 424:245-252.
[9] Chistiakov DA, Bobryshev YV, Orekhov AN, et al. Macrophage-mediated cholesterol handling in atherosclerosis[J]. J Cell Mol Med, 2016, 20(1):17-28.
[10] Klionsky DJ. The updated guidelines for the use and interpretation of assays for monitoring autophagy[J]. Autophagy, 2014, 10(10):1691.
[11] Victoria CK, Aaron C, Ido L. P62 at the crossroad of the ubiquitin-proteasome system and autophagy[J]. Oncotarget, 2016, 7(51):83833-83834.
[12] Jin M, Liu X, Klionsky DJ. SnapShot: selective autophagy[J]. Cell, 2013, 152(1/2):368-368.e2.
[13] Singh R, Kaushik S, Wang Y, et al. Autophagy regulates lipid metabolism[J]. Nature, 2009, 458(7242):1131-1135.
[14] 姚树桐,李严严,刘庆华,等. 氧化低密度脂蛋白通过CD36介导的氧化应激诱导巨噬细胞自噬[J]. 中国病理生理杂志, 2015, 31(6):1002-1007.
Yao ST, Li YY, Liu QH, et al. Oxidized low-density lipoprotein induces autophagy in macrophages via CD36-mediated oxidative stress[J]. Chin J Pathophysiol, 2015, 31(6):1002-1007.
[15] He JP, Zhang GY, Pang Q, et al. SIRT6 reduces macrophage foam cell formation byinducing autophagy and cholesterol efflux under ox-LDL condition[J]. FEBS J, 2017, 9(284):1324-1337.
[16] Koga H, Kaushik S, Cuervo AM. Altered lipid content inhibits autophagic vesicular fusion[J]. FASEB J, 2010, 24(8):3052-3065.
[17] Yamamoto T, Takabatake Y, Takahashi A, et al. High-fat diet induced lysosomal dysfunction and impaired autophagic flux contribute to lipotoxicity in the kidney[J].J Am Soc Nephrol, 2017, 28(5):1534-1551.
[18] Zhang Y, Han Q, You S, et al. Rapamycin promotes the autophagic degradation of oxidized low-density lipoprotein in human umbilical vein endothelial cells[J]. J Vasc Res, 2015, 52(3):210-219.
[19] Wang X, Qi H, Wang Q, et al. FGFR3/fibroblast growth factor receptor 3 inhibits autophagy through decreasing the ATG12-ATG5 conjugate, leading to the delay of cartilage development in achondroplasia[J]. Autophagy, 2015, 11(11):1998-2013.
[20] 温柱华,付大伟,王静,等. 葛根素对RAW264.7源性泡沫细胞胆固醇摄取及外排功能的影响[J]. 中国病理生理杂志, 2016, 32(9):1614-1620.
Wen ZH, Fu DW, Wang J, et al. Effect of puerarin on cholesterol influx and efflux in RAW264.7-treated foam cells[J]. Chin J Pathophysiol, 2016, 32(9):1614-1620.
Lipophagy inhibits foam cell formation by reducing cholesterol content
ZHENG Shu-zhan1, CHEN Mao2, DU Yan-fei1, CHEN Yu-lu1, ZHANG Wei1
(1,,646000,;2,,,610000,)
To observe the changes of lipophagy during foam cells formation, and to determine the effect of lipophagy on the lipid content and cholesterol outflow of foam cells.Human THP-1 monocytes were induced by phorbol-12-myristate-13-acetate for 48 h to differentiate into macrophages, and then were incubated with 50 mg/L oxidized low-density lipoprotein (oxLDL) to form foam cells. Lipids in foam cell were stained by oil red O, and the lipid content was determined. The total cholesterol (TC) and free cholesterol (FC) levels in foam cells were measured by cholesterol testing kit. Cholesteryl ester (CE) and CE/TC ratio were calculated. The cholesterol efflux rate was detected by cholesterol efflux assay kit. The expression of autophagy-related proteins, including autophagy-related protein 5 (Atg5), microtubule-associated protein 1 light chain 3 (LC3) and P62, were detected by Western blot. The colocalization of lipid droplets (LD) and LC3 was detected by immunofluorescence staining. The autophagy inducer rapamycin (Rap) or blocker 3-methyladenine (3MA) was used to intervene foam cells, and the expression of Atg5, LC3 and P62, the co-expression of LD and LC3, the cholesterol content and the cholesterol efflux rate were determined.Formation of foam cells was observed at 24 h after stimulation with oxLDL at 50 mg/L, as indicated by intracellular CE/TC ratio exceeding 50%.Cholesterol efflux assay revealed that the cholesterol efflux rate increased within 24 h during foam cell formation but decreased after 48 h (<0.05). Western blot results displayed that the expression of Atg5 and LC3-II/LC3-I ratio were increased within 24 h of foam cell formation, but was deceased after 48 h (<0.05). The expression of P62 was decreased within 24 h but was increased at 48 h (<0.05). The colocalization of LD and LC3 was increased at 24 h but was decreased at 48 h after oxLDL stimulation. Treatment with Rap up-regulated the expression of Atg5 and LC3-II/LC3-I ratio, reduced the level of P62, increased the colocalization of LD and LC3, promoted the cholesterol efflux, anf reduced cholesterol content in foam cells (<0.05). On the contrary, 3MA inhibited the expression of Atg5, reduced LC3-II/LC3-I ratio, elevated the level of P62, decreased the colocalization of LD and LC3, reduced the outflow of cholesterol, increased the content of TC and CE, and elevated CE/TC ratio in foam cells (<0.05).Lipophagy is enhanced at 24 h but decreased at 48 h during foam cell formation. Lipophagy inhibited foam cell formation by reducing cholesterol content and increasing cholesterol efflux.
Autophagy; Lipophagy; Macrophages; Foam cells; Cholesterol efflux
R363.2; R329.2+5
A
10.3969/j.issn.1000-4718.2020.11.009
1000-4718(2020)11-1980-08
2020-04-16
2020-07-17
泸州市人民政府-西南医科大学科技战略合作项目基金资助(No.2017LZXNYD-J03)
Tel: 13378261229; E-mail: toshuzhan@126.com
(责任编辑:林白霜,罗森)

