玉米浆发酵产生物丁醇的氨基酸代谢动力学模拟
赵新河,贺壮壮,赵玉斌,马成业,任晓洁,2
玉米浆发酵产生物丁醇的氨基酸代谢动力学模拟
赵新河1,2,3,贺壮壮1,赵玉斌4,马成业1,任晓洁1,2※
(1. 山东理工大学农业工程与食品科学学院,淄博 255000;2. 山东理工大学考林腊特列杰微生物脂质国际研究中心,淄博 255000;3. 重庆市科学技术研究院,重庆 401123;4. 鲁洲生物科技有限公司,临沂 276400)
为了深入挖掘利用丙酮丁醇梭菌产生物丁醇过程中氨基酸代谢的动态过程,探究利用廉价氮源玉米浆中的氨基酸用于丙酮丁醇梭菌产生物丁醇的生产策略,寻找生产丁醇的高效率廉价氮源来降低发酵生产成本。该研究首先利用高通量测序技术对玉米浆中微生物多样性进行分析;同时基于丙酮丁醇梭菌()生产丙酮-丁醇-乙醇(Acetone-Butanol-Ethanol,ABE)碳代谢动态模型的基础上,构建氨基酸代谢模型,以此模拟15种氨基酸在利用木糖为碳源发酵生产ABE中的氨基酸代谢过程,并对氨基酸的代谢与丙酮丁醇梭菌的生物量以及ABE的合成相关性关系进行冗余分析;通过模型预测实际生产中利用玉米浆发酵时氨基酸的消耗过程。结果表明,梭状芽胞杆菌属()占细菌总数的68.76%,是玉米浆中的优势菌群;最佳参数校正后构建了氨基酸代谢模型,模拟值与试验值有较好拟合度;11种氨基酸(苯丙氨酸、苏氨酸、异亮氨酸、亮氨酸、蛋氨酸、缬氨酸、酪氨酸、甘氨酸、丝氨酸、精氨酸、天冬酰胺)在培养过程中迅速消耗用于细胞生长和溶剂生成,3种氨基酸(脯氨酸、组氨酸、天冬氨酸)保持稳定状态,同时发酵过程中谷氨酰胺积累;冗余分析表明其中5种氨基酸对发酵产物及生物量影响具有相关性,相关性排序从大到小依次为丝氨酸、甘氨酸、亮氨酸、缬氨酸、天冬酰胺;模拟预测玉米浆中缬氨酸、甘氨酸、丝氨酸在发酵过程中基本被消耗,推测其为发酵后期的营养限制性因子。该结论可证实玉米浆可作为丙酮丁醇梭菌发酵丁醇的优势氮源,为丙酮丁醇梭菌的氨基酸代谢调控及下一步利用并优化玉米浆作为氮源生产生物丁醇提供一定的理论参考和数据支撑。
动力学;模型;丙酮丁醇梭菌;ABE发酵;玉米浆;微生物组分析;氨基酸
0 引 言
近年来,微生物发酵生产生物燃料已成为当前能源研究热点。而丁醇作为新一代生物燃料,具有能量密度大、燃值高等多种优良特性[1]。梭菌是工业丙酮-丁醇-乙醇(Acetone-Butanol-Ethanol,ABE)发酵模式的主要菌株[2]。然而高成本和低利用率限制了生物丁醇的产业化发展[3]。因此,为了降低生物丁醇生产成本,迫切需要开发及优化更多廉价易降解的原料用于ABE发酵丁醇[4-5]。
农产品加工产业的快速发展,造成众多农产品加工废弃物堆弃而未能得到有效的利用。玉米浆(Corn Steep Liquor,CSL)是玉米淀粉加工的副产物,富含多种氨基酸、可溶性糖、矿物质等营养物质,常作为发酵工业的替代氮源[6]。此前有大量研究致力于玉米浆的资源化利用如青霉素合成、生物饲料生产等[6-7]。但玉米浆酸度高、霉菌毒素易超标等问题限制了其在食品生产中高值化的利用。然而,玉米浆作为氮源用于丙酮丁醇梭菌生产ABE,可以为发酵过程提供充足的氨基酸等速效氮源和促营养因子,不但可以有效降低原料成本,也为玉米浆的应用开拓了市场。Zhang等[8]以玉米加工废弃物(玉米芯水解物为碳源,玉米浆为氮源)用北耶林氏梭状芽孢杆菌SE-2生产丁醇,优化培养基成分得到总ABE浓度为19.22 g /L,丁醇浓度可达11.65 g /L,比初始培养基高42%。Maddipati等[9]以低成本营养源玉米浆代替酵母抽提液,利用梭状芽孢杆菌菌株P11发酵生产浓度1.7 g/L的生物乙醇。以上研究均证明了农产品废弃物玉米浆作为发酵原料的巨大潜力。
微生物动态代谢模型可以模拟微生物对原料中各种营养元素的利用及代谢过程,因此,可以更加精确预测培养条件和营养需求,实现原料的高效利用。Zhao等[10]以中心碳代谢为基础构建了丙酮丁醇梭菌的ABE发酵模型,该模型模拟了碳源通过糖酵解、戊糖磷酸途径(Pentose-Phosphate Pathway,PPP)等合成有机酸和溶剂(ABE)的动态代谢过程。该模型引入了与ABE发酵密切相关的丁醇抑制和醋酸盐激活等代谢调节因子,精确展现了碳源在ABE发酵过程中的代谢流分配及变化。然而该模型并未涉及氮源代谢及其动态分析,例如氨基酸等代谢相关的途径,以及氮源与溶剂合成的相关性关系。因此为本研究提供了深入挖掘ABE发酵过程中氮源动态代谢过程的思路。
本研究首先通过高通量测序技术对玉米浆中的原始微生物菌群进行了多样性分析,并在丙酮丁醇梭菌ABE发酵碳代谢模型的基础上,构建氨基酸代谢模型,以此模拟玉米浆作为氮源生产生物丁醇的氨基酸代谢消耗过程。本研究为废弃玉米浆为底物发酵生物丁醇提供了优化策略,同时以自然界中广泛存在的半纤维素的水解物作为碳源进行研究,以期为利用玉米浆—半纤维素水解物(木糖)为碳氮源生产丁醇提供参考。
1 材料与方法
1.1 菌种与培养
研究菌种为丙酮丁醇梭菌ATCC 824,该菌株被认为是具有高产溶剂能力且基因组测序完整的经典种,溶剂产量可达到11~17 g/L[11-14]。使用增强梭状芽孢杆菌培养基(Reinforced Clostridia Medium,RCM)作为种子培养基[15]。采用改良梭状芽孢杆菌生长培养基(Modified Clostridia Growth Medium,CGM)作为发酵培养基[16],并在CGM发酵培养基中加入5 g/L CaCO3作为pH缓冲剂。在3.6 L生物反应器(瑞士Infors-HT公司)中分批培养,以5%体积分数接种量接种种子液(37℃血清瓶中厌氧培养),喷入100%氮气,保证厌氧条件,100 r/min,37 ℃培养。
1.2 氨基酸的测定
氨基酸测定主要针对丙酮丁醇梭菌在CGM发酵培养基中培养时各取样点的氨基酸含量以及玉米浆中氨基酸的种类及含量测定。通过HPLC/MS/MS系统(1290 超高压液相色谱/6460 三重串联四极杆液质联用仪,美国Agilent科技公司)对上清液进行氨基酸分析。具体操作步骤参考Zhao等[10]的研究。
1.3 玉米浆微生物多样性分析
玉米浆(Corn Steep Liquor,CSL)由鲁洲生物科技有限公司提供。委托上海生工生物有限公司对玉米浆样品进行预处理并进行16SrDNA高通量测序。基因组DNA提取使用Mag-Bind Soil DNA分离试剂盒(美国Omega Bio-tek公司),按照制造商的说明进行。CSL样品提取一式三份。每个样本用琼脂糖凝胶电泳检测DNA完整性。使用Qubit2.0 DNA检测试剂盒对基因组DNA进行精确定量。引物341F(CCTACGGGNGGCWGCAG)和805R(GACTACHVGGGTATCTAATCC)用于细菌16SrDNA基因的扩增,引物ITS1F(CTTGGTCATTTAGAGGAAGTAA)和ITS2R(GCTGCGTTCTTCATCGATGC)用于真菌基因扩增。高通量测序使用Illumina Miseq™平台进行。
1.4 动态氮源代谢模型建立
基于Zhao等[10]建立的丙酮丁醇梭菌ABE发酵的碳动态代谢模型,增加氨基酸代谢网络,用以描述玉米浆为底物的氨基酸动态代谢过程。用Michaelis-Menten方程描述了各通量的动力学和细胞的比生长速率。化学反应计量关系、代谢通量动力学方程和质量平衡方程参考Zhao等[10]的研究确定。根据Rizzi等[17]提出的方法确定模型结构和动力学参数,并通过最小二乘法优化模拟结果。通过定义试验值与模拟值之间残差的加权平方和为目标函数,在参数变化范围内优化函数最小值得到参数值。根据在MATLAB中输入模型的参数值(见表1)和代谢物初始值(见表2)进行动态代谢模型模拟得到氨基酸消耗模拟曲线。运用MATLAB R2018b进行动态代谢模型模拟及数据分析,运用Canoco5对数据进行相关性分析。

表1 氨基酸代谢模型参数值
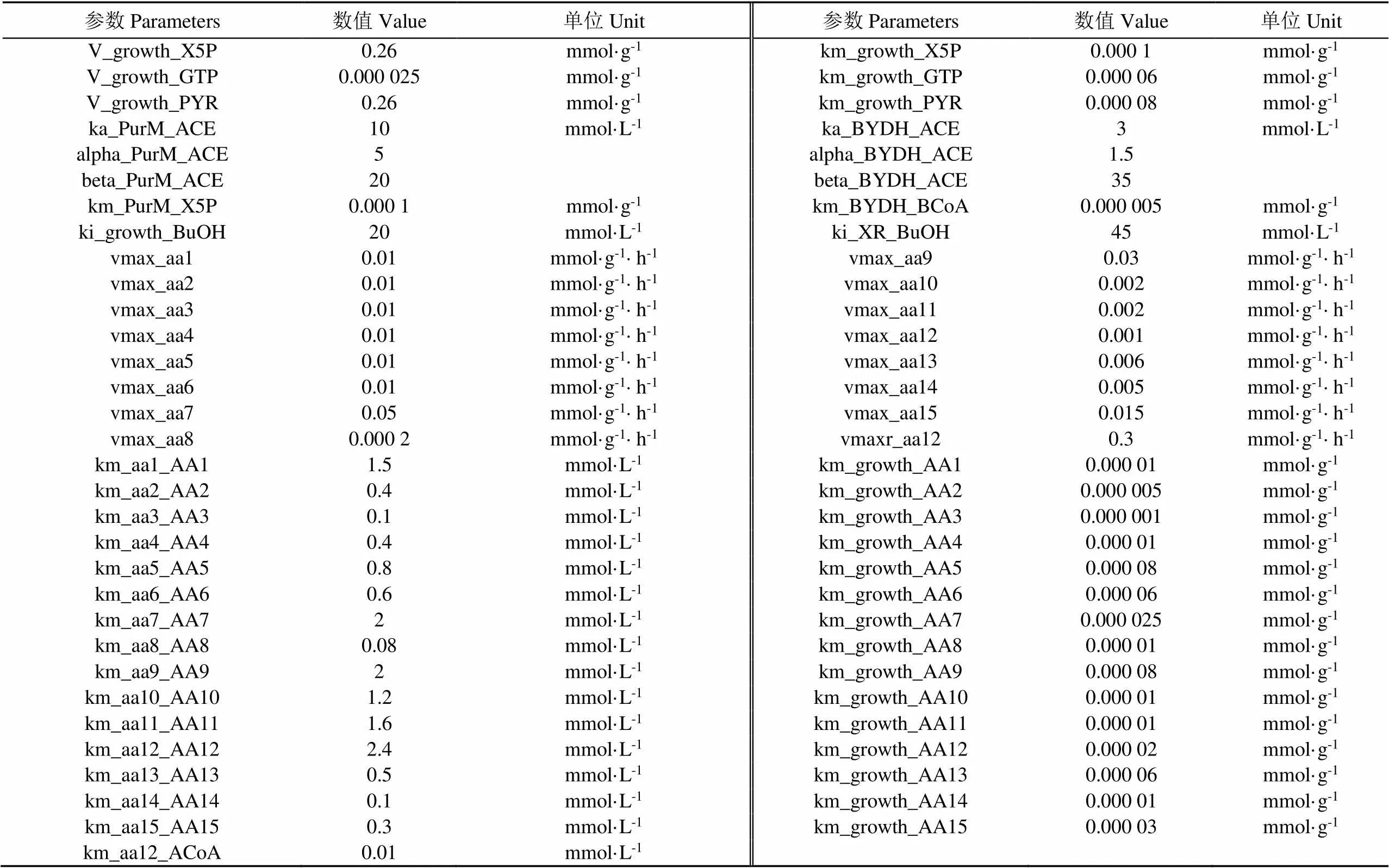
续表
注:XR:木糖还原酶;rpiA :核糖5-磷酸异构酶A;PurM:嘌呤代谢;ribA:环化水解酶II; DPO1:二磷酸核苷激酶;TKTa:转酮醇酶;PFK:磷酸果糖激酶;GAPDH:甘油醛-3-磷酸脱氢酶;PGK:磷酸甘油酸激酶;PK:丙酮酸激酶;LDH:乳酸脱氢酶;PFOR:铁氧还蛋白氧化还原酶;PTA:磷酸转乙酰酶;AYDH:乙醛脱氢酶;THL:硫解酶;CoATa:乙酰基-乙酰辅酶A-乙酸-转移辅酶A;CoATb:乙酰基-乙酰辅酶A-丁酸-转移辅酶A;AADC:乙酰乙酰辅酶A;SADH:二级醇脱氢酶;PTB:磷酸转丁酰酶;BHBD:β-羟丁酰-脱氢辅酶A;BYDH:丁醛脱氢酶;XYL:木糖;X5P:5-磷酸木酮糖;GTP:三磷酸鸟苷;R5P:5-磷酸核糖;RIBO:核黄素;F6P:6 -磷酸果糖;GA3P:3-磷酸甘油醛;G13DP:甘油酸-1,3-二磷酸;PRPO:丙醇;PEP:磷酸烯醇丙酮酸;PYR:丙酮酸;LAC:乳酸;ACoA:乙酰辅酶A;EtOH:乙醇;AACoA:乙酰乙酰辅酶A;BUT:丁酸;ACTO:丙酮;ACA:乙酰乙酸;ACE:乙酸;BCoA:丁酰辅酶A;BuOH:丁醇;AA1:苏氨酸;AA2:甘氨酸;AA3:丝氨酸;AA4:苯丙氨酸;AA5:酪氨酸;AA6:亮氨酸;AA7:天冬酰胺;AA8:天冬氨酸;AA9:精氨酸;AA10:组氨酸;AA11:脯氨酸;AA12:谷氨酰胺;AA13:蛋氨酸;AA14:异亮氨酸;AA15:缬氨酸。小写字母“aa”代表相应氨基酸酶促反应,下同。
Note: XR: xylose reductase; rpiA: ribose 5-phosphate isomerase A; PurM: purine metabolism; ribA: GTP cyclohydrolase II; DPO1: nucleoside-diphosphate kinase; TKTa: transketolase; PFK:phosphofructokinase; GAPDH: glyceraldehyde-3-phosphate dehydrogenase; PGK: phosphoglycerate kinase; PK:pyruvate kinase; LDH:lactate dehydrogenase; PFOR: pyruvate-ferredoxin oxidoreductase; PTA: phosphotransacetylase; AYDH: acetaldehyde dehydrogenase; THL: thiolase; CoATa: acetoacetyl-CoA-acetate-CoA-transferase; CoATb:acetoacetyl-CoA-butyrate-CoA-transferase; AADC: acetoacetate decarboxylase; SADH: secondary alcohol dehydrogenase; PTB: phosphotransbutyrylase; BHBD: β-hydroxybutyryl-CoA dehydrogenase; BYDH: butyraldehyde dehydrogenase; XYL: xylose; X5P: xylulose 5-phosphate; GTP: guanosine triphosphate; R5P: ribose 5-phosphate; RIBO: riboflavin; F6P fructose 6-phosphate; GA3P: glyceraldehyde 3-phosphate; G13DP: glycerate-1,3-bisphosphate; PRPO:propanol; PEP: phosphoenolpyruvate; PYR: pyruvate; LAC: lactate; ACoA: acetyl coenzyme A; EtOH : ethanol; AACoA: acetoacetyl coenzyme A; BUT: butyrate; ACTO: acetone; ACA: acetoacetate; ACE: Acetic acid; BCoA: butyryl coenzyme A; BuOH: butanol; AA1: Threonine; AA2: Glycine; AA3: Serine; AA4: Phenylalanine; AA5: Tyrosine; AA6: leucine; AA7: Asparagine; AA8:Aspartic acid; AA9: Arginine; AA10: Histidine;AA11: Proline; AA12: Glutamine; AA13: Methionine; AA14: Isoleucine; AA15: Valine. The lowercase letter “aa” represents the enzymatic reaction of corresponding amino acids, the same as below.
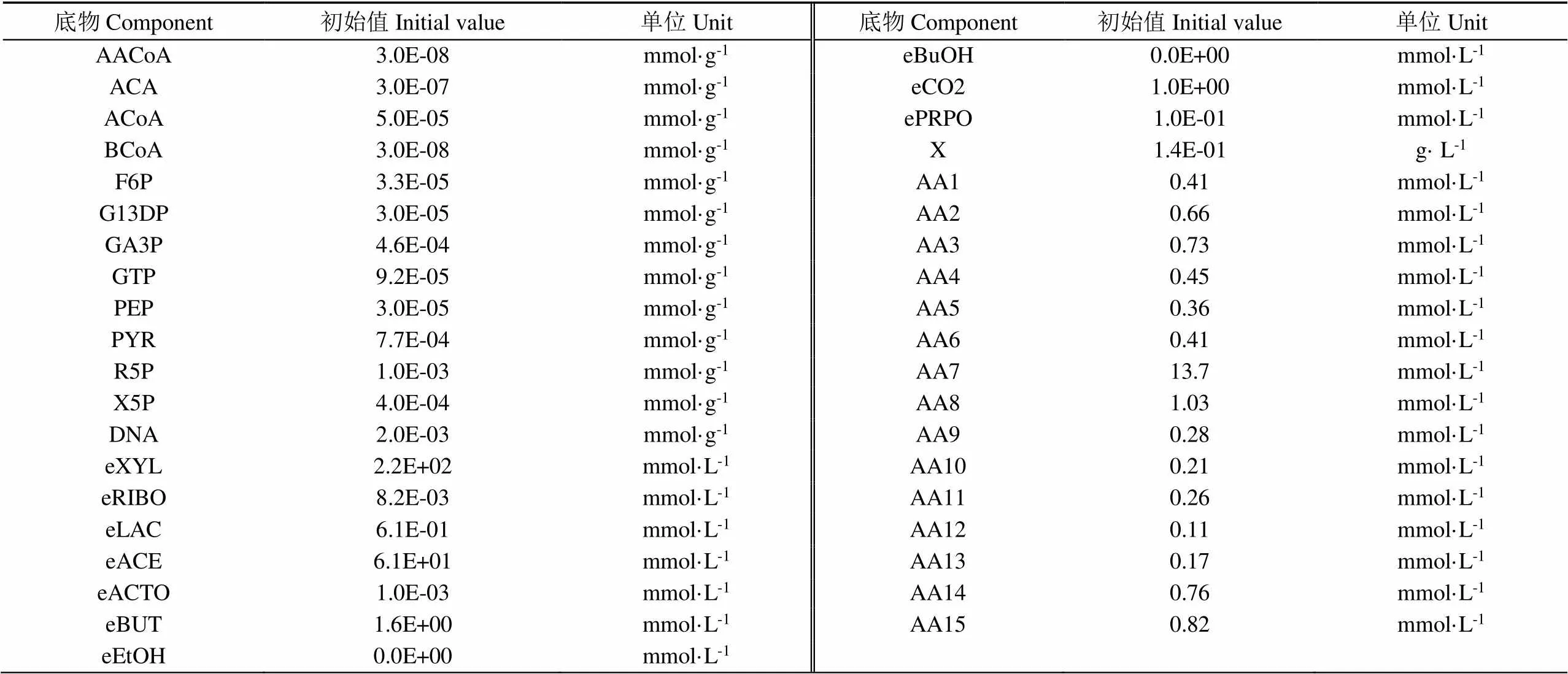
表2 氨基酸代谢模型变量初值
2 结果与分析
2.1 玉米浆微生物多样性分析
目前并没有研究报道对玉米浆中微生物多样性的分析。为了深入了解玉米浆中原始微生物的群落种类与丰度,采用高通量测序技术对玉米浆中原始微生物多样性进行分析。利用核糖体数据库工程(Ribosome Database Project,RDP)分类器对每个样本序列进行分析,将玉米浆中原始菌群的物种信息鉴定在属水平,并对各菌属的相对丰度进行了统计(图 1)。利用ITSrDNA对玉米浆中的真菌进行扩增和测序,结果显示,真菌目标区域扩增后无明显条带,表明玉米浆中真菌群落丰度极低。此外,通过16srDNA技术检测玉米浆中细菌的丰度及多样性,结果显示,玉米浆中的细菌要比真菌丰富得多。其中玉米浆中各主要的细菌菌属如梭状芽孢杆菌属()(68.76%)、芽孢杆菌属()(3.98%)、短波单胞菌属()(2.53%)、假单胞菌属()(1.6%)、乳杆菌属()(1.45%)、类芽孢杆菌属()(1.42%)、赖氨酸芽胞杆菌属()(1.41%)占到所有原始菌属的70%以上。从各菌属的占比中可以看出,梭状芽胞杆菌是玉米浆原始菌群中的绝对优势菌属。绝大多数梭状芽孢杆菌是严格厌氧微生物,能够分解碳水化合物,可以通过Stickland反应分解多种氨基酸,并且可以耐受较高的渗透压,对不良环境具有极强的抵抗力[18-19]。玉米浆中营养成分、渗透压等原始环境,更适合梭状芽孢杆菌等微生物定殖,这对玉米浆在发酵领域的资源化利用提供了理论参考。
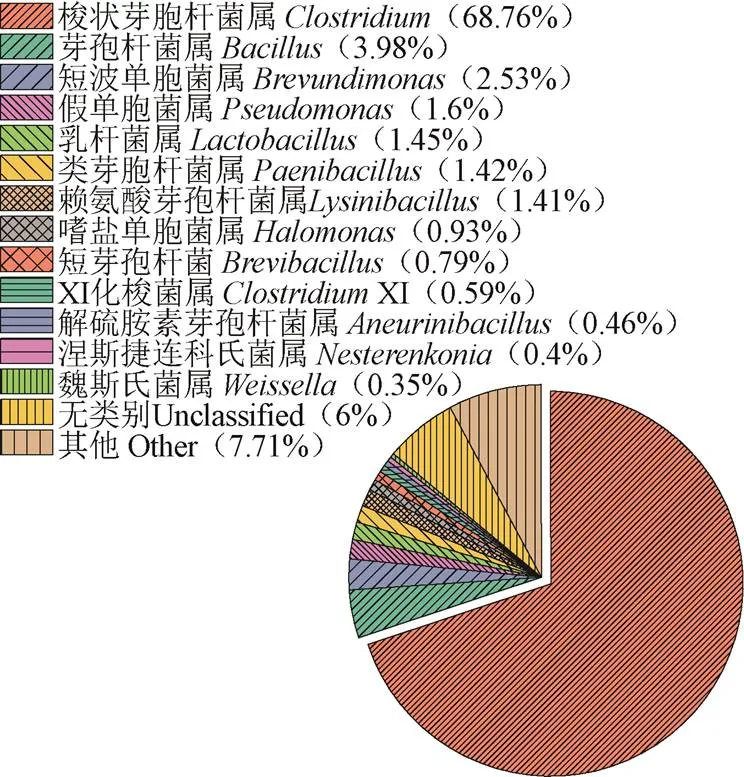
图1 玉米浆微生物群落丰度饼图
同时对玉米浆中原始菌群构建了进化树和相似性分析,并将玉米浆中菌群基因的功能分类按总体丰度进行分布,如图2所示。图2a选取总体丰度最高的前50个OUT(操作单元分类)簇的代表性序列和与其相近的数据库序列在属水平上的进化树结果,结果显示玉米浆原始菌群可分为两大簇,其中一簇菌属数量较多,另一簇只有几株菌,为赖氨酸芽孢杆菌属和枝芽胞杆菌属,两种菌属亲缘关系较近,其与其他菌属亲缘关系较远。另外梭状芽孢杆菌属多种亚种均在系统进化树的同一大簇,而且与芽孢杆菌科其他菌属在系统进化树进化关系上较亲近。因此它们在玉米浆中可以呈现较好的共生状态。

图2 玉米浆中原始菌群构建的相似进化树和基因功能分类
图2b为玉米浆原始菌群基因的功能分类分布,按总体丰度排序。从图中可以看出,特征注释的结果分为25个类别。其中大部分的功能都属于管家基因的功能,例如:[R]一般功能预测、[K]转录、[T]信号转导机制、[M]细胞壁结构、[D]细胞分裂周期控制、[L]核酸复制修复、[V]细胞防御、[O]蛋白分泌、[A]转录后修饰、[P][H]各种辅酶及离子的转运、[C]能量的合成与转化等。而与代谢相关的功能有只有[E]氨基酸转运与代谢、[G]碳水化合物转运与代谢、[I]油脂代谢及[Q]少量次级代谢产物合成等。此外,还有大量功能未知基因待进一步研究。这说明玉米浆中的原始菌群功能主要集中在对碳、氮源的转化,这与玉米浆中丰富的氨基酸以及可溶性糖含量可能有一定关系。经测定,玉米浆中含有4%的葡萄糖及50%以上的氨基酸,这进一步说明作为优势群体的梭状芽孢杆菌对糖类及氨基酸类营养物质具有较高的利用效率。为下一步选择玉米浆混菌发酵的菌株提供了理论依据。
2.2 氨基酸代谢通量分析
通过对玉米浆中原始菌群的多样性分析发现梭状芽孢杆菌是优势菌,它属于梭菌属,该属的细菌通常是严格的厌氧杆菌,能够在高效利用碳氮源的同时产生乙酸、丁酸、丙酮、乙醇、丁醇等小分子有机酸和醇类[20]。玉米浆中富含多种氨基酸,其含氮量能达到干质量的4.7%。常作为优质发酵氮源。因此,预测梭菌属微生物对玉米浆中氨基酸的利用效率将对指导玉米浆发酵提供参考与数据支撑。此前Zhao等人利用属中的丙酮丁醇梭菌发酵生产丙酮-乙醇-丁醇(ABE),并建立了该菌的碳代谢模型,本研究在此基础上,进一步检测了该菌在GCM发酵培养基中对氨基酸的消耗情况,并进一步建立和完善了其对氨基酸的氮代谢动力学模型,用于指导利用玉米浆发酵ABE过程中的氨基酸及糖的代谢研究。15种氨基酸在细胞中的代谢途径如图 3所示[21]。
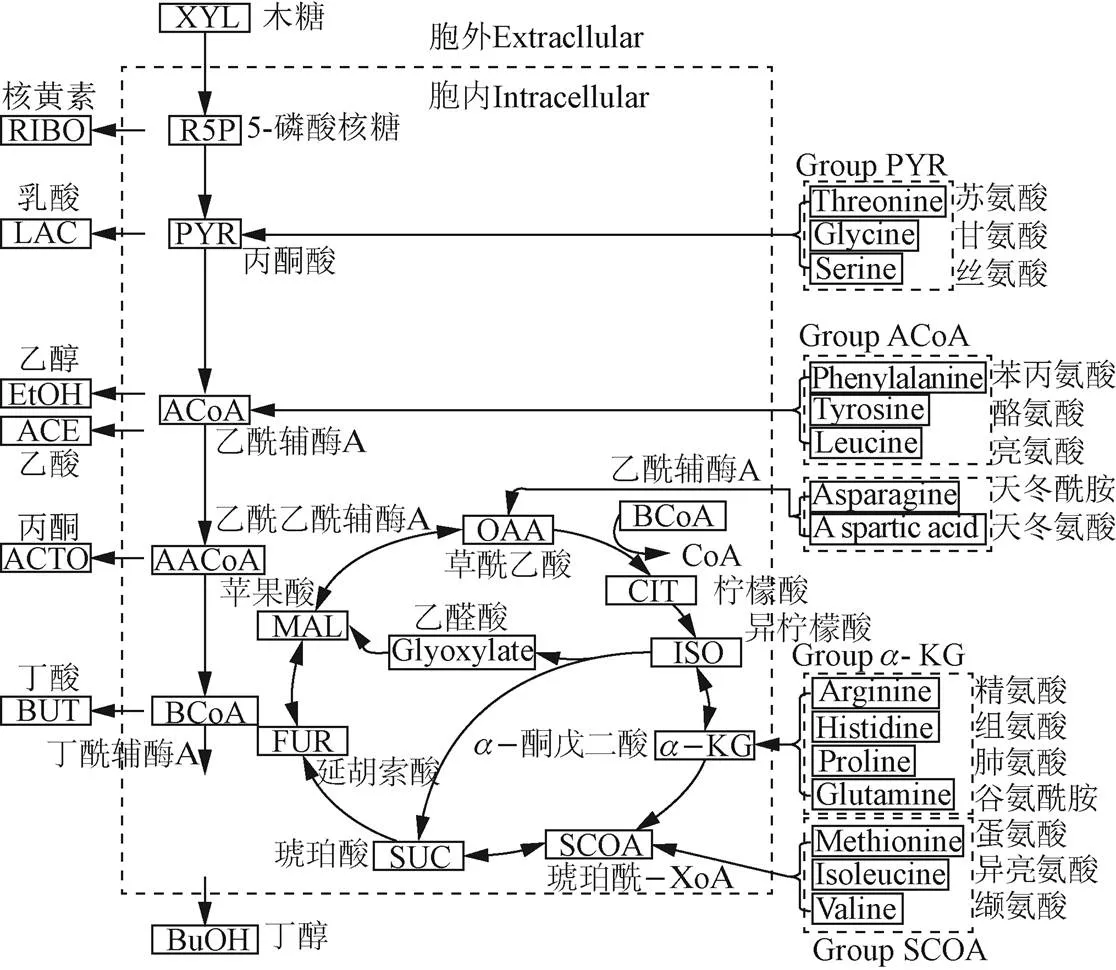
图3 丁醇梭菌15种氨基酸主要代谢路径
图4模拟了丙酮丁醇梭菌培养过程中对15种氨基酸的消耗情况。通过定义试验值与模拟值之间残差的加权平方和为目标函数,在参数变化范围内优化函数最小值得到参数值。参数校正结果显示,模型模拟曲线与试验测量值基本吻合,证明建立的氨基酸代谢模型能够较好地反映培养基中氨基酸的动态变化。结果显示,其中11种氨基酸(苯丙氨酸、苏氨酸、异亮氨酸、亮氨酸、蛋氨酸、缬氨酸、酪氨酸、甘氨酸、丝氨酸、精氨酸、天冬酰胺)在代谢过程中消耗较快,尤其在10~30 h氨基酸消耗最快,在50 h后趋于稳定。而另外3种氨基酸(脯氨酸、组氨酸、天冬氨酸)基本不被梭菌利用,其浓度保持在初始值附近。值得注意的是,谷氨酰胺浓度升高,其在0~80 h时从初始的(0.12 ± 0.003)mmol/L积累到(0.24 ± 0.04)mmol/L(图4l),这与绝大多数氨基酸被消耗的趋势截然不同。谷氨酰胺的积累说明该菌在合成ABE过程中伴随着谷氨酰胺的合成。在目前谷氨酰胺合成途径的研究中发现,谷氨酸在谷氨酰胺酶的催化作用下,被转化为谷氨酰胺[22]。同时多种氨基酸如天冬酰胺、苯丙氨酸和酪氨酸可通过柠檬酸循环中α-酮戊二酸产生谷氨酸。因此,积累的谷氨酰胺可能是从其他降解的氨基酸转化而来。同时,有研究发现丁醇会影响细胞膜的流动性和组成,导致细胞膜通透性增加[23],因此30 h后丁醇的积累增加了胞内合成的谷氨酰胺排出胞外的速率。此外,Fonknechten等[21]研究发现梭状芽胞杆菌()在消耗甘氨酸、丝氨酸、精氨酸和苏氨酸的同时也有谷氨酸、天门冬氨酸和丙氨酸等氨基酸的积累。
2.3 氨基酸代谢与产物生成通量分析
为了进一步分析丙酮丁醇梭菌氨基酸代谢与产物合成间的关系,以各氨基酸消耗与产物生成比值来表征二者的联系(图5)。结果显示,各氨基酸对乙醇消耗生成比明显高于对丙酮和丁醇的消耗生成比,这主要是因为培养过程中乙醇生成速率明显低于其他两种溶剂。这说明氨基酸合成乙醇的效率相对较低。结果表明,9种氨基酸(甘氨酸、丝氨酸、苯丙氨酸、酪氨酸、亮氨酸、精氨酸、蛋氨酸、缬氨酸、异亮氨酸)消耗速率与3种溶剂产出速率的比率随着培养时间先增加后减少,除异亮氨酸在60 h比率达到最高值外,其余均在40 h达到最高值。这是由于在0~40 h各氨基酸消耗速率升高,40 h后消耗速率减慢甚至趋近停止,而溶剂在40 h后生成速率升高,开始大量积累,导致呈下降趋势。尤其是丝氨酸、缬氨酸、苯丙氨酸、亮氨酸、甘氨酸比率明显高于其他氨基酸,这是因为它们在梭菌从产酸阶段转向产溶剂阶段的生产过程中氨基酸被迅速消耗。Amador-Noguez 等[24]研究表明,在梭菌从产酸阶段转向产溶剂阶段过程中氨基酸被迅速消耗,尤其是以丝氨酸、亮氨酸、异亮氨酸、缬氨酸变化最明显,这与本研究的结果一致。后期各氨基酸消耗缓慢,这是由于细胞在从产酸向产溶剂转变过程中诱导了溶剂合成基因上调[25],使得胞内糖酵解、TCA循环和氨基酸合成过程受到显著影响,减少了还原性TCA循环和氨基酸合成过程,使得三磷酸腺苷(Adenosine triphosphate,ATP)和还原型烟酰胺腺嘌呤二核苷酸磷酸(Nicotinamide Adenine Dinucleotide Phosphate,NADPH)更多地用于丁醇合成[24]。其他氨基酸(天冬氨酸、组织胺、脯氨酸)与溶剂的比率曲线均保持稳定的状态。另外可以看出苯丙氨酸与溶剂浓度比值的曲线拐点时间略早于其他氨基酸,这说明苯丙氨酸代谢较快,所以很快进入了较低的浓度水平。苯丙氨酸属于芳香性氨基酸,大量研究表明其更有利于进入细胞积累,消耗更快,因此其比值拐点时间较早于其他氨基酸,但容易导致溶剂生产滞后[26-27]。
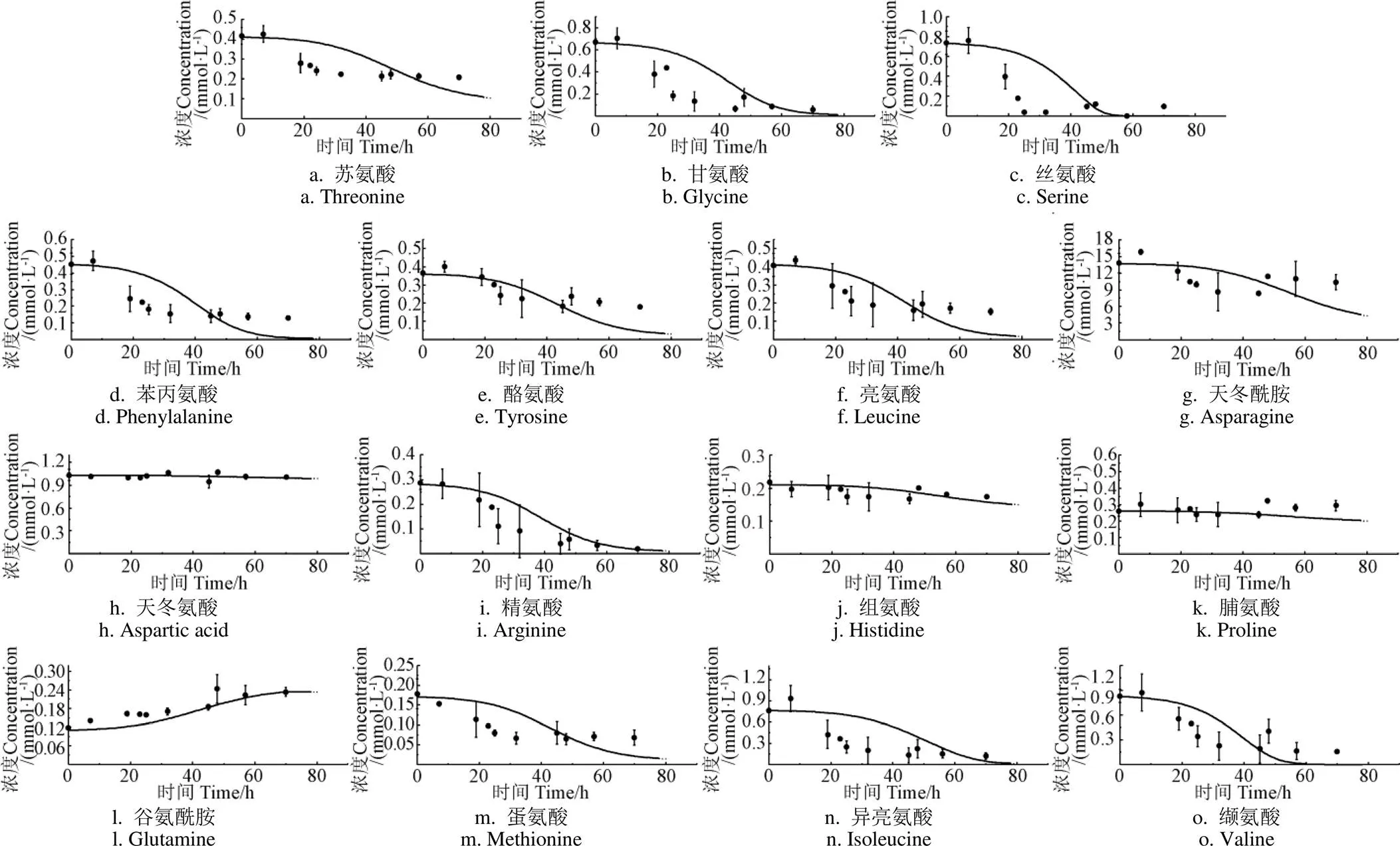
注:实心圆点为氨基酸浓度的试验测定值;实线为氨基酸浓度的模拟值。
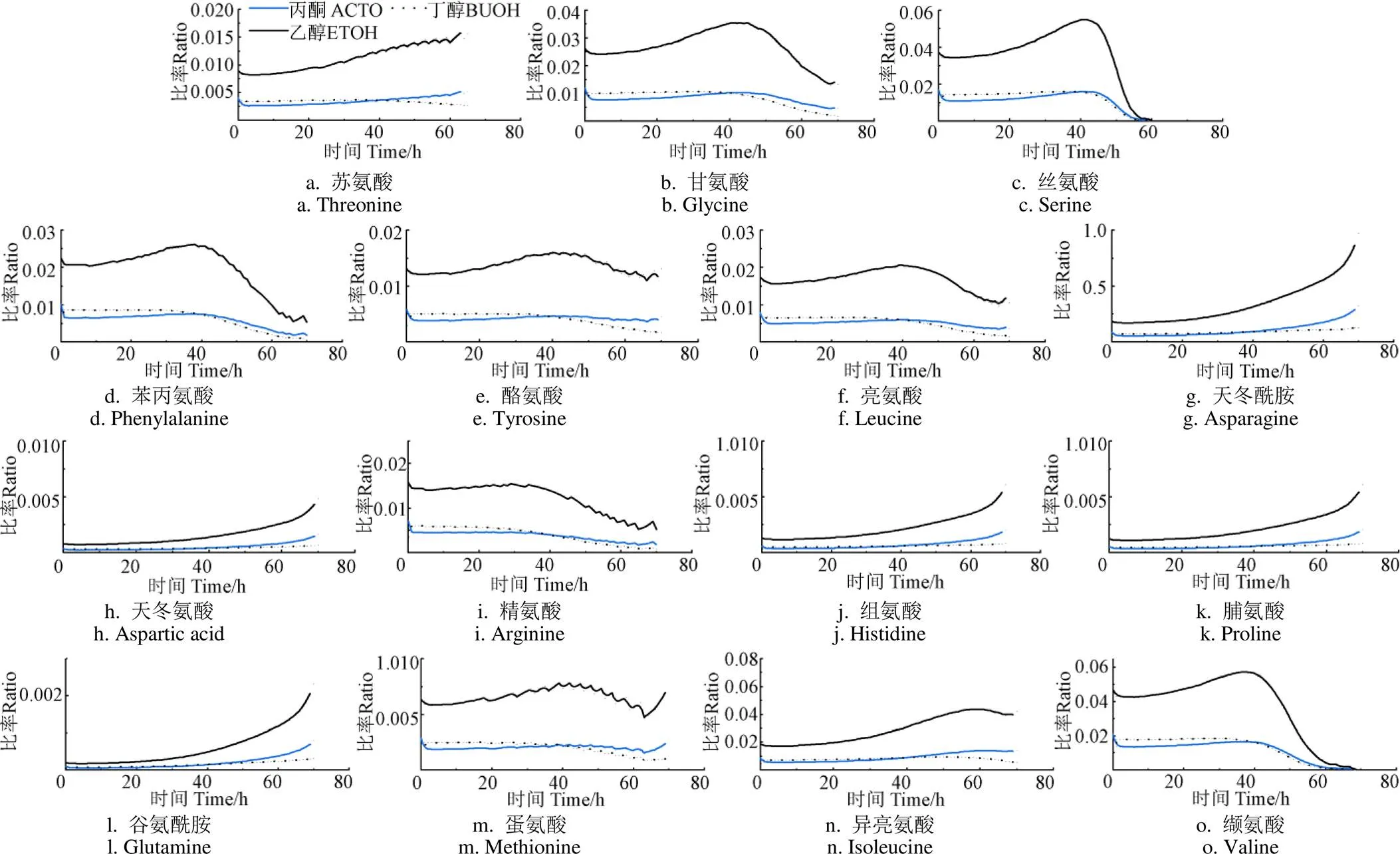
注:深色实线为各氨基酸浓度对乙醇浓度比率的模拟结果;浅色实线为各氨基酸浓度对丙酮浓度比率的模拟结果;深色虚线为各氨基酸浓度对丁醇浓度比率的模拟结果。
在丙酮丁醇梭菌中,除了代谢产生乙酸、丙酸、丁酸及相应的溶剂乙醇、丙酮及丁醇之外,生物量的积累及核黄素的合成也消耗了大量的碳、氮源。图6表示了各氨基酸浓度与生物量及核黄素浓度之间的比率。初始时各氨基酸与核黄素浓度比率曲线呈现断崖式下降,这是由于培养初期培养基中核黄素生成速率低,处于延滞状态,导致比率过高。6种氨基酸(甘氨酸、丝氨酸、苯丙氨酸、亮氨酸、精氨酸、缬氨酸)代谢速率与生长速率的比率总体上随着培养时间先增加后减少,在50 h出现峰值,这是由于这几种氨基酸在0~50 h消耗速率增大,50 h后氨基酸基本不消耗,而此时生物量达到最大,达到生长稳定期。因此50 h比率最高,50 h后生物量呈现负增长,导致比率曲线下降。其他氨基酸培养过程中消耗速率很低,而细胞量迅速增长,所以曲线呈增长状态。前期糖代谢和氨基酸代谢有利于细胞生长,但不利于丁醇合成[28]。氨基酸与生物量比率变化程度最大的是丝氨酸、甘氨酸和缬氨酸。Liu等[29]研究发现添加氨基酸,尤其是甘氨酸与丝氨酸能明显促进细胞密度增长,而添加组氨酸并不能促进细胞生长或丁醇的生成,推测是由于最终产物丁醇对磷酸戊糖途径的抑制作用,这与本研究的结果一致。在50 h丁醇生产速率最高,有研究报道丁醇对细胞有一定毒性,溶剂浓度达到抑制水平导致后期细胞裂解[30]。另外丙酮丁醇梭菌内自溶酶在指数期结束后达到最大值,后期菌体自溶,释放氨基酸和还原力[31],导致氨基酸消耗减少,溶剂生产减少导致部分氨基酸比率呈迅速下降趋势。Nimbalkar等[32]研究表明缬氨酸和精氨酸组合以及鸟氨酸和苯丙氨酸作为良好的氮源,可以促进细胞生长,提高ABE产量。原因可能是精氨酸通过瓜氨酸快速代谢成鸟氨酸,从而转化为能量ATP[21,33];另一个原因可能是精氨酸促进了醋酸盐的形成,进而致使丙酮产量增加[34]。同时这几种氨基酸消耗速率与核黄素生成速率在50 h时呈现急剧下降的趋势,这是由于各氨基酸在50 h时消耗速率迅速减低,甚至不被消耗,而核黄素生长速率达到最高,导致比率曲线迅速下降。
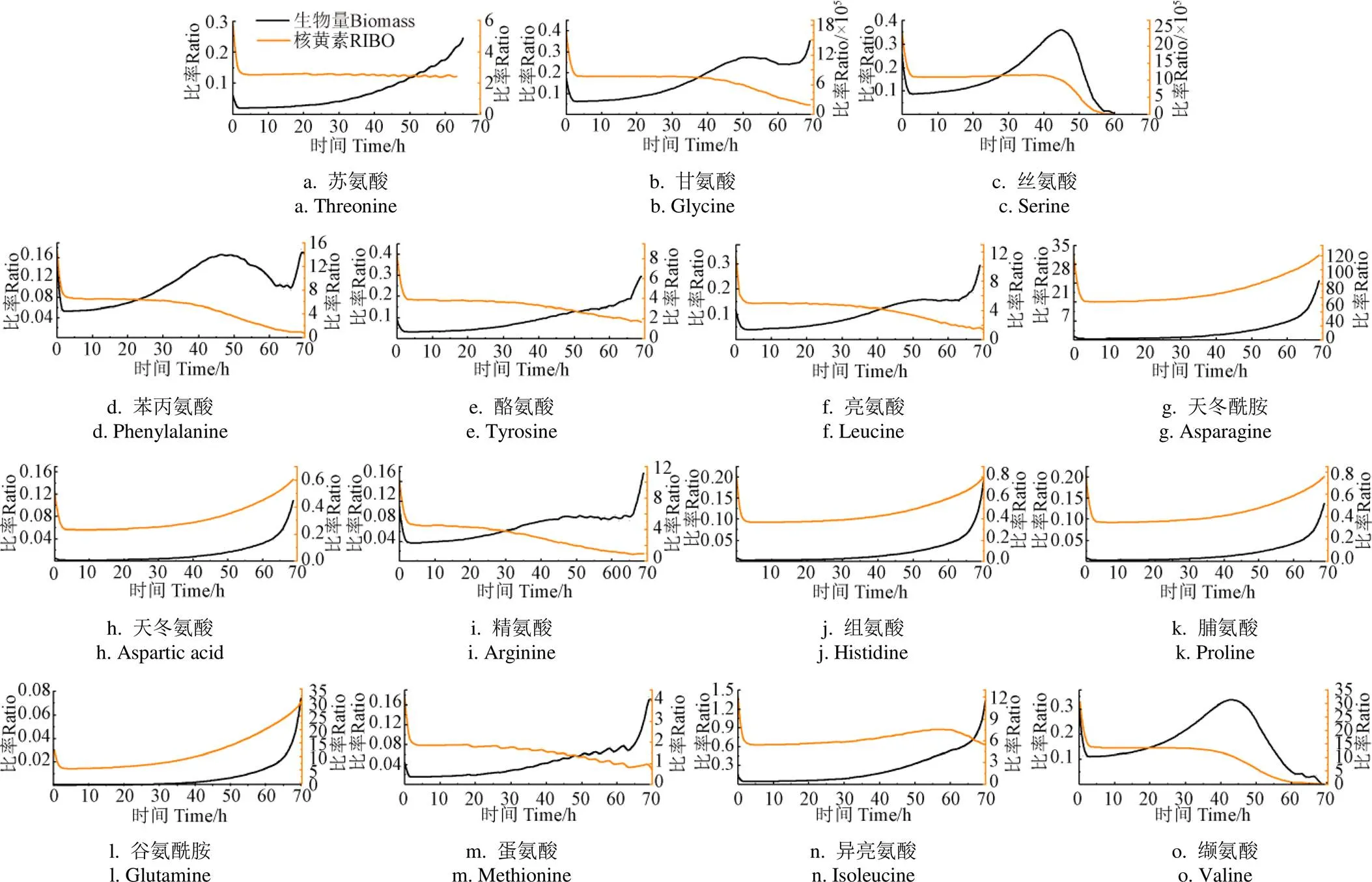
注:浅色实线为各氨基酸浓度对核黄素浓度比率的模拟结果;深色实线为各氨基酸浓度对生物量比率的模拟结果。
2.4 培养过程中氨基酸与合成产物的相关性分析
为了进一步分析氨基酸的代谢与丙酮丁醇梭菌生物量以及ABE、核黄素合成的相关性关系,以各时间段试验数据对15种氨基酸和产物进行冗余分析,结果如图7所示。2个排序轴解释了各氨基酸与各产物的累积变化率分别为95.23%和3.19%,2个排序轴共同解释了98.42%的样本信息,说明生物量、溶剂生成、核黄素合成与15种氨基酸中的5种氨基酸(丝氨酸、天冬酰胺、甘氨酸、亮氨酸、缬氨酸)的代谢消耗有关。其中亮氨酸对结果影响解释度为64.4%,可以认为是对产物影响的主要氨基酸。从图中可以看出,5种氨基酸对产物影响相关性排序从大到小依次为丝氨酸、甘氨酸、亮氨酸、缬氨酸、天冬酰胺;生物量与各产物对氨基酸消耗影响相关性排序从大到小依次为生物量、丙酮、乙醇、丁醇、核黄素。以上5种氨基酸向量与丁酸向量趋近垂直,说明氨基酸代谢与丁酸合成相关性低。丁酸向量与生物量和丙酮向量趋近垂直,与乙醇、丁醇、核黄素向量夹角呈钝角,说明丁酸与生物量、丙酮合成相关性较低,与乙醇、丁醇、核黄素合成相关性较高,这与丁酸代谢产生丁醇的代谢理论相对应。乙酸盐向量与所有产物向量夹角均呈钝角,说明乙酸盐有利于产物形成,尤其是与核黄素向量夹角趋近180°,说明乙酸盐存在可以促进核黄素的合成。这也验证了Zhao等[10]前期工作中添加乙酸钠能够刺激核黄素的产生的结论。
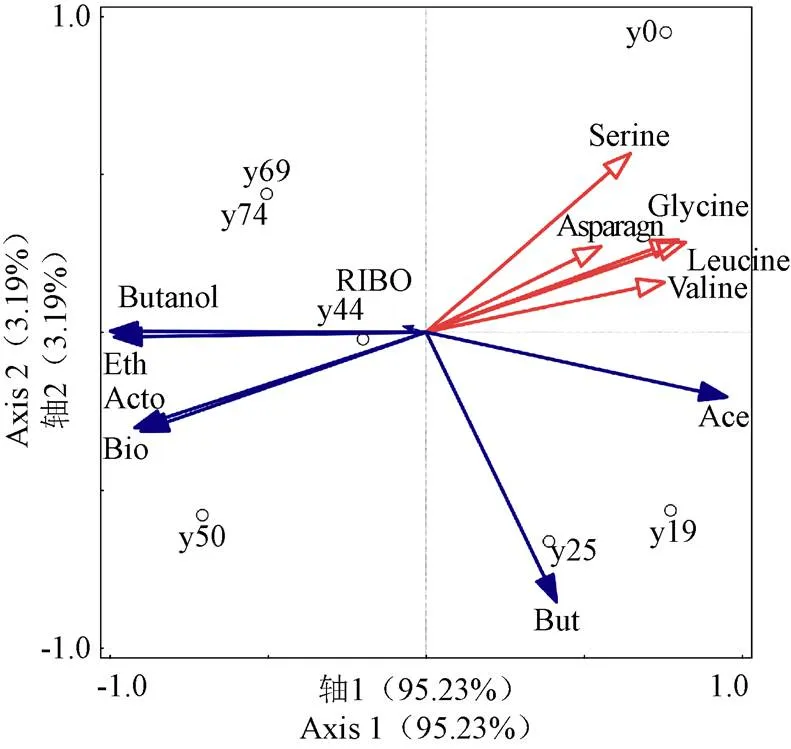
注:But:丁酸;Ace:乙酸;Acto:丙酮;RIBO:核黄素;Bio:生物量;Eth:乙醇。
三磷酸鸟苷(Guanosine triphosphate,GTP)是核黄素产生的重要通量节点。氨基酸通过嘌呤代谢为其从头合成提供碳氮源。因此,部分氨基酸参与嘌呤代谢时与GTP、核黄素的产生有关。例如,甘氨酸已经被证明可以生成嘌呤环原子中5C和7N[22]。同时,甘氨酸很容易被甘氨酸羟甲基转移酶催化成丝氨酸,被l-苏氨酸醛缩酶催化成苏氨酸。因此,甘氨酸的消耗导致了核黄素的产生,在核黄素的生成中应发挥特殊的作用,这与图6和图7所示的结果一致。另一种对核黄素敏感的有机氮源精氨酸(图6 i)也表现出类似的消耗趋势。同时,作为主要氮源之一,天冬酰胺在培养中的利用率也较高(图4g)。因此,本研究中甘氨酸、精氨酸和天冬酰胺对核黄素的积累起到了促进作用。
2.5 氨基酸代谢模型预测玉米浆ABE发酵
在丙酮丁醇梭菌的氨基酸代谢模型基础上,对利用木糖和玉米浆为主要原料发酵ABE的氨基酸消耗过程进行模拟预测。模型使用玉米浆中氨基酸的含量作为初始值,模拟结果如图8所示。其中苏氨酸、甘氨酸、丝氨酸、苯丙氨酸、缬氨酸在发酵过程中被迅速消耗,且在60 h时缬氨酸完全消耗。其中精氨酸消耗量最高,消耗约7 mmol/L,说明培养过程中梭菌大量利用精氨酸用于细胞生长和产物代谢。主要原因为精氨酸通过瓜氨酸快速代谢成鸟氨酸,鸟氨酸可以进一步分解产生ATP[21]。同时,精氨酸的存在也会促进乙酸盐形成,导致丙酮产量增加[34]。另外,丁醇胁迫也会对精氨酸和嘧啶代谢有调节作用[28]。谷氨酰胺在玉米浆为原料的模拟预测中最终积累浓度达到0.15 mmol/L,但在CGM发酵培养基的实验中却增加了约0.10 mmol/L。其他氨基酸,如蛋氨酸、异亮氨酸在发酵培养实验中被迅速消耗,但在模拟预测中无明显消耗。分析原因发现,玉米浆中这两种氨基酸的初始浓度是CGM发酵培养基的10倍左右,说明初始浓度升高并不会大幅增加蛋氨酸、异亮氨酸的消耗。另外缬氨酸、甘氨酸、丝氨酸在玉米浆发酵的预测值都被完全消耗,说明丙酮丁醇梭菌对这3种氨基酸的利用率最高。因此,可以考虑在发酵后期补加消耗较快的氨基酸,以避免造成营养限制因子的缺乏。通过氨基酸代谢模型模拟玉米浆中氨基酸的消耗过程,为下一步利用玉米浆作为氮源生产生物丁醇提供数据支持。
3 讨 论
玉米浆中拥有丰富的氨基酸、可溶性糖以及溶磷等营养物质,是作为微生物培养基中廉价氮源的最佳选择之一。但是,玉米浆中特有的营养物质组成,以及与细胞生长相关的抑制物质的存在,使其对不同微生物有着一定的偏好。但目前,仍未有关于玉米浆中原始菌群的微生物多样性分析的研究。本研究通过16SrDNA测序技术分析了玉米浆中微生物多样性及其菌属的系统进化树和基因功能预测结果,发现梭状芽孢杆菌是玉米浆中占有绝对优势的菌属。梭状芽孢杆菌是严格厌氧细菌,在生物技术工程中有较多的应用,比如利用其生物代谢丙酮、丁醇、乙醇等有机溶剂,以及有机酸、神经毒素等[35]。本研究在丙酮丁醇梭菌发酵生产ABE,建立该菌的碳代谢模型基础上完善并建立了氮代谢模型,并模拟了发酵培养基中15种氨基酸的代谢过程。
氨基酸是许多生化反应的前体,梭状杆菌利用氨基酸具有优先顺序,通过Stickland反应利用多种氨基酸[21,33]。氨基酸的代谢需要大量ATP和NADPH,因此溶剂合成过程中,需要减少氨基酸合成用于溶剂生产[24]。草酰乙酸是多种氨基酸的合成前体,可以通过调节丙酮酸羧化酶,降低其活性,减少丙酮酸流向草酰乙酸[36]。大量研究用来表征氨基酸在丙酮丁醇梭菌发酵ABE中的作用。在本研究中,苯丙氨酸、酪氨酸、蛋氨酸在培养液中均明显被消耗。多个研究表明添加芳香族氨基酸(苯丙氨酸和酪氨酸)以及天冬氨酸族氨基酸(赖氨酸和蛋氨酸)促进了丙酮丁醇梭菌胞内溶剂快速积累,有利于溶剂生产和细胞存活[27,37]。在发酵系统中存在氨基酸能够促进细菌代谢,提高产品产量和菌株的耐酒精性。Wang等[38]研究表明增加苏氨酸、甘氨酸、丙氨酸、苯丙氨酸、酪氨酸、色氨酸、天冬氨酸、谷氨酸等氨基酸浓度水平可以提高梭菌对丁醇的耐受性。梭菌能够调节氨基酸代谢,增加胞内氨基酸积累来适应丁醇胁迫,如Amador-Noguez等[24]检测到在酸向溶剂转化过程中胞内支链氨基酸(缬氨酸、亮氨酸、异亮氨酸、谷氨酰胺的变化。因此可以通过添加外源调控氨基酸代谢进一步优化溶剂生产和细胞耐性。如Luo等[39]添加了乙酸盐刺激氨基酸在胞内积累,进而适应丁醇胁迫。Ding等[40]添加Na2SO4/CaSO4作为电子受体刺激苯丙氨酸、蛋氨酸、亮氨酸、缬氨酸胞内积累,丁醇浓度升高至12.96 g/L。但Liu等[29]的研究认为多种氨基酸只与正常细胞代谢相关,并没有显著增加丁醇的产量。因此需针对氨基酸在丙酮丁醇梭菌中的代谢途径及作用作进一步研究。
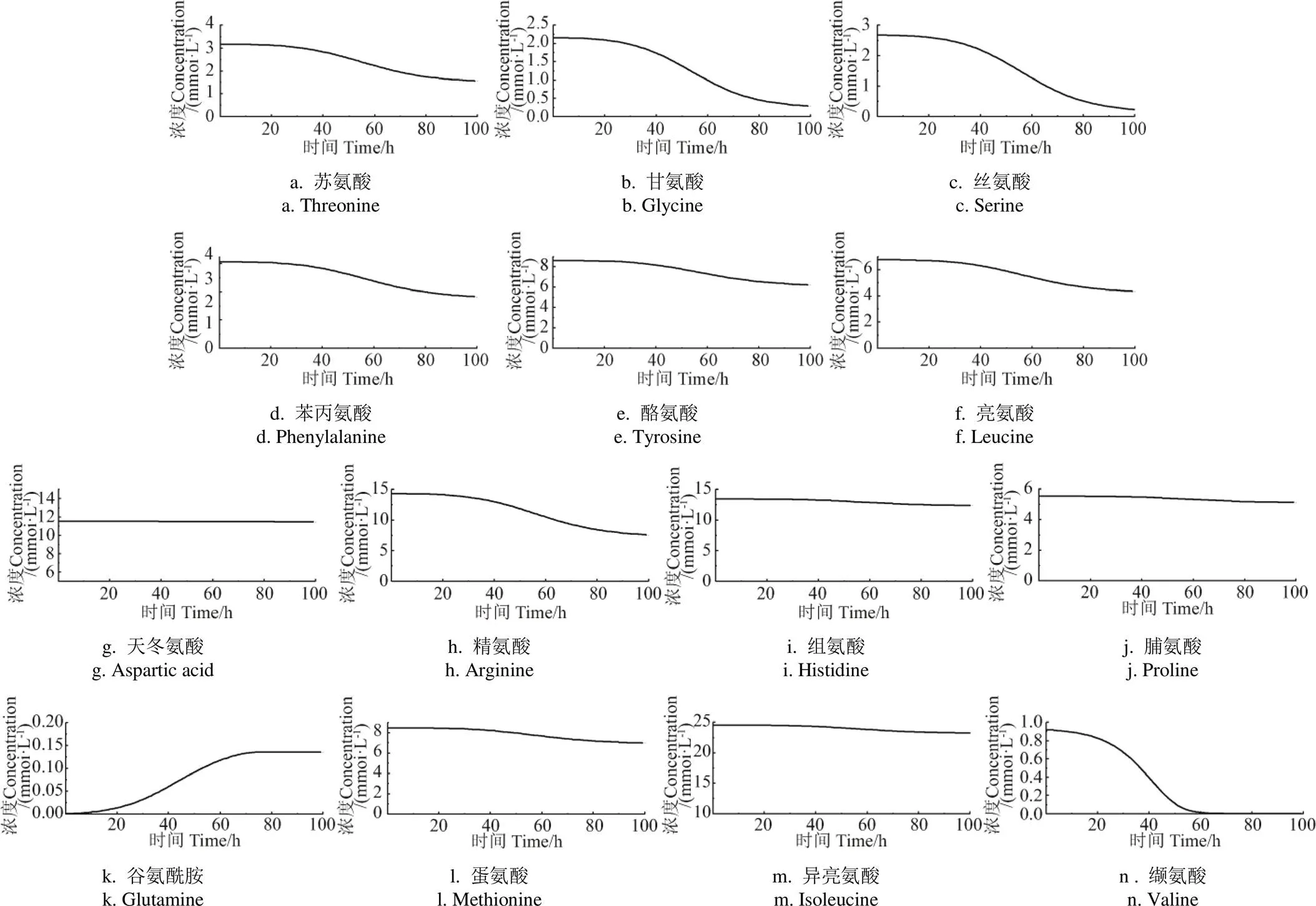
图8 基于代谢模型的玉米浆ABE发酵的氨基酸代谢模拟预测
大量研究致力于寻求低价碳水化合物和脂类原料用于生产,包括大量蛋白质类废弃物[41]。本研究致力于利用富含氨基酸的玉米浆为原料生产生物丁醇,以降低生产成本,促进蛋白质废弃物管理。玉米浆中丰富的氨基酸资源,用于丙酮丁醇梭菌发酵ABE切实可行。玉米浆中含有高水平的乳酸[42]。乳酸可以被梭状芽孢杆菌同化,进而提高丁醇产量[43-44]。乳酸添加可以提高乳酸向丙酮酸的转化率,增加了更多NADPH和ATP用于丁醇合成[45]。同时玉米浆中可溶性糖也有利于有机酸生产。Cao等[46]利用造纸厂污泥水解物和5%浓度玉米浆获得了16.5 g/L浓度的丁醇。Choi等[16]以玉米浆替代酵母膏,在添加6%浓度玉米浆发酵18 h,产生21.4 g/L浓度的ABE。很多研究利用了不同丁酸梭菌对玉米浆发酵丁醇进行了试验,均证明了玉米浆生产ABE的可行性,但并没有对玉米浆中氨基酸的利用进行深入研究。本研究通过丙酮丁醇梭菌氨基酸代谢模型的建立,能够准确模拟玉米浆中氨基酸的消耗情况,为实际生产提供了理论指导作用。
4 结 论
1)玉米浆原始菌群中梭状芽孢杆菌相对丰度达到68.76%,是玉米浆原始菌群中优势菌属。玉米浆中营养成分、渗透压等原始环境,更适合梭状芽孢杆菌等微生物定殖。
2)建立了丙酮丁醇梭菌氨基酸代谢模型,该模型能够较好地拟合试验数据并能对相关数据进行很好地预测和挖掘。11种氨基酸(苯丙氨酸、苏氨酸、异亮氨酸、亮氨酸、蛋氨酸、缬氨酸、酪氨酸、甘氨酸、丝氨酸、精氨酸、天冬酰胺)在培养过程中迅速消耗用于细胞生长和溶剂生成,3种氨基酸(脯氨酸、组氨酸、天冬氨酸)保持在稳定的状态,另外检测到谷氨酰胺在培养过程中获得积累。
3)冗余分析发现5种氨基酸(丝氨酸、天冬酰胺、甘氨酸、亮氨酸、缬氨酸)与丙酮丁醇梭菌的生物量、ABE产物、核黄素有显著相关性,相关性排序从大到小依次为丝氨酸、甘氨酸、亮氨酸、缬氨酸、天冬酰胺。其中亮氨酸对结果影响解释度为64.4%,被认为是对产物主要影响的氨基酸。
4)氨基酸动态模型模拟预测玉米浆作为氮源发酵ABE时,精氨酸消耗量最高,约7 mmol/L,缬氨酸、甘氨酸、丝氨酸基本被完全消耗,实际生产中应考虑在发酵后期补加消耗较快的氨基酸,以避免缺乏营养限制因子。该结论为丙酮丁醇梭菌的氨基酸代谢调控及下一步以玉米浆—木糖为原料利用梭菌ABE发酵生产进一步提供理论支撑和数据参考。
[1] Ndaba B, Chiyanzu I, Marx S. Direct fermentation of sweet sorghum juice by Clostridium acetobutylicum and Clostridium tetanomorphum to produce bio-butanol and organic acids[J]. Biofuel Research Journal, 2015, 2(2): 248-252.
[2] Jones D T, Woods D R. Acetone-butanol fermentation revisited[J]. Microbiological Reviews, 1986, 50(4): 484-524.
[3] 王风芹,谢媱嬛,苏增平,等. 酶法复合脱毒提高玉米秸秆水解液丁醇发酵效率[J]. 农业工程学报,2017,33(8):204-210. Wang Fengqin, Xie Yaohuan, Su Zengping, et al. Enzymatic composite detoxification improving effect of butanol fermentation from corn stover hydrolysate[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(8): 204-210. (in Chinese with English abstract)
[4] Zhang J, Zhu W, Xu H, et al. Simultaneous glucose and xylose uptake by an acetone/butanol/ethanol producing laboratory Clostridium beijerinckii strain SE-2[J]. Biotechnology Letters, 2016, 38(4): 611-617.
[5] Kumar M, Gayen K. Developments in biobutanol production: New insights[J]. Applied Energy, 2011, 88(6): 1999-2012.
[6] Hofer A, Hauer S, Kroll P, et al. In-depth characterization of the raw material corn steep liquor and its bioavailability in bioprocesses of Penicillium chrysogenum[J]. Process Biochemistry, 2018, 70: 20-28.
[7] Filipović S, Ristić M, Sakač M. Technology of corn steep application in animal mashes and their quality[J]. Roumanian Biotechnology Letters, 2001, 7(3): 705-710.
[8] Zhang J, Jia B. Enhanced butanol production using Clostridium beijerinckii SE-2 from the waste of corn processing[J]. Biomass and Bioenergy, 2018, 115: 260-266.
[9] Maddipati P, Atiyeh H K, Bellmer D D, et al. Ethanol production from syngas by Clostridium strain P11 using corn steep liquor as a nutrient replacement to yeast extract[J]. Bioresource Technology, 2011, 102(11): 6494-6501.
[10] Zhao X, Kasbi M, Chen J, et al. A dynamic metabolic flux analysis of ABE (acetone‐butanol‐ethanol) fermentation byATCC 824, with riboflavin as a by-product[J]. Biotechnology and Bioengineering, 2017, 114(12): 2907-2919.
[11] Li X, Li Z, Zheng J, et al. Yeast extract promotes phase shift of bio-butanol fermentation byATCC824 using cassava as substrate[J]. Bioresource Technology, 2012, 125: 43-51.
[12] Sun Z, Liu S. Production of n-butanol from concentrated sugar maple hemicellulosic hydrolysate byATCC824[J]. Biomass and Bioenergy, 2012, 39: 39-47.
[13] Choi S J, Lee J, Jang Y S, et al. Effects of nutritional enrichment on the production of acetone-butanol-ethanol (ABE) by[J]. Journal of Microbiology, 2012, 50(6): 1063-1066.
[14] Harris L M, Welker N E, Papoutsakis E T. Northern, morphological, and fermentation analysis of spo0A inactivation and overexpression inATCC 824[J]. Journal of Bacteriology, 2002, 184(13): 3586-3597.
[15] Zhao X, Condruz S, Chen J, et al. A quantitative metabolomics study of high sodium response inATCC 824 acetone-butanol-ethanol (ABE) fermentation[J]. Scientific Reports, 2016, 6(1): 28307.
[16] Choi J D R, Jang Y S, Cho J H, et al. Characterization and evaluation of corn steep liquid in acetone-butanol-ethanol production by[J]. Biotechnology and Bioprocess Engineering, 2013, 18(2): 266-271.
[17] Rizzi M, Baltes M, Theobald U, et al. In vivo analysis of metabolic dynamics in: II. Mathematical model[J]. Biotechnology and Bioengineering, 1997, 55(4): 592-608.
[18] Tracy B P, Jones S W, Fast A G, et al. Clostridia: The importance of their exceptional substrate and metabolite diversity for biofuel and biorefinery applications[J]. Current Opinion in Biotechnology, 2012, 23(3): 364-381.
[19] Charubin K, Bennett R K, Fast A G, et al. Engineeringorganisms as microbial cell-factories: challenges & opportunities[J]. Metabolic Engineering, 2018, 50: 173-191.
[20] Hu X, Du H, Ren C, et al. Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J]. Applied and Environmental Microbiology, 2016, 82(8): 2506-2515.
[21] Fonknechten N, Chaussonnerie S, Tricot S, et al., a specialist in amino acid degradation: Revisiting its metabolism through its genome sequence[J]. BMC Genomics, 2010, 11(1): 555.
[22] Michal G. Biochemical pathways: An atlas of biochemistry and molecular biology[J]. Journal of Chemical Education, 2012, 77(2): 163.
[23] Baer S H, Blaschek H P, Smith T L. Effect of butanol challenge and temperature on lipid composition and membrane fluidity of butanol-tolerant[J]. Applied and Environmental Microbiology, 1987, 53(12): 2854-2861.
[24] Amador-Noguez D, Brasg I A, Feng X J, et al. Metabolome remodeling during the acidogenic-solventogenic transition in[J]. Applied and Environmental Microbiology, 2011, 77(22): 7984-7997.
[25] Janssen H, Döring C, Ehrenreich A, et al. A proteomic and transcriptional view of acidogenic and solventogenic steady-state cells ofin a chemostat culture[J]. Applied Microbiology and Biotechnology, 2010, 87(6): 2209-2226.
[26] Masion E, Amine J, Marczak R. Influence of amino acid supplements on the metabolism of[J]. FEMS Microbiology Letters, 1987, 43(3): 269-274.
[27] Wu J, Dong L, Zhou C, et al. Developing a coculture for enhanced butanol production byand Saccharomyces cerevisiae[J]. Bioresource Technology Reports, 2019, 6: 223-228.
[28] Yoo M, Nguyen N P T, Soucaille P. Trends in systems biology for the analysis and engineering of clostridium acetobutylicum metabolism[J]. Trends in Microbiology, 2020, 28(2): 118-140.
[29] Liu H, Huang D, Wen J. Integrated intracellular metabolic profiling and pathway analysis approaches reveal complex metabolic regulation by[J]. Microbial Cell Factories, 2016, 15(1): 1-14.
[30] Janssen H, Grimmler C, Ehrenreich A, et al. A transcriptional study of acidogenic chemostat cells of-solvent stress caused by a transient n-butanol pulse[J]. Journal of Biotechnology, 2012, 161(3): 354-365.
[31] Croux C, Canard B, Goma G, et al. Autolysis ofATCC 824[J]. Microbiology, 1992, 138(5): 861-869.
[32] Nimbalkar P R, Khedkar M A, Kulkarni R K, et al. Strategic intensification in butanol production by exogenous amino acid supplementation: Fermentation kinetics and thermodynamic studies[J]. Bioresource Technology, 2019, 288: 121521.
[33] Sangavai C, Chellapandi P. Amino acid catabolism-directed biofuel production in Clostridium sticklandii: An insight into model-driven systems engineering[J]. Biotechnology Reports, 2017, 16: 32-43.
[34] Grassi M C B, Carazzolle M F, Nakagawa B T, et al. New contributions for industrial n-butanol fermentation: An optimized Clostridium strain and the use of xylooligosaccharides as a fermentation additive[J]. Biomass and Bioenergy, 2018, 119: 304-313.
[35] Gheshlaghi R, Scharer J M, Moo-Young M, et al. Metabolic pathways of clostridia for producing butanol[J]. Biotechnology Advances,2009, 27(6): 764-781.
[36] Daniel A N. Systems-level metabolic flux profiling elucidates a complete, bifurcated tricarboxylic acid cycle in Clostridium acetobutylicum[J]. Journal of Bacteriology, 2010, 17(192): 4452-4461.
[37] Abd Alla M H, Elsadek El-Enany A W. Production of acetone-butanol-ethanol from spoilage date palm (L) fruits by mixed culture ofand Bacillus subtilis[J]. Biomass and Bioenergy, 2012, 42: 172-178.
[38] Wang Y F, Tian J, Ji Z H, et al. Intracellular metabolic changes ofand promotion to butanol tolerance during biobutanol fermentation[J]. The International Journal of Biochemistry & Cell Biology, 2016, 78: 297-306.
[39] Luo H, Ge L, Zhang J, et al. Enhancing acetone biosynthesis and acetone–butanol–ethanol fermentation performance by co-culturing Clostridium acetobutylicum/Saccharomyces cerevisiae integrated with exogenous acetate addition[J]. Bioresource Technology, 2016, 200: 111-120.
[40] Ding J, Luo H, Xie F, et al. Electron receptor addition enhances butanol synthesis in ABE fermentation by Clostridium acetobutylicum[J]. Bioresource Technology, 2018, 247: 1201-1205.
[41] El-Dalatony M M, Saha S, Govindwar S P, et al. Biological conversion of amino acids to higher alcohols[J]. Trends in Biotechnology, 2019, 37(8): 855-869.
[42] Gao Y, Yuan Y J. Comprehensive quality evaluation of corn steep liquor in 2-Keto-l-gulonic acid fermentation[J]. Journal of Agricultural & Food Chemistry, 2011, 59(18): 9845-9853.
[43] Ahn J H, Sang B I, Um Y. Butanol production from thin stillage using Clostridium pasteurianum[J]. Bioresource Technology, 2011, 102(7): 4934-4937.
[44] Zhang J, Zong W, Hong W, et al. Exploiting endogenous CRISPR-Cas system for multiplex genome editing in Clostridium tyrobutyricum and engineer the strain for high-level butanol production[J]. Metabolic Engineering, 2018, 47: 49-59.
[45] Zhou Q, Liu Y, Yuan W. Kinetic modeling of lactic acid and acetic acid effects on butanol fermentation by Clostridium saccharoperbutylacetonicum[J]. Fuel, 2018, 226: 181-189.
[46] Cao X, Chen Z, Liang L, et al. Co-valorization of paper mill sludge and corn steep liquor for enhanced n-butanol production with Clostridium tyrobutyricum Δcat1:: adhE2[J]. Bioresource Technology, 2020, 296: 122347.
Kinetic simulation of amino acid metabolism of butanol produced from the fermentation of corn steep liquor
Zhao Xinhe1,2,3, He Zhuangzhuang1, Zhao Yubin4, Ma Chengye1, Ren Xiaojie1,2※
(1,,255000,; 2.,,255000,;3.,401123,; 4.,276400,)
This study aimsto investigate the dynamic process of amino acid metabolism in thefermentation of biobutanol. In a production strategy, a type of cheap nitrogen source, such as amino acid in the Corn Steep Liquor (CSL), can be used to produce butanol from. The efficient and cheap nitrogen source is seeking for butanol production to reduce the production cost of fermentation. In this study, a high-throughput sequencing technology was used to analyze the microbial diversity in CSL, based on the dynamic model of carbon metabolism for ABE (acetone-butanol-ethanol) produceby. A model of amino acid metabolism was constructed, using the metabolism network of amino acid, chemical reaction flux dynamics, and mass balance measurement. 15 amino acids were selected to simulate the metabolism process in ABE fermentation, using xylose as a carbon source. A redundancy analysis was conducted to establish the correlation between amino acid metabolism, the biomass of, and the synthesis of ABE. The predict model was achieved for the consumption process of amino acid in the CSL fermentation in an actual production. The results showed that theaccounted for 68.76% of the total number of bacteria, indicating the dominant bacterial group in the CSL. The prediction results showed that the gene function of original bacteria was mainly focused on the transformation of carbon and nitrogen sources in the CSL. The optimal parameter correction demonstrated that the simulated values were in good agreement with the experimental ones, indicating that the proposed model can accurately reveal the dynamic metabolic process of amino acid under the utilization by. Both experimental and simulation results indicated that 11 amino acids (phenylalanine, threonine, isoleucine, leucine, methionine, valine, tyrosine, glycine, serine, arginine, asparagine) were rapidly consumed for cell growth and solvent generation during the cultivation process, whereas 3 amino acids (proline, histamine, aspartic acid) remained stable, particularly that the glutamine accumulation was detected during fermentation. In addition, the metabolism of sugar and amino acid can be beneficial to the cell growth in the early stage, but not to the butanol synthesis. Correlation analysis results showed that five types of amino acids (serine, asparagine, glycine, leucine, and valine) were closely related to the fermentation products and biomass accumulation. The correlation sequence was serine, glycine, leucine, valine, asparagine in order from the largest to the smallest. A high consumption rate was obtained for valine, glycine, and serine during the fermentation process, indicating a nutrient limiting factor in the later stage of fermentation. A fully consumption was found in the predicted values of valine, glycine, and serine in the fermentation of CSL, indicating thatthehad the highest utilization rate of three amino acids. Therefore, amino acids can be expected to add in the late period of fermentation, to avoid the deficiency of nutrient limiting factors. The CSL can also serve as the dominant nitrogen source of butanol fermentationbyThe findings can provide a sound theoretical reference and data support for the amino acid metabolism of, and for the subsequent utilization and optimization of CSL as a promising nitrogen source to produce biobutanol.
dynamics; models;; ABE fermentation; corn steep liquor; microbiome analysis; amino acid
赵新河,贺壮壮,赵玉斌,等.玉米浆发酵产生物丁醇的氨基酸代谢动力学模拟[J]. 农业工程学报,2020,36(18):263-274.doi:10.11975/j.issn.1002-6819.2020.18.031 http://www.tcsae.org
Zhao Xinhe, He Zhuangzhuang, Zhao Yubin, et al. Kinetic simulation of amino acid metabolism of butanol produced from the fermentation of corn steep liquor[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(18): 263-274. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.18.031 http://www.tcsae.org
2020-05-28
2020-08-18
重庆市技术创新与应用发展重点项目(cstc2019jscx-gksbX0113);国家博士后基金面上项目(2019M662362);山东省自然科学基金博士项目(ZR2019BC099);山东省博士后创新项目(201902048)
赵新河,博士,讲师,主要从事发酵工程方面的研究。Email:zhaoxinhe@sdut.edu.cn
任晓洁,博士,讲师,主要从事发酵工程方面的研究。Email:renxiaojie2020@163.com
10.11975/j.issn.1002-6819.2020.18.031
TQ923
A
1002-6819(2020)-18-0263-12

