铁代谢异常在新生隐球菌脑膜炎感染中的相关研究
徐 涛,林文婷,王晓莉,陈江汉
隐球菌性脑膜炎是一类侵袭性真菌感染,致病菌主要为新生隐球菌和格特隐球菌,传播媒介多为环境中的鸽粪,防治困难,后遗症多,且患者死亡风险高[1-3]。隐球菌感染在免疫缺陷人群如艾滋病(AIDS)、器官移植患者中高发,但在临床中常可观察到无特定免疫缺陷人群的发病[4,5]。笔者前期的研究发现血清抗粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)抗体所致的免疫功能障碍可以部分解释格特隐球菌感染这类“免疫正常”人群的原因[6,7]。但新生隐球菌感染的相关机制仍不清楚。铁是隐球菌的重要营养物质,培养基中铁浓度的不同直接影响隐球菌荚膜的大小[8]。隐球菌感染后宿主会通过一系列调节机制加快细胞对铁离子的摄取,血清铁浓度显著下降而铁蛋白浓度上升,从而达到与隐球菌竞争铁的效果[9]。笔者设想铁代谢与调节障碍可能与隐球菌感染有关。本研究共采集10 例无特定免疫缺陷的隐球菌性脑膜炎患者和10 名健康志愿者的血液样本,通过血清铁、铁蛋白、转铁蛋白及可溶性转铁蛋白受体检测,探究新生隐球菌感染该人群的可能原因。
1 研究对象与方法
1.1 研究对象
回顾性筛选2016 年1 月—2018 年6 月在海军军医大学附属长征医院皮肤科住院并确诊为隐球菌性脑膜炎的患者,通过外周血免疫球蛋白、淋巴细胞检测和询问病史排除人免疫缺陷病毒(HIV)感染、恶性肿瘤、器官移植或长期使用免疫抑制药物等常见免疫缺陷因素。患者组年龄26 ~62 岁,女4 例,男6 例;对照组为健康志愿者10 名,年龄24 ~55 岁,女4 例,男6 例。纳入的研究对象均签订知情同意书,并经医院临床科学研究伦理委员会通过。
1.2 方法
1.2.1 隐球菌菌株筛选与标本采集 常规收集住院隐球菌性脑膜炎患者的脑脊液样本,通过YPD 培养基培养隐球菌,CGB 培养基进行鉴定。从中筛选出感染菌株为新生隐球菌的患者,并采集血液样本。患者治愈出院3 个月后,于复查时采集治疗后血液样本。受试者均在清晨空腹时于肘静脉处采集外周全血5 ml,置于无抗凝剂试管中静置待凝固,4 ℃条件下3 000 r/min离心15 分min,收集上清贮存在-80 ℃中待检。
1.2.2 血清铁、铁蛋白、转铁蛋白和可溶性转铁蛋白受体浓度测定 铁蛋白、转铁蛋白和可溶性转铁蛋白受体检测均采用酶联免疫吸附试验(ELISA),人ELISA 检测试剂盒购自上海西唐生物科技有限公司,具体操作按照说明书完成。使用酶标仪测定标准品和样本在450 nm 处吸光度,通过标准品绘制标准曲线计算样本中的目标蛋白含量。血清铁检测采用亚铁嗪微板法,铁检测试剂盒购自上海信裕生物科技有限公司,具体操作按照说明书完成。使用酶标仪测定标准品和样本在562 nm 处吸光度,根据标准品浓度和吸光度计算样本中铁浓度。
1.3 统计学方法
采用SPSS22.0 软件对数据进行分析,连续性变量以均数±标准差(x¯±s)描述,两组间差异比较采用t检验,多组之间差异比较采用方差分析,如方差不齐采用秩和检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组血清铁、铁蛋白、转铁蛋白和可溶性转铁蛋白受体浓度比较
患者组治疗前后铁蛋白水平分别为(1 119.70±458.11)μg/L、(212.88±137.15)μg/L, 对 照 组 为(105.71±47.51)μg/L(铁蛋白正常值:男15 ~200 μg/L,女12 ~150 μg/L),两两相比差异均有统计学意义(治疗前:治疗后P<0.001;治疗后:对照组P=0.039;治疗前:对照组P<0.001,比较顺序下文同)。治疗前后可溶性转铁蛋白受体水平分别为(91.31±66.65)nmol/L、(86.02±52.42)nmol/L,对 照 组为(34.44±10.20)nmol/L(可溶性转铁蛋白受体正常值:20.8 ~59.16 nmol/L),治疗前后与对照组相比差异均有统计学意义(P=0.025,P=0.013),但治疗前后相比差异无统计学意义(P=0.846)。治疗前后血清铁水平(19.72±11.65)μmol/L、(25.75±16.60)μmol/L,与对照组(18.97±6.39)μmol/L 两两相比差异均无统计学意义(P=0.359,P=0.252,P=0.861)(血清铁正常值:男11.6 ~31.3 μmol/L,女9 ~30.4 μmol/L)。治疗前后转铁蛋白水平(2.46±0.50)g/L、(2.32±0.48)g/L,对照组(2.73±0.38)g/L(转铁蛋白正常值:2.2 ~4.0 g/L),两两相比差异均无统计学意义(P=0.547,P=0.051,P=0.183)。
2.2 铁代谢异常患者与对照组血清铁、铁蛋白、转铁蛋白和可溶性转铁蛋白受体浓度比较
在上一步统计分析中发现,患者组治疗前血清铁水平未见降低,不符合隐球菌感染常规表现,且治疗前后可溶性转铁蛋白受体水平均较高,怀疑部分患者存在铁代谢异常。对数据进行逐个筛查后,发现异常值主要来源于4 例患者,其治疗前后血清铁、可溶性转铁蛋白受体与对照组相比有显著差异(图1),一旦排除这4 例患者,其余患者治疗前后血清铁、可溶性转铁蛋白受体与对照组无显著差异(图2)。随后查阅这4 例患者住院时临床资料发现,血常规结果均提示小细胞低色素性贫血(表1)。

图1 铁代谢异常4例患者血清各指标与对照组比较
3 讨论
铁离子在人体代谢中发挥多种重要作用,但它也是病原菌生长不可或缺的微量元素。隐球菌重要毒力因子黑色素的形成依赖于铁的摄取,而荚膜体积与环境中铁离子浓度密切相关[10,11]。因为体液中铁离子含量较低,隐球菌通过一系列转运蛋白有效摄取宿主体内铁元素。包括亚铁氧化酶Cfos(Cfo1、Cfo2)[12],细胞膜上的铁离子还原酶Fre 家族,其中Fre2 可从宿主血红蛋白和血红素内摄取铁元素[13];以及借助铁透过酶Cfts(Cft1、Cft2),研究发现Cft1 与铁离子有较高亲和力,从而可以竞争利用转铁蛋白中的铁元素,Cft1 敲除菌株利用转铁蛋白的能力与生长速度明显下降[14,15]。在宿主体内隐球菌通过转录调控转运蛋白表达水平,以及细胞器内的铁结合蛋白如Grx4 水平,维持自身铁代谢平衡,并满足自身生长需求[17,18]。
因为隐球菌对铁元素的竞争利用,机体会通过一系列调控干扰其生长发育。正常情况下转铁蛋白与铁离子结合后通过转铁蛋白受体进入红细胞内,并参与血红蛋白的形成。隐球菌感染后免疫细胞会大量吞噬红细胞,摄取其内部的铁离子,同时铁蛋白合成增多,加速铁元素从功能状态向储存状态的转换,使得血清铁水平下降而铁蛋白水平上升,减少隐球菌可利用铁的来源[19]。该研究中4 例铁代谢异常患者则存在调节障碍,其治疗前后血清铁、铁蛋白水平均较高,提示患者体内储铁量并不低但血常规却提示小细胞低色素性贫血。因此在铁代谢进程中存在部分环节的异常,可能为红细胞摄取铁异常,或由于血红素合成障碍引起的红细胞内铁利用不良。机体与隐球菌竞争铁能力的不足或导致该类患者易受其侵袭性感染的可能原因[20]:①铁在组织、血液中的大量富集为隐球菌提供了充足的铁源;②感染发生后,机体不能将铁快速转移;③贫血本身削弱了患者免疫功能;④充足的铁源有利于隐球菌荚膜体积和毒力因子上升,提升了侵袭性与致病力[21]。因此,该类患者铁代谢异常可能与隐球菌感染有潜在关联。
本研究存在一定的局限性。首先,纳入患者数量有限,本次研究仅选取新生隐球菌感染患者;其次,并非全部患者均表现出铁代谢异常,因此不能完全说明其与新生隐球菌感染相关。最后,前期标本留取仅为血液样本,实验手段有限,因此仅采用ELISA 法检测各项指标。在后续临床诊治中笔者将进一步筛查是否有更多患者存在类似铁代谢障碍,同时扩大样本含量,通过流行病学研究探寻铁代谢障碍是否为隐球菌感染的危险因素。
综上所述,本研究发现部分无特殊免疫缺陷的新生隐球菌感染患者存在铁代谢异常,高血清铁水平可能对隐球菌感染有潜在影响。未来在对类似患者诊治中,需密切关注铁代谢指标,对于相关疾病做到早诊断、早治疗,或可改善预后,减少类似机会性感染的复发。
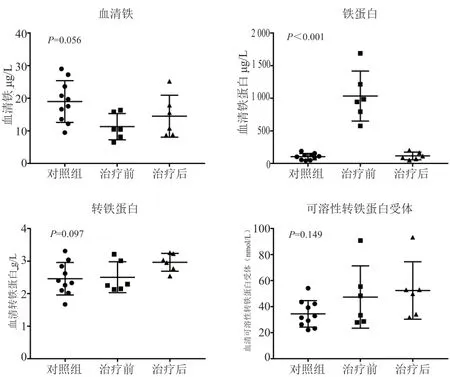
图2 其余患者血清各指标与对照组比较

表1 4例铁代谢异常患者血常规贫血相关指标

