脐带间充质干细胞对CTX导致的药物性肝损伤大鼠的治疗作用
王佳
【摘要】 目的 分析臍带间充质干细胞(UC-MSC)对环磷酰胺(CTX)导致的药物性肝损伤大鼠的治疗作用。方法 以87只健康成年SPF级雄性SD大鼠为研究对象, 根据随机数字表法分成溶剂对照组、CTX给药组、CTX联合UC-MSC治疗组, 各29只。CTX联合UC-MSC治疗组第1、4、7及10天均予以UC-MSC进行尾静脉注射, 第3天给予CTX腹腔注射;CTX给药组第3天施以CTX腹腔注射;溶剂对照组按照以上两组同样时间、同样方式给予生理盐水。对比三组体重、肝脏/体质量、血清肝功能生化指标[天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、血清总胆红素(TBIL)、血清碱性磷酸酶(ALP)]、氧化应激[超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽(GSH)、一氧化氮(NO)、丙二醛(MDA)、过氧化脂质(LPO)]损伤状况。结果 CTX给药组、CTX联合UC-MSC治疗组体重分别为(234.52±15.18)、(253.41±15.36)g低于溶剂对照组的(286.75±20.79)g, 且CTX给药组体重低于CTX联合UC-MSC治疗组;CTX给药组、CTX联合UC-MSC治疗组肝脏/体质量分别为(0.05±0.01)、(0.04±0.01)高于对照组的(0.03±0.01), 且CTX给药组高于CTX联合UC-MSC治疗组, 差异具有统计学意义(P<0.05)。CTX给药组、CTX联合UC-MSC治疗组AST、ALT、TBIL、ALP水平分别为(180.46±20.78)U/L、(102.43±23.49)U/L、(2.31±0.38)μmol/L、(167.46±20.78)U/L及(162.35±20.46)U/L、(82.67±20.16)U/L、(0.87±0.02)μmol/L、(158.15±20.57)U/L均高于溶剂对照组的(98.76±12.49)U/L、(36.85±4.57)U/L、(0.14±0.01)μmol/L、(105.82±25.13)U/L, 且CTX给药组高于CTX联合UC-MSC治疗组, 差异具有统计学意义(P<0.05)。CTX给药组、CTX联合UC-MSC治疗组SOD、GSH-Px、GSH低于溶剂对照组, 且CTX给药组低于CTX联合UC-MSC治疗组, 差异具有统计学意义 (P<0.05) ;CTX给药组、CTX联合UC-MSC治疗组NO、MDA、LPO高于溶剂对照组, 且CTX给药组高于CTX联合UC-MSC治疗组, 差异具有统计学意义(P<0.05)。结论 UC-MSC能有效减轻CTX所致的大鼠药物性肝损伤, 值得临床应用。
【关键词】 环磷酰胺;脐带间充质干细胞;药物性肝损伤
DOI:10.14163/j.cnki.11-5547/r.2020.30.002
The therapeutic effect of umbilical cord mesenchymal stem cells on CTX-induced liver injury in rats WANG Jia. Jiangsu Zhengda Fenghai Pharmaceutical Co., Ltd, Nanjing 210046, China
【Abstract】 Objective To analyze the role of umbilical cord mesenchymal stem cells (UC-MSC) on cyclophosphamide (CTX)-induced liver injury in rats. Methods A total of 87 healthy adult SPF male SD rats as study subjects were divided into solvent control group, CTX group, and CTX combined with UC-MSC group according to random numerical table, with 29 rats in each group. In CTX combined with UC-MSC group, UC-MSC was injected via caudal vein on 1st, 4th, 7th and 10th day, and CTX was intraperitoneally injected on 3rd day; CTX group was given intraperitoneal injection of CTX on 3rd day; the solvent control group was given normal saline at the same time and in the same manner. The body weight, liver/body mass, serum liver function biochemical indicators [aspartate aminotransferase (AST), alanine aminotransferase (ALT), serum total bilirubin (TBIL), serum alkaline phosphatase (ALP)], oxidative response kinase [superoxide dismutase (SOD), glutathione peroxidase (GSH-Px), glutathione (GSH), nitric oxide (NO), malondioxide aldehyde (MDA), lipid peroxide (LPO)] of the three groups were compared. Results The weight of CTX group and CTX combined with UC-MSC group were (234.52±15.18) and (253.41±15.36) g were lower than (286.75±20.79) g of the solvent control group, CTX group was lower than CTX combined with UC-MSC group; the liver/body mass of CTX group and CTX combined with UC-MSC group were (0.05±0.01) and (0.04±0.01), which were higher than (0.03±0.01) of the solvent control group, and CTX group was higher than CTX combined with UC-MSC group. The difference was statistically significant (P<0.05). The levels of AST, ALT, TBIL and ALP of CTX group and CTX combined with UC-MSC group were (180.46±20.78) U/L, (102.43±23.49) U/L, (2.31±0.38) μmol/L, (167.46±20.78) U/L and (162.35±20.46) U/L, (82.67±20.16) U/L, (0.87±0.02) μmol/L, (158.15±20.57) U/L, which were higher than (98.76±12.49) U/L, (36.85±4.57) U/L, (0.14±0.01) μmol/L, (105.82±25.13) U/L of solvent control group, and CTX group was higher than CTX combined with UC-MSC group, and the difference was statistically significant (P<0.05). SOD, GSH-Px and GSH of CTX group and CTX combined with UC-MSC group were lower than those of solvent control group, and CTX group was lower than CTX combined with UC-MSC group, and the difference was statistically significant (P<0.05). NO, MDA, LPO of CTX group and CTX combined with UC-MSC group were higher than those of solvent control group, and CTX group was higher than CTX combined with UC-MSC group, and the difference was statistically significant (P<0.05). Conclusion UC-MSC can effectively reduce the drug-induced liver injury in rats caused by CTX and is worthy of clinical application.
【Key words】 Cyclophosphamide; Umbilical cord mesenchymal stem cells; Drug-induced liver injury
CTX属于广谱抗肿瘤药物, 在多种恶性肿瘤中均可发挥良好作用[1]。但在CTX使用过程中, 可出现一系列不良反应, 特别是肝毒性, 造成其应用范围受到一定影响[2]。CTX代谢在肝脏内进行, 通过肝脏微粒体混合功能氧化酶系的作用, 分解为4-羧基环磷酸胺, 在31-51-核酸内切酶作用下转化为丙烯醛与磷酰胺氮芥, 前者为引发不良反应的重要成分, 后者则为抗肿瘤活性成分[3]。丙烯醛属活动性不饱和醛, 能诱发脂质过氧化反应, 造成细胞损伤。现阶段, 临床上主要利用保肝药治疗CTX所致药物性肝损伤, 该种疗法虽能在一定程度上缓解患者肝功能损伤, 但不可改善其预后[4]。现有研究表示[5-7], UC-MSC在失代偿期与终末期肝硬化、酒精性肝损伤治疗中均可发挥积极作用。鉴于此, 为明确在CTX所致药物性肝损伤治疗中UC-MSC的作用, 现对87只健康成年SPF级雄性SD大鼠展开研讨, 具体报告如下。
1 材料与方法
1. 1 材料 CTX(通化茂祥制药有限公司)、苏木染色液(厦门迈威生物科技有限公司)、戊巴比妥钠(山西云鹏制药有限公司)、柠檬酸缓冲液(北京百奥莱博科技有限公司)、反转录试剂盒(上海康朗生物科技有限公司)、谷胱甘肽过氧化物(海恒远生物科技有限公司)、TRIZOL试剂(北京华夏远洋生物科技中心)、总超氧物歧化酶(深圳思美泉生物医药要有限公司)、一氧化氮(常州凌肯自动化科技有限公司)、脂质过氧化物(上海亨代劳商贸有限公司)、丙二醇(山东富商化工有限公司)。87只健康成年SPF级雄性SD大鼠(上海斯莱克实验动物有限责任公司), 按照随机数字表法分为溶剂对照组、CTX给药组、CTX联合UC-MSC治疗组, 各29只。
1. 2 方法
1. 2. 1 分组处理 在SPF级条件下饲养SD大鼠, 合理调整湿度、温度, 予以充足食物与水。待大鼠熟悉环境1周后开展实验。以下实验流程均重复3次:CTX联合UC-MSC治疗组大鼠首次注射UC-MSC作为实验第1天, 在第1、4、7及10天分别予以0.4 ml浓度为5×106/ml的UC-MSC实施尾静脉注射, 第3天给予200 mg/kg CTX进行腹腔注射;CTX组第3天给予CTX, 方法与CTX联合UC-MSC治疗组一致;溶剂对照组和以上两组相同时间、相同方式进行生理盐水注射。实验期间, 密切观察大鼠毛色、饮食、体重变化等, 分别于第4、7、10及13天从以上三组中选取7只大鼠, 腹腔注射40 mg/kg戊巴比妥钠, 收集心脏血, 将肝脏取出, 测量其湿重, 计算器官与体重之比, 将部分肝脏组织浸泡于4%多聚甲醛内实施固定, 其余组织用液氮速冻后放于-80℃条件下备用。
1. 2. 2 UC-MSC分离-培养-鉴定 在无菌条件下提取脐血, 以密度梯度法分离获取单个核细胞, 按照5×106/cm2在T25培养瓶中实施接种, 每瓶内加入
10 ml含有10% 血清(FBS)的DMEM/F12培养基液, 并于5%CO2、37℃饱和湿度培养箱内培养。5 d后进行换液, 后期每隔3 d换液1次。当细胞融合>80%时, 以0.05%胰酶消化并进行传代。选择第3代细胞, 用小鼠单克隆抗体CD105-FITC、CD34-PE标记细胞, 并用流式细胞仪实施检测。
1. 2. 3 CTX损伤判断及UC-MSC治疗效果验证 ①氧化应激损伤相关指标测定:于预冷生理盐水内漂洗肝脏组织, 以滤纸擦拭, 取0.1 g放于EP管内, 加入0.9 ml
生理盐水, 以超声波破碎细胞法将其制成10%组织匀浆, 频率控制为10 s/次, 间隔时间控制为10 s, 反复
5次。离心后, 提取上层清液, 根据试剂盒说明书采用硝酸还原酶法、分光光度法测定浆液内GSH、SOD、GSH-Px、LPO含量。②外周血肝脏生化指标检测:将心脏血以3500 r/min的速度离心20 min, 收集上层清液, 以全自动生化分析仪测定TBIL、ALP、AST、ALT。
1. 3 观察指标 对比三组体重、肝脏/体质量、血清肝功能生化指标(AST、ALT、TBIL、ALP)、氧化应激(SOD、GSH-Px、GSH、NO、MDA、LPO)损伤状况。
1. 4 统计学方法 以Graphpad Prism 6作为数据制图工具, 采用SPSS24.0统计学软件进行统计分析。计量資料以均数±标准差( x-±s)表示, 采用F检验。P<0.05表示差异具有统计学意义。
2 结果
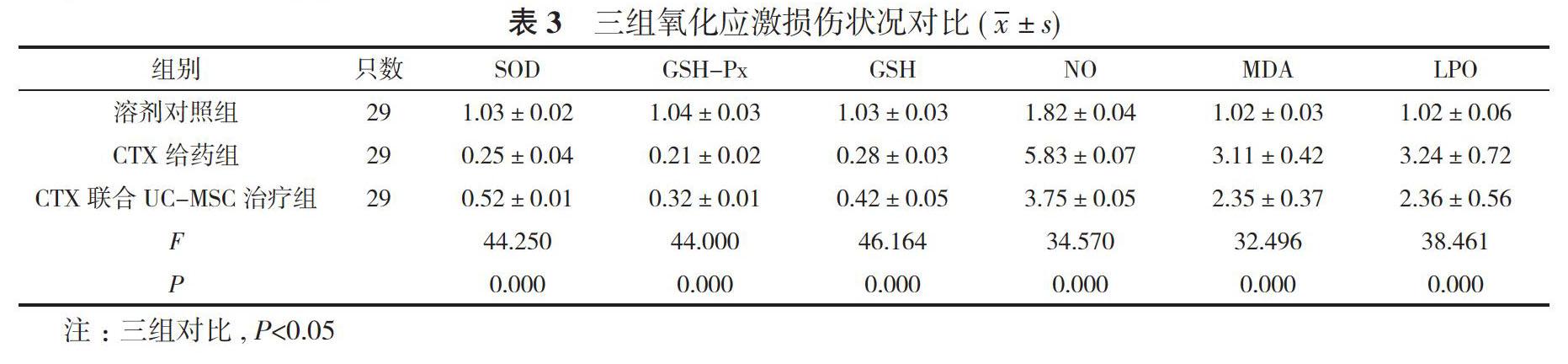
2. 1 三组体重、肝脏/体质量对比 CTX给药组、CTX联合UC-MSC治疗组体重分别为(234.52±15.18)、(253.41±15.36)g低于溶剂对照组的(286.75±20.79)g,
且CTX给药组体重低于CTX联合UC-MSC治疗组;CTX给药组、CTX联合UC-MSC治疗组肝脏/体质量分别为(0.05±0.01)、(0.04±0.01)高于对照组的(0.03±
0.01), 且CTX给药组高于CTX联合UC-MSC治疗组, 差异具有统计学意义(P<0.05)。见表1。
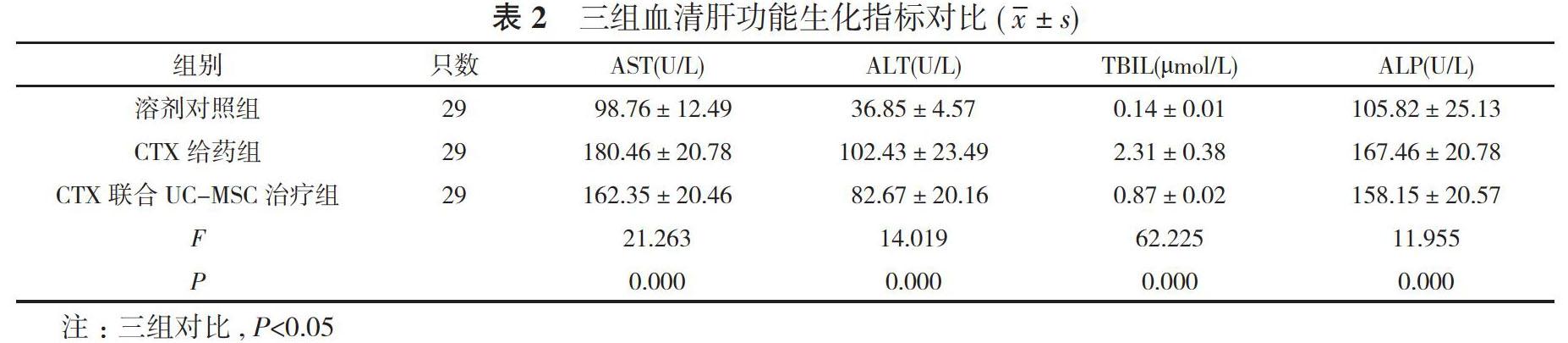
2. 2 三组血清肝功能生化指标对比 CTX给药组、CTX联合UC-MSC治疗组AST、ALT、TBIL、ALP水平分别为(180.46±20.78)U/L、(102.43±23.49)U/L、(2.31±0.38)μmol/L、(167.46±20.78)U/L及(162.35±20.46)U/L、(82.67±20.16)U/L、(0.87±0.02)μmol/L、(158.15±20.57)U/L均高于溶剂对照组的(98.76±12.49)U/L、(36.85±4.57)U/L、(0.14±0.01)μmol/L、(105.82±
25.13)U/L, 且CTX给药组高于CTX联合UC-MSC治疗组, 差异具有统计学意义(P<0.05)。见表2。
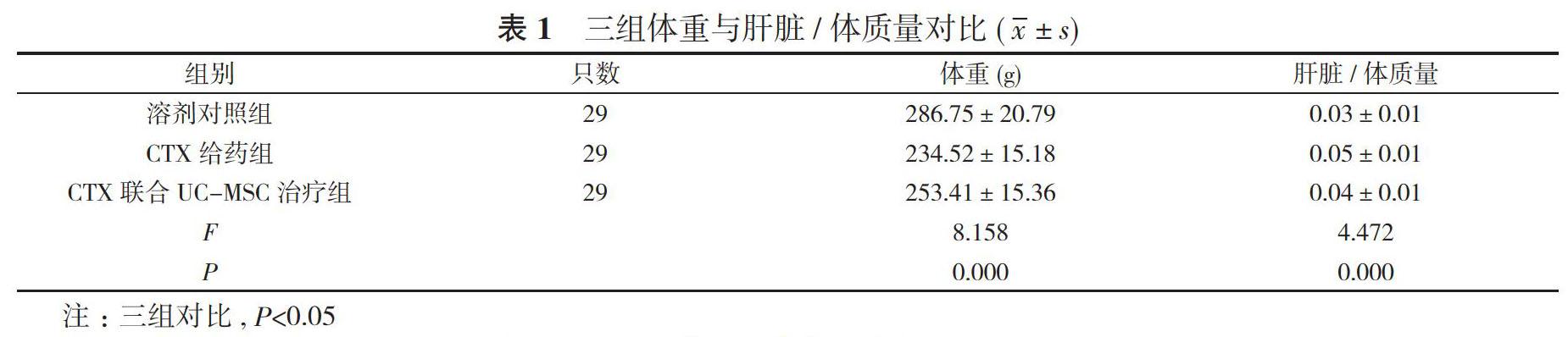
2. 3 三组氧化应激酶损伤状况对比 CTX给药组、CTX联合UC-MSC治疗组SOD、GSH-Px、GSH低于溶剂对照组, 且CTX给药组低于CTX联合UC-MSC治疗组, 差异具有统计学意义 (P<0.05) ;CTX给药组、CTX联合UC-MSC治疗组NO、MDA、LPO高于溶剂对照组, 且CTX给药组高于CTX联合UC-MSC治疗组, 差异具有统计学意义(P<0.05)。见表3。
3 讨论
间充质干细胞(MSC)在体外与体内环境中均具有分泌充足营养因子的能力, 包括肝细胞生长因子(HGF)、表皮生长因子、碱性成纤细胞生长因子、血管内皮生长因子(VEGF)等[8]。当外源性UC-MSC注入动物体内时, 可诱发损伤部位VEGF水平的增加, 其作用机理可能为MSC通过促使肝脏微环境的改变, 来协助局部肝脏前体细胞分化、增殖, 从而改善损伤组织灌注与微循环, 为损伤组织提供充足营养物质, 避免实质细胞凋亡;而良好的血供可帮助周边内皮细胞增殖, 促进营养因子分泌, 提高损伤组织修复速度[9]。体外研究显示[10], MSC能下调白介素-6、肿瘤坏死因子、白介素-1β等促炎因子的表达, 分泌白介素-10、白介素-12等抑炎因子, 组建免疫耐受环境, 促使淋巴细胞凋亡。所以, 当MCS进入损伤组织后, 通过营养因子的分泌, 能有效改善微环境, 协助组织再生, 减轻炎症反应, 防控实质细胞凋亡与组织纤维化, 促使心血管产生。诸多研究均证实[11, 12], MSC能有效减轻多种原因所致的肝损伤。
综合现有研究结论, 可将MSC移植干预受损肝脏的途径归纳为以下几点:①防控肝脏纤维化:阻止HSC增殖, 引导细胞外基质降解, 促使HSC凋亡。
②协助内源性细胞增殖及分化:协助肝细胞分化、增殖, 防控肝细胞凋亡, 改善内源性异常状况。③免疫调节:激活T细胞, 阻碍抗原提呈细胞增殖, 减少刺激T调节细胞、淋巴细胞的增殖。④转变为实质细胞:MSC于体外可转变为肝实质细胞, 且具有肝细胞的储备、合成、代谢功能。经以上途径作用下, 可有效缓解小鼠肝功能损伤, 促进其肝功能的修复。在本研究中, CTX给药组体重、肝脏/体质量、血清肝功能指标、氧化应激酶损伤均出现显著变化, 而CTX联合UC-MSC治疗组也出现同样变化, 但相较于CTX给药组, CTX联合UC-MSC治疗组变化幅度较低, 这说明UC-MSC能有效改善CTX造成的小鼠肝功能损伤状况。
综上所述, 在CTX所致药物性肝功能损伤治疗中, UC-MSC可发挥良好作用, 值得临床实践及应用。
参考文献
[1] 郭成永, 杨吉鹏, 梁朝辉, 等. 重组人肿瘤坏死因子-α联合环磷酰胺对胶质瘤的作用. 中国临床药理学杂志, 2019, 35(12):1266-1268.
[2] 张颖佩, 吴东方. 表柔比星、环磷酰胺和长春地辛联合化疗引起严重心脏和血液毒性反应致死亡. 药物不良反应杂志, 2019, 21(6):459-460.
[3] 赵方, 章丽娜, 王钰莹. 环磷酰胺治疗难治性皮肌炎致急性肝损伤1例及文献复习. 临床药物治疗杂志, 2019, 23(8):23-25.
[4] 王超, 郭立杰, 张海丛, 等. 初治结核病患者预防使用保肝药物对药物性肝损伤的价值研究. 临床误诊误治, 2019, 32(9):241-243.
[5] 高琳琳, 王静敏, 张艳鹤, 等. 脐带、脂肪源性间充质干细胞改善肝硬化大鼠的效果比较. 胃肠病学和肝病学杂志, 2018, 26(7):125-127.
[6] 苏倩, 尹华发, 李家斌. 脐带间充质干细胞治疗终末期肝病的研究进展. 国际流行病学传染病学杂志, 2018, 45(3):204-207.
[7] 刘凤永, 王茂强. 间充质干细胞:细胞替代治疗肝硬化. 中华肝胆外科杂志, 2019, 25(4):308-311.
[8] 金丽娟, 汪玉海. 携带Ad-HGF的脐血间充质干细胞对烧伤后大鼠体内炎症因子的影响. 宁夏医科大学学报, 2019, 18(7):654-657.
[9] 李典, 何大维, 唐波, 等. 人脐带间充质干细胞外泌体抑制草酸及草酸钙诱导的HK-2细胞上皮间质转化. 中国细胞生物学学报, 2018, 20(6):158-159.
[10] 刘欢, 刘世宇, 邱新毓, 等. 肿瘤坏死因子α对喉黏膜间充质干细胞免疫调节能力的影响. 中华耳鼻咽喉头颈外科杂志, 2019, 54(3):203-208.
[11] 平键, 陈红云, 周扬, 等. 骨髓间充质干细胞移植对四氯化碳大鼠肝损伤的影响及一贯煎的干预作用. 中国中药杂志, 2018, 26(19):3905-3912.
[12] 高磊, 曹蕾, 王瑞芳, 等. 人臍带间充质干细胞移植对酒精性肝损伤大鼠的保护作用. 实用肝脏病杂志, 2019, 18(6):234-235.
[收稿日期:2020-05-13]

