苗药“杆努尽烟”对慢性支气管炎大鼠TLR4-MyD88-NF-κB信号通路的影响*
吴宁, 黄雨霄, 石雪, 陈晋伦, 彭凌峰, 杨露露, 徐红, 孙见飞, 刘华
(贵州医科大学 基础医学院 基础医学实验教学中心, 贵州 贵阳 550025)
慢性支气管炎(chronic bronchitis,CB)是一种临床常见的呼吸系统疾病,主要临床表现为咳嗽、咳痰或伴有喘息,常并发阻塞性肺气肿[1]。CB病程晚期,可进展为肺动脉高压、肺源性心脏病[1-2]。临床常采用西药对CB进行治疗,且具有起效快、疗效明显等优势,但CB病程长且容易复发,因需长期服药,患者的依从性较差,而传统中草药具有多成分、多靶点、多途径及副作用小等特点,在CB的治疗方面具有一定的潜力[3-4]。贵州凯里苗族地区常采用特色药方“杆努尽烟”对支气管炎进行治疗,疗效显著[5-6];但因其作用机制尚不明确,从而阻碍了该药的研发,该药一直处于经验用药阶段。根据课题组前期研究结果[7],本研究采用低(2 g/kg)、高(8 g/kg)两个剂量的“杆努尽烟”对CB模型大鼠进行治疗,并于用药的第28天时观察大鼠肺组织的病理变化、肿瘤坏死因子-α(TNF-α)含量及Toll样受体4(Toll-like receptor 4,TLR4)-髓样分化因子88(myeloid differentiation factor 88,MyD88)-核因子-κB(nuclear factor-κB,NF-κB)信号通路中TLR4、MyD88、NF-κB p65 mRNA及蛋白表达水平,探究苗药“杆努尽烟”对CB大鼠模型的疗效及其可能机制,为该药的开发利用提供一定的理论基础。
1 材料与方法
1.1 材料
1.1.1实验动物 30只清洁(specific pathogen free,SPF)级、7~8周龄SD(sprague dawley,SD)大鼠,雌、雄各半;体质量(200±20)g,由重庆腾鑫公司提供[SYXF(黔)2018-0001]。
1.1.2药物 苗药“杆努尽烟”全草采摘于凯里市炉山镇,经贵州省中医药大学潘炉台教授鉴定属吊石苣苔属植物吊石苣苔(LysionotuspauciflorusMaxim.);桂龙咳喘宁胶囊购自桂龙药业有限责任公司。
1.1.3主要试剂 脂多糖(美国Sigma),TNF-α酶联免疫试剂盒(南京诺唯赞生物科技有限公司,批号A38281155),TLR4兔抗大鼠一抗(美国Abcam公司),MyD88兔抗大鼠一抗(美国CST公司),NF-κB p65兔抗大鼠一抗(中国武汉Abclonal公司),辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔,免疫球蛋白G(immunoglobulin G,IgG)二抗(中国武汉Abclonal公司,批号AS014),内参蛋白β-actin兔抗大鼠一抗(中国武汉Abclonal公司),实时荧光定量PCR(real-time fluorescence quantitative polymerase chain reaction,Real-time PCR)反应试剂盒(南京诺唯赞生物科技有限公司),TLR4 mRNA、MyD88 mRNA、NF-κBp65 mRNA及内参照甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GADPH)引物(武汉天一辉远公司),贵烟黄果树蓝佳品(贵阳卷烟厂)。
1.1.4主要仪器 4 ℃高速低温离心机(美国Thermo公司),RM2015型石蜡切片机(德国Leica公司),BX51T-PHD-J11 型显微镜(日本Olympus公司),Synergy H1全功能酶标仪(美国 Bio Tek公司),上海嘉腾凝胶成像系统(上海嘉腾科技有限公司),ABI StepOnePlusTMReal-time PCR(美国Thermo)。
1.2 方法
1.2.1苗药“杆努尽烟”水提液的制备 取2 000 g“杆努尽烟”全草,浸泡于蒸馏水中1 h,电热恒温水浴箱90 ℃ 连续浸提全草12 h,收集、过滤、旋蒸水提液,浓缩至2.5 kg/L。最后高压蒸汽灭菌分装,4 ℃贮存。
1.2.2大鼠分组及CB模型建立 制备大鼠吸烟室(0.55 m×0.45 m×0.35 m,上壁留有通气孔)。30只大鼠在无烟环境中喂养7 d,随机分为CB模型组、正常对照组、阳性药物组、低剂量“杆努尽烟”组及高剂量“杆努尽烟”组,每组6只。正常对照组进行无烟处理;其余4组大鼠进行烟熏处理,30 min/次、2次/d,其中造模的第1天和第14天不做烟熏处理,采用8%水合氯醛(3 mL/kg)行腹腔注射,然后将200 g/L脂多糖(lipopolysaccharide,LPS)溶液200 μ L注射入气管内,建立CB大鼠模型,共计28 d[8-9];造模结束后,5组大鼠进行灌胃给药处理,低剂量“杆努尽烟”组、高剂量“杆努尽烟”组分别按2 g/kg、8 g/kg灌胃,阳性组为1 g/kg桂龙咳喘宁灌胃,正常对照组和CB模型组,用等量生理盐水(normal saline,NS)进行灌胃,1次/d,持续给药28 d[7,10]。
1.2.3呼吸系统症状观察及肺组织的收集 造模成功及灌胃给药第28 天时,比较5组大鼠大鼠呼吸系统症状。于灌胃给药处理第28 天时,麻醉状态下心脏取血法处死大鼠,取出大鼠肺组织,部分制作HE切片、部分直接使用,下余部分用RNA保存液处理后保存于-80 ℃冰箱、用于后续指标的检测。
1.2.4大鼠肺切片组织学变化 取新鲜肺组织,用0.9%NaCl溶液冲洗,用4%甲醛固定左肺上叶,制作切片并苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色,光镜下观察肺组织改变。
1.2.5肺组织中TNF-α含量 采用酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)检测,取50 mg新鲜肺组织,快速剪碎,加入PBS,充分研磨,在5 000 r/min,4 ℃的条件下,离心10 min,取上清液,按照ELISA试剂盒说明书检测TNF-α表达水平。
1.2.6肺组织TLR4、MyD88及NF-κBp65 mRNA表达 采用Real-time PCR法检测,Trizol法提取总RNA,取1 μg RNA进行逆转录反应,合成cDNA。TLR4、MyD88、NF-κBp65及内参照GADPH引物序列见表1。按Real-time PCR步骤:95 ℃ 5 min,95 ℃ 10 s、60 ℃ 30 s,共40个循环。反应完成后,读取各样本扩增循环数(cycle Threshold,Ct)值,用相对定量法计算各指标mRNA的相对表达水平。

表1 PCR引物序列Tab.1 Primer sequence of PCR
1.2.7TLR4、MyD88及NF-κB p65蛋白表达 采用蛋白免疫印迹法(Western blot)法测定,取新鲜肺组织60 mg,置于研钵中,快速剪碎,加裂解液600 μL充分研磨,总蛋白浓度用聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)法测定。取总蛋白40 μg,置于95 ℃恒温水浴箱8 min,随后上样。经SDS-PAGE电泳、转膜后,用5%(tris buffered saline tween,TBST)脱脂奶粉封闭1 h,加入兔抗大鼠一抗,4 ℃孵育过夜。洗涤聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜3次,5 min/次,加HRP标记的山羊抗兔IgG二抗,孵育120 min。用电化学发光(electrochemiluminescence,ECL)混合液显色、凝胶成像系统进行数据分析。
1.3 统计学分析
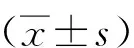
2 结果
2.1 呼吸系统症状
造模成功后,正常对照组大鼠饮食饮水活动正常,无明显咳嗽、喘息等症状;与正常对照组比较,其余4组大鼠体质量减轻,并伴有咳嗽、喘息等症状;灌胃给药第28天时,与CB模型组大鼠比较,阳性药物组、低剂量“杆努尽烟”组及高剂量“杆努尽烟”组大鼠的呼吸系统症状均有改善,其中高剂量组大鼠效果最为明显。
2.2 大鼠肺组织学改变
灌胃给药第28 天时,正常对照组肺泡壁、细支气管上皮细胞结构完整,无炎症损伤;CB模型组可见肺泡壁缺损,细支气管上皮排列紊乱,炎性细胞明显聚集,管壁上皮坏死、脱落,提示造模成功;与CB模型组比较,阳性药物组、低剂量“杆努尽烟”组、高剂量“杆努尽烟”组肺泡壁及细支气管损伤程度明显减轻,炎性细胞明显减少,上皮排列较完整,但管腔内仍可见明显炎症损伤及少量脱落物。见图1。
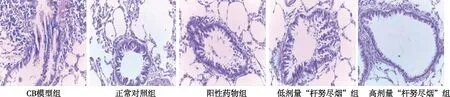
图1 各组大鼠肺组织形态学(HE,×400)Fig.1 Effect of L. pauciflorus Maxim. on histopathological morphology of rat lung tissue(HE,×400)
2.3 大鼠肺组织中TNF-α表达
灌胃给药第28 天时,与正常对照组比较,其余4组大鼠肺组织中TNF-α含量均有增加(P<0.05);与CB模型组比较,各给药组经药物干预后,肺组织TNF-α含量均有不同程度的减少(P<0.05),其中高剂量“杆努尽烟”组减少大于低剂量“杆努尽烟”组,但差异无统计学意义(P>0.05)。见图2。

注:(1)与正常对照组比较,P<0.05;(2)与CB模型组比较,P<0.05。图2 各组大鼠肺组织中TNF-α表达Fig.2 Expression of TNF-α in lung of rats
2.4 大鼠肺组织中TLR4、MyD88及NF-κB p65 mRNA的表达
灌胃给药第28 天时,与正常对照组比较,其余4组大鼠肺组织中TLR4、MyD88及NF-κBp65 mRNA表达水平增加(P<0.05),其中CB模型组增加最明显;与CB模型组比较,各给药组大鼠经药物干预后,肺组织中TLR4、MyD88、NF-κBp65 mRNA表达均有不同程度的降低(P<0.05),其中高剂量“杆努尽烟”组降低最明显。见图3。

注:(1)与正常对照组比较,P<0.05;(2)与CB模型组比较,P<0.05。图3 各组大鼠肺组织中TLR4、MyD88及NF-κB p65 mRNA表达Fig.3 Expression of TLR4,MyD88,and NF-κB p65 mRNA in lung tissue of rats
2.5 大鼠肺组织中TLR4、MyD88及NF-κB p65蛋白表达
灌胃给药第28 天时,与正常对照组比较,其余4组大鼠肺组织中TLR4、MyD88及NF-κB p65 表达水平增加(P<0.05),其中以CB模型组最为明显;与CB模型组比较,各给药组大鼠经药物干预后,肺组织中TLR4、MyD88及NF-κB p65蛋白表达水平均有不同程度的降低(P<0.05),其中高剂量“杆努尽烟”组降低最明显。见图4。

注:(1)与正常对照组比较,P<0.05;(2)与CB模型组比较,P<0.05。图4 各组大鼠肺组织中TLR4、MyD88及NF-κB p65 蛋白表达Fig.4 Expression of TLR4,MyD88,and NF-κB p65 protein in lung tissue of rats
3 讨论
CB是指发生于气管、支气管黏膜及其周围组织的慢性非特异性炎症,每年发病持续3个月或更长,有的可连续2年。CB的病因和发病机制尚不完全清楚,吸烟、革兰阴性菌感染是最重要的环境发病因素,空气污染、职业粉尘与慢性气道炎症的发生发展也有着密切的联系[11-14]。资料表明,CB镜下特点主要表现为支气管上皮细胞变性、坏死、脱落,各级气管周围组织可见大量炎性细胞浸润。随着炎症损伤进一步加重,可引起肺泡腔扩大及肺泡弹性纤维断裂[15-16]。
苦苣苔科植物吊石苣苔,苗族名为“杆努尽烟”,主要成分中包含黄酮类物质,该成分在抗炎、抗感染方面有一定的疗效[17-18]。本研究结果显示,灌胃给药第28天时,经“杆努尽烟”干预的CB模型大鼠,其体质量、饮水饮食得到改善;咳嗽、喘息减轻;镜下可见大鼠肺泡壁及细支气管的炎症损伤明显减轻。据此推测“杆努尽烟”对CB有较强的抗炎作用,从而缓解CB的临床症状。
多项研究显示,TLR4-MyD88-NF-κB信号通路是慢性支气管炎发病的重要机制之一[19-20]。TLR4是一种重要的免疫识别受体,连接天然免疫和获得性免疫,在启动和调节气道炎症过程中发挥重要作用[21]。香烟烟雾和LPS可以激活TLR4,激活的TLR4会将信号向细胞内传导,从而使MyD88被特异性激活,将信号进一步传到至NF-κB,NF-κB进入到细胞核内与特定的靶基因结合,促进TNF-α等炎症介质大量释放[22-23],最终导致肺泡、细支气管等结构受到炎症破坏[24-25]。灌胃给药第28天时,本研究检测了各组大鼠肺组织中TNF-α的含量及TLR4、MyD88、NF-κB p65 mRNA及蛋白表达水平,结果表明,经“杆努尽烟”干预的大鼠上述因子表达水平均明显下调。据此推测“杆努尽烟”可能是通过下调TLR4的表达水平进而抑制MyD88和NF-κB的磷酸化,减少下游炎症因子TNF-α等的释放,从而减轻大鼠肺部炎症损伤。
综上所述,炎症反应是CB发生发展的核心机制,贵州苗药“杆努尽烟”可通过其较强的抗炎作用,减轻CB的炎症损伤,进而缓解其临床症状,而 TLR4/MyD88/NF-κB通路可能是其发挥抗炎作用的、潜在的重要靶点之一,这为今后深入探究”杆努尽烟”治疗CB的作用机制提供科学依据。

