乐伐替尼与瑞格菲尼对肝癌细胞PD-L1的作用及机制*
许静, 喻超, 杨盛力, 孙诚谊
(贵州医科大学附属医院 肝胆外科, 贵州 贵阳 550004; 贵州医科大学 肝胆胰脾重点实验室, 贵州 贵阳 550004; 贵州省肝胆胰脾疾病研究所, 贵州 贵阳 550004)
过去十年来,肝癌(hepatocellular carcinoma,HCC)成为全球癌症死亡的第三大主要原因,其主要是由乙型肝炎病毒或丙型肝炎病毒的慢性感染、酗酒及代谢综合征(糖尿病和肥胖症)引起的[1-2]。发达国家疾病检测方案中,约40%~50%的早期肝细胞癌患者可进行潜在的治疗[3],中期肝癌的患者可以接受局部治疗,而晚期肝癌的患者可以从全身治疗中受益[4],大约50%的肝癌患者会接受全身治疗[5-6]。目前,分子靶向治疗在肝癌治疗中起着至关重要的作用[7]。瑞格菲尼是口服的血管生成性血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)及基质受体酪氨酸激酶的抑制剂[8],基于3期随机双盲对照试验的结果,该药已被批准用作治疗肝癌的二线药物[9-10]。乐伐替尼是一种口服的多靶点酪氨酸激酶抑制剂,可选择性抑制血管生成性血管内皮生长因子、成纤维细胞生长因子受体及血小板衍生的生长因子受体[11-13]。临床前期研究表明,乐伐替尼能有效阻断血管内皮生长因子和成纤维细胞生长因子驱动的血管生成,阻断VEGFR相关的淋巴管生成[14],已被用于治疗进行性、局部复发性及放射性碘难治性甲状腺癌[14];乐伐替尼联合依维莫司以血管内皮生长因子为靶点,用于治疗转移性肾细胞癌[15]。最近,在乐伐替尼的肝癌3期临床试验中,乐伐替尼通过统计证实治疗效果不亚于索拉菲尼,并证明了对总体生存率有明显的影响[14],且该药在肝癌疾病的缓解率,无复发生存期方面取得了重大的临床效果[16]。研究发现肿瘤细胞免疫检查点蛋白通常表达上调,从而通过抑制T细胞攻击来逃避宿主免疫系统的杀伤[17];肿瘤细胞中的程序性死亡-配体1(programmed cell death -ligand1,PD-L1)与在T细、B细胞、树突状细胞和自然杀伤性T细胞上表达的程序性死亡1(programmed cell death protein 1,PD-1)结合,可以抑制抗癌免疫力[18-19]。因此,抗PD-L1和抗PD-1抗体已用于治疗癌症,但对分子靶向药对PD-L1表达的调控及分子机制尚不清楚,本研究探讨分子靶向药物瑞格菲尼与乐伐替尼调控PD-L1的作用及分子机制,现将结果汇报如下。
1 材料与方法
1.1 材料
1.1.1细胞与实验动物 人肝癌Hep3B和SMMC-7721细胞购自中国典型培养物保藏中心(武汉);4周龄雌性裸鼠(BALB/c)小鼠30只,体质量(16±5)g,购自华中科技大学同济医学院实验动物中心。
1.1.2药物、主要试剂与仪器 乐伐替尼粉剂(批号S1164,2 mg/支)和瑞格菲尼粉剂(批号S1178,5 mg/支)购自美国Selleck公司,缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF1α)、髓细胞增生原癌基因(myelocytomatosis oncogene,MYC)、缺氧诱导因子-2α(hypoxia inducible factor-2α,HIF2α),信号传导与转录激活因子3(signal transducer and activator of transcription3,STAT3)、黏蛋白1-C(mucin 1-C,MUC1-C)、细胞周期素依赖蛋白激酶5(cyclin-dependent kinase 5,CDK5)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK14)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)及转化生长因子-β1(transforming growth factor-β1,TGF-β1)引物购自武汉谷歌生物科技有限公司,二甲亚砜(dimethyl sulfoxide, DMSO)购自美国MP Biomedical公司,胎牛血清、DMEM细胞培养基、青霉素-链霉素双抗、Lipofectamine 3000、Opti-MEM培养基、siRNA转染试剂盒及提取RNA所用的Trizol均购自美国Invitrogen公司,TGF-β1的空载质粒、干扰质粒和Western blot试剂盒购自武汉谷歌生物科技有限公司,TGF-β1、PD-L1和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体购自武汉三鹰生物技术有限公司,CO2恒温培养箱购自美国Cellstar公司。
1.2 方法
1.2.1TGF-β1干扰RNA的转染 无酶水稀释TGF-β1干扰RNA干粉后,调节浓度至20 mmol/L。取长满50%~60%培养瓶的肝癌Hep3B和SMMC-7721细胞进行转染,2种细胞各分为对照组和干扰组。2种细胞的干扰组进行转染时,取2支1.5 mL EP管,再分别取si-TGF-β1 5 μL、Opti-MEM 125 μL、lipofectamine3000 5 μL及Opti-MEM 125 μL混合均匀并静置5 min,2支EP管的液体轻轻混合均匀、静置20 min;混合液加入培养瓶中,与换好的培养液摇晃混匀;2种细胞的对照组按上述方法进行转染。将培养瓶置于37 ℃的恒温加湿培养箱中培养6 h后换液。
1.2.2皮下成瘤实验及分组 取人肝癌Hep3B细胞(1×106个)皮下接种于所有小鼠右侧腹肋下,观察裸鼠皮下成瘤情况;1周后将皮下成瘤的30只小鼠随机分为对照组[DMSO 20 μg/(kg·d)]、乐伐替尼组[注射乐伐替尼4 μg/(kg·d)]及瑞格菲尼组[注射瑞格菲尼20 mg/(kg·d)],10只/组,每2 d对各组小鼠进行皮周注射,持续3周;末次给药后24 h处死小鼠,取肿瘤块,待后续实验使用。
1.2.3细胞培养及实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)检测 取人肝癌Hep3B、SMMC-7721细胞,分别转染TGF-β1的空载体、干扰质粒后置于含5%胎牛血清及1%青霉素-链霉素双抗的DMEM培养基中,37 ℃、5%CO2加湿培养箱中培养;使用Trizol试剂分别从上述细胞中提取总RNA,用PrimeScript RT试剂盒进行逆转录,用SYBR Prime Script RT-PCR试剂盒进行qRT-PCR试验,检测肝癌细胞中HIF1α、MYC、HIF2α、STAT3、MUC1-C、CDK5、MAPK14、EGFR、ALK及TGF-β1的mRNA表达水平,所有测定均重复3次。见表1。

表1 qRT-PCR引物序列Tab.1 Primer sequences of qRT-PCR
1.2.4Western blot实验 分别取各组小鼠的皮下瘤组织及1.2.2项下各组肝癌细胞加入RIPA缓冲液,置于冰上裂解40 min,4 ℃、12 000 r/min离心30 min,取上清液于5×SDS-PAGE上样缓冲液中煮沸10 min,10%SDS-PAGE分离,转移到硝酸纤维素膜上;将膜置于含5%脱脂奶粉的TBST中室温封闭1 h,4 ℃与抗PD-L1(1 ∶3 000)、抗TGF-β1(1 ∶500)和抗GAPDH(1 ∶3 000)的抗体孵育过夜;次日与PD-L1和TGF-β1的二抗于室温孵育2 h,TBST溶液洗脱3次,增强化学发光(Electro Chemi Luminescence,ECL)检测,使用ImageJ图像分析软件分析PD-L1和TGF-β1的表达量。
1.3 统计学分析
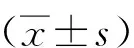
2 结果
2.1 药物对PD-L1各上游基因的调控作用
qRT-PCR检测结果显示,与对照组相比,乐伐替尼组和瑞格菲尼组小鼠皮下肝癌移植瘤组织中HIF1α、MYC、HIF2α及MUC1-CmRNA表达均上调,STAT3、CDK5、MAPK14、EGFR及ALKmRNA表达均下调,但乐伐替尼组TGF-β1 mRNA表达增加,瑞格菲尼组TGF-β1 mRNA表达降低,差异均有统计学意义(P<0.05)。见图1。

注:(1)与对照组比较,P<0.05。图1 各组小鼠皮下肝癌移植瘤组织中PD-L1各上游基因的表达(qRT-PCR)Fig.1 The expression levels of the upstream gene of PD-L1 in the xenograft tumors tissues of each group(qRT-PCR)
2.2 药物对PD-L1和TGF-β1的影响
qRT-PCR结果显示,与对照组比较,乐伐替尼组肝癌Hep3B和SMMC-7721细胞的TGF-β1 mRNA表达水平均上升,瑞格菲尼组的TGF-β1 mRNA表达水平下降(P<0.05,图2A); Western blot结果显示,与对照组比较,乐伐替尼组肝癌Hep3B和SMMC-7721细胞的PD-L1和TGF-β1蛋白表达量均上升,瑞格菲尼组PD-L1和TGF-β1蛋白表达量下降,差异均有统计学意义(P<0.05,图2B和2C)。
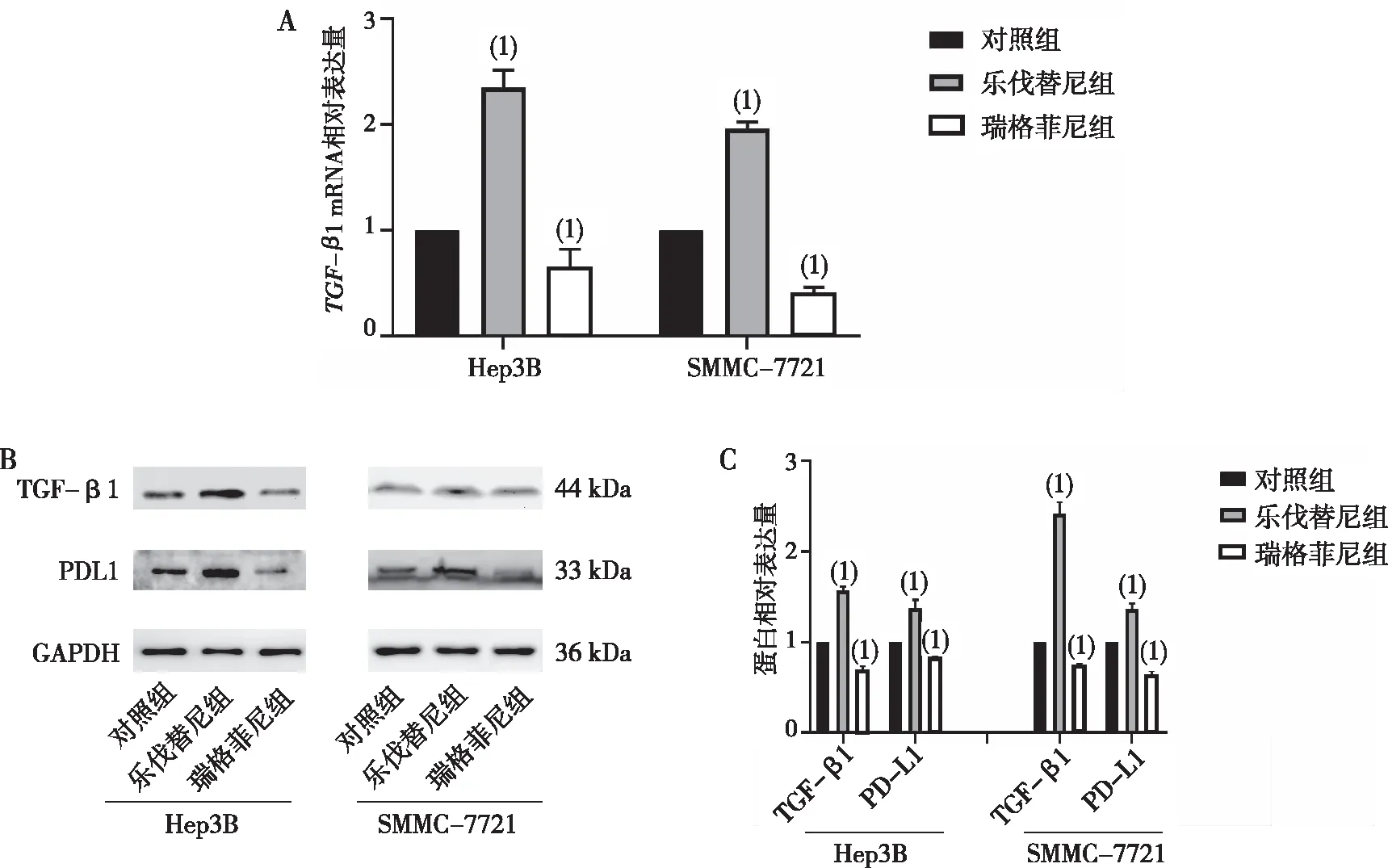
注:A为qRT-PCR检测结果,B、C为Western blot检测结果;(1)与对照组相比,P<0.05。图2 乐伐替尼组和瑞格菲尼组不同肝癌细胞中TGF-β1和PD-L1的表达Fig.2 Expression of TGF-β1和PD-L1 in hepatocellular carcinoma cells in lenvatinib group and regorafenib group
2.3 干扰RNA转染效果的验证
转染siRNA后qRT-PCR检测结果显示,肝癌Hep3B和SMMC-7721细胞干扰组TGF-β1 mRNA表达量分别较对照组降低,差异均有统计学意义(P<0.05,图3A);Western blot检测结果显示,肝癌Hep3B和SMMC-7721细胞干扰组的TGF-β1蛋白表达量分别较对照组降低,差异均有统计学意义(P<0.05,图3B和3C)。

注:A为qRT-PCR检测结果,B、C为Western blot检测结果;(1)与对照组比较,P<0.05。图3 对照组和干扰组TGF-β1的表达Fig.3 Expression of TGF-β1 in the control and interfering group
2.4 干扰TGF-β1表达后对肝癌细胞PD-L1表达的影响
qRT-PCR结果显示,肝癌Hep3B和SMMC-7721细胞干扰组的PD-L1 mRNA表达量分别较对照组降低,差异均有统计学意义(P<0.05,图4A);Western blot 结果显示,肝癌Hep3B和SMMC-7721细胞干扰组的TGF-β1和PD-L1蛋白表达量分别较对照组下降,差异均有统计学意义(P<0.05,图4B和4C)。

注:A为qRT-PCR检测结果,B、C为Western blot检测结果;(1)与对照组相比,P<0.05。图4 抑制TGF-β1后肝癌细胞PD-L1的表达Fig.4 Expression of PD-L1 after inhibited the expression of TGF-β1
3 讨论
瑞格菲尼和乐伐替尼具有多个靶点,并在肿瘤治疗中广泛使用,且两者均已获得FDA批准,可用于治疗肝细胞癌[20]。然而,以分子靶向的肿瘤很少能完全抑制肿瘤,药物的治疗作用往往是暂时的,因此,大多数患者最终会产生耐药性并复发[21]。因此,迫切需要更有效的治疗策略和药物,来改善表现出抗药性的肝细胞癌患者的预后。PD-L1是PD1的配体,在许多类型的肿瘤细胞(包括黑素瘤,卵巢癌和肺癌)中均表达上调[22-23]。由于PD1和PD-L1的阻断在抑制肿瘤上已产生了可喜的临床效果,因此,了解两种分子靶向治疗药物影响PD-L1的调节机制可能有助于寻找有效的临床治疗策略。本研究先构建了裸鼠的皮下肝癌成瘤模型,根据文献报导,本实验常规使用雌性裸鼠[24];同时通过阅读文献,筛选出与PD-L1相关度较高的调控基因HIF1α、MYC、HIF2α、STAT3、MUC1-C、CDK5、MAPK14、EGFR、ALK及TGF-β1,先进行qRT-PCR实验,结果显示乐伐替尼和瑞格菲尼对TGF-β1具有反向调节作用,这与2种靶向药对PD-L1的调节方式一致。本研究中qRT-PCR对裸鼠植皮下肝癌移植瘤中PD-L1的上游调控基因进行检测结果发现,乐伐替尼和瑞格菲尼对TGF-β1表达出现了差异性调节,即乐伐替尼使TGF-β1表达增加,瑞格菲尼组使TGF-β1表达降低,再通过qRT-PCR和Western blot在细胞水平上验证乐伐替尼和瑞格菲尼对TGF-β1表达的调控,结果与肝癌组织一致。因此推测乐伐替尼和瑞格菲尼可能通过TGF-β1调节PD-L1的表达,进而在肝癌中产生不完全相同的治疗效果。
TGF-β1是一种多功能的多肽细胞因子,在炎症中起作用,由巨噬细胞、基质细胞和肿瘤细胞产生[25]。在缺氧和炎性条件下,TGF-β1通过调节多种细胞过程(例如细胞增殖,分化,迁移和凋亡)从而在肿瘤进展中发挥作用[26-28]。最近的证据表明,TGF-β1是癌前细胞中的主要肿瘤抑制因子,但在癌症进展晚期,TGF-β1可诱导上皮-间质转化(epithelial-mesenchymal transition,EMT)并导致癌细胞转移增加[29]。由于TGF-β1在转移过程中的关键作用,已开发出靶向TGF-β1信号转导的拮抗剂来治疗癌症[30]。但是,TGF-β1与免疫检查点之间的关系尚不清楚。虽然乐伐替尼和瑞格菲尼对瘤体中的TGF-β1具有反向调节作用,但肿瘤的发生发展是一个复杂的过程,因此进一步在肝癌SMMC-7721和Hep3B细胞中用qRT-PCR法和Western blot分别从分子和蛋白水平检测乐伐替尼和瑞格菲尼对肝癌细胞TGF-β1 表达量的影响,结果提示乐伐替尼和瑞格菲尼导致肝癌细胞TGF-β1的相反调节。转染siRNA干扰TGF-β1的表达,用qRT-PCR从分子水平确认转染成功,肝癌细胞中TGF-β1 mRNA表达量下降。而TGF-β1被抑制后,PD-L1的表达下调:qRT-PCR和Western-blot结果均提示,转染TGF-β1 shRNA后,PD-L1 mRNA及蛋白表达量均下降。
综上所述,本研究确定了瑞格菲尼和乐伐替尼对肝癌细胞中PD-L1和TGF-β1之间的机制和功能联系。这些结果为靶向TGF-β1/PD-L1轴建立了潜在的临床策略,该调控机制可能会提高多激酶激酶抑制剂的疗效,并成功解决耐药性问题。

