人肺鳞癌类器官三维培养体系的建立*
方译萱,邹心如,沈林艺,王天池,薛 群,张 曙,季俐俐
(1 南通大学医学院病理系,江苏226001;南通大学附属医院2 胸心外科;3 病理科)
长期化疗导致的耐药性是影响肺癌整体治疗效果,导致化疗失败的主要原因之一,深入研究肺癌耐药机制及开发新的靶向药物具有重要的临床意义,从基础研究转化为临床实际治疗是研发治疗肺癌新药的重大课题。传统肿瘤研究模型包括肿瘤细胞系(patient-derived cancer cell lines,PDC)及人体肿瘤组织小鼠移植模型(patient-derived xeografts,PDX),然而它们的弊端日益显露,包括瘤细胞异质性及其体内特征的丢失、肿瘤移植成功率低、肿瘤样本量大和实验周期较长等问题。类器官技术被Science 杂志评选为2013年科技发展的十大突破之一[1],研究者们利用该技术成功建立了肿瘤类器官模型(patientderived organoids,PDO)。2019年Se Jin Jang 等利用肺癌患者的肿瘤组织进行3-D 培养,建立了肺癌类器官库[2]。本研究我们根据文献报道的方法,结合自身实验条件成功构建了人肺鳞癌类器官三维培养体系的流程和方法,报告如下。
1 材料与方法
1.1 主要试剂 Advanced DMEM/F-12,GlutaMAX,HEPES,Antibiotic -Antimycotic,B -27 Supplement,Recovery Cell Culture Freezing Medium,杜氏磷酸盐缓冲液(DPBS,pH 7.2)(Gibco/Thermo Fisher 公司,美国);重组人EGF,基质胶(Corning 公司,美国);0.25%胰酶(Gibco 公司,美国);N-Acetyl-L-cysteine,胶原酶(Sigma 公司,美国);抗P63 抗体(Santa Cruz 公司,美国);抗TTF-1 抗体(Santa Cruz 公司,美国);重组人FGF-4、重组人FGF-10、重组人Noggin(Peprotech 公司,美国);TGF-β 受体抑制剂A83-01(Tocris 公司,美国);Rho 激酶抑制剂Y-27632(Selleck Chemicals 公司,美国)。所有有关人肺鳞癌标本获取的实验过程均在南通大学附属医院伦理委员会的监督指导下完成,符合医学伦理学要求。人肺鳞癌标本的获取已获得患者的知情同意。
1.2 实验方法
1.2.1 人肺鳞癌肿瘤细胞的分离及体外类器官培养的建立:收集2019年1月—2020年1月南通大学附属医院早期非小细胞肺癌(NSCLC)患者手术切除的新鲜肿瘤标本,冰上剪碎为约4 mm 直径大小瘤组织块,用冷PBS 缓冲液冲洗。随后用胶原酶消化1 h,继而用胰酶TrypLE Express 于37 ℃轻微震荡消化10 min,形成单细胞悬液。细胞计数,将细胞与基质胶重悬,按50 μL/孔接种于24 孔板以形成基质胶凝固液滴(matrix dome),置于培养箱37 ℃,10~20 min,凝固基质胶。每孔加入500 μL 肺鳞癌类器官条件培养基,完全没过基质胶凝固液滴,37 ℃,5%CO2条件下维持培养。肺鳞癌类器官体外培养基中各种添加成分如下:Glutamax,2 mmol/L;HEPES,10 mmol/L;Antibiotic-Antimycotic,100 U/mL;N-Acetyl-L-cysteine,1.25 mmol/L;Recombinant Human EGF,50 ng/mL;Recombinant Human FGF-10,100 ng/mL;Recombinant Human FGF-4,100 ng/mL;Recombinant Human Noggin,100 ng/mL;A 83-01,0.5 μmol/L;Y-27632,10 μmol/L;B-27 Supplement,50×稀释使用。
1.2.2 人肺鳞癌类器官的传代和培养:预先将无菌24 孔培养板放置37 ℃培养箱预热,基质胶提前1~2 h冰上融化。培养的类器官弃去培养基,加入4 ℃DPBS,将基质胶吹打成碎片,转移至15 mL 离心管。100g 离心5 min,弃去上清,加入0.25%胰酶后吹打均匀,37 ℃水浴10~30 min。期间用1 mL 枪头每隔10 min 反复吹打,把类器官吹打成碎片。显微镜下观察细胞分离情况,当大部分解离为单细胞或含3~4个细胞的细胞团时,迅速终止消化。加入含10%FBS培养基,转移至15 mL 离心管,4 ℃下250 g 离心5 min。弃去绝大部分上清,仅在管底留5~10 μL。离心管于冰上静置3 min,使管壁上残余液体沉至管底,然后小心吸去多余上清。按照24 孔每孔加入200 μL 基质胶的量(按1∶3 比例重新接种),重悬细胞沉淀后,再次垂直种于24 孔板(50 μL/孔)。24 孔板先在超净台室温静置1~2 min,随后置于37 ℃细胞培养箱5~10 min 使基质胶变硬,最后每孔加入500 μL 培养基,置于37 ℃细胞培养箱培养,隔天换液1 次。
1.2.3 人肺鳞癌类器官的冷冻:以24 孔板为例,冻存前1天移去多余的培养液,每孔加入1 mL Recovery Cell Culture Freezing Medium。用含有10%FBS 的预冷DPBS 预冷1 mL 枪头,按照细胞传代培养手册,收集分散细胞,轻柔地将基质胶打散为小块。将含有Freezing Medium 的类器官细胞悬液吸入预先标记好的2 mL 冷冻管中。将冷冻管置于室温平衡的冷冻皿中,并转移至-80 ℃过夜,次日将冷冻管放入液氮罐中长期保存。建议在正常传代日期前3~4天冻存肺鳞癌类器官,这样冻存的类器官在解冻复苏后细胞生长状态较好(图1,封二)。
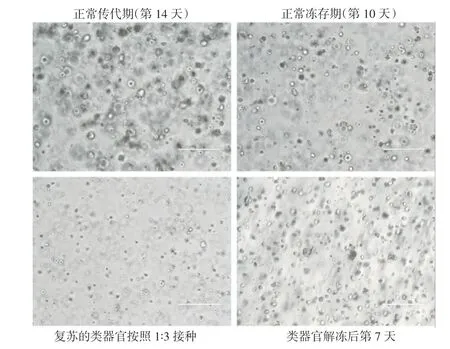
图1 肺鳞癌类器官的体外培养倒置显微镜显示最佳冻存期及复苏照片(bar=400 μm)
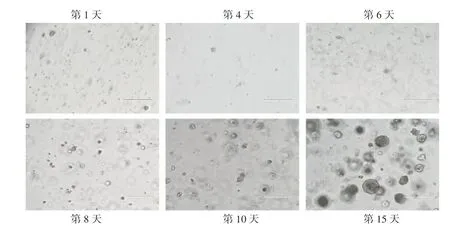
图2 肺鳞癌类器官体外培养的连续生长(bar=400 μm)
1.2.4 人肺鳞癌类器官的形态学及分子病理学分析:对建立的肺癌类器官模型进行体外连续培养15天,明视野显微镜下观察肺癌类器官的形态。为了获得分子病理学的结果,需要对肺癌组织类器官进行Histogel 包埋及后续肺癌常用标志物的免疫组化染色。具体步骤:Histogel 提前于65 ℃水浴1~2 h 使其液化。吸掉培养的肺癌类器官多余培养基,常温PBS轻柔清洗2 遍,4%室温多聚甲醛固定2 h。在等待固定过程中将冷冻包埋模具冰上预冷,取150 μL 已经液化的Histogel 铺于包埋模具的底部,并继续置于冰上冷冻凝固。吸掉固定好的类器官组织中的多聚甲醛,以ddH2O 小心清洗3 遍。随后用手术刀将类器官组织连同基质胶轻刮下来置于包埋模具中已凝固的Histogel 胶面上,在其上方继续加入150 μL Histogel,置于冰上10~15 min 以凝固形成三明治结构。将凝固好的Histogel组织块用手术刀从冷冻包埋模型中切下,转移至组织包埋盒中。组织包埋盒于10%福尔马林固定16~20 h,70%乙醇脱水1~2天后进行常规石蜡包埋及后续HE、免疫组化染色。类器官切片的处理方式与其他组织切片一样,使用一般脱蜡、补液、抗原修复等的常规步骤。免疫组化检测肺鳞癌最常用标记物P63 及肺腺癌最常用免疫标志物TTF-1。
2 结 果
2.1 体外培养 类器官经过酶解、培养及传代至少3 代后,用倒置显微镜观察其培养形态,细胞团样生长状况良好的样本可判定为成功建模的类器官。图2(封二)为对成功建立的肺鳞癌类器官进行体外连续培养15天,类器官呈团样生长,并在体外培养至15天内传代,传代按照1∶3 比例。显示肺鳞癌类器官可以通过长期传代或冷冻保存维持,为实验提供稳定的细胞来源。
2.2 肺鳞癌类器官组织病理学检测 HE 染色镜检结果如图3(封二)所示,镜下可见细胞核浆比增高,细胞核具有明显的异型性,符合恶性肿瘤细胞的形态特征。细胞成团分布,与组织学上鳞癌的癌巢结构特征相似。免疫组化镜检结果如图4(封二)所示,P63 和TTF-1 均为胞核定位,染色结果显示P63 阳性,TTF-1 阴性,符合肺鳞癌分子病理特征。
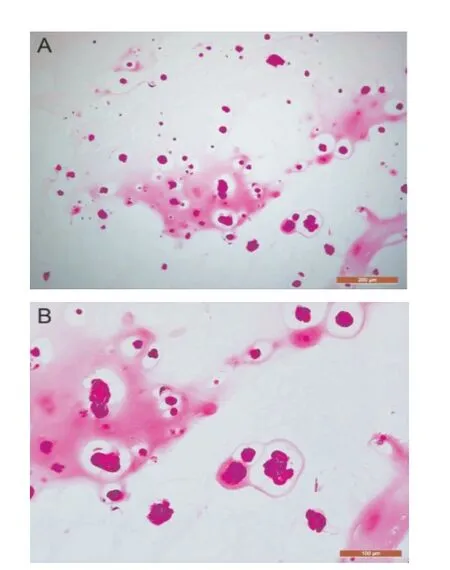
图3 肺鳞癌类器官HE 染色(A:bar=200μm;B:bar=100μm)
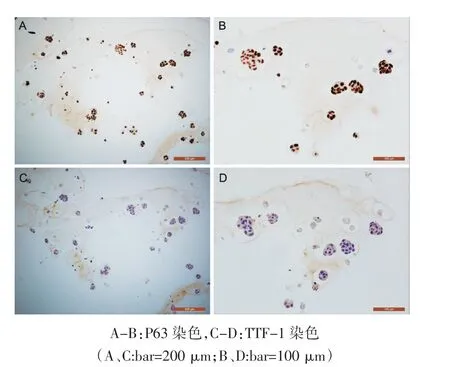
图4 肺鳞癌类器官免疫组化
3 讨 论
由于类器官方法学在疾病模型构建和药物筛选方面的实用性,近年来获得越来越多的关注[3-6]。本研究目的在于从肺鳞癌患者肿瘤组织中探索建立肺鳞癌类器官体外培养的实验方案,将能很好模拟体内肺癌肿瘤组织的生长特点和微环境,更客观反映肿瘤组织对药物的反应,并且相对动物模型能在短期内完成肺癌疾病模型的建立,快速进行药物敏感性检测与药物筛选,为肺癌药物研发提供理想的体外模型。
最近研究报道描述了生成NSCLC 类器官培养的两种截然不同的方法[7-8]。其中一种方法中作者提出由于在NSCLC 类器官培养过程中出现大量非肿瘤细胞污染,可以用MDM2 抑制剂nutlin-3a 处理类器官培养基,以使得含有TP53 突变的肿瘤细胞在培养过程中能富集起来[8]。然而长期暴露于这样的化学试剂中将使肿瘤细胞的生物学特征发生难以预料的后果,虽然TP53 突变在NSCLC 中较普遍,但并非出现在所有肺癌患者中,因此这种培养方法被排除。我们实验中采用培养基营养成分参考了Ming-Sound Tsao 实验室报道的文献[9],从倒置显微镜显示的结果可以初步判断肺鳞癌类器官培养模型的建立获得成功。随后对建立的肺鳞癌类器官进行Histogel 包埋及常规石蜡切片,HE 染色可见肺细胞核浆比高,核染色深,核异质性明显,符合恶性肿瘤细胞病理学特征,同时瘤细胞成团生长,类似于鳞癌肿瘤细胞的癌巢状生长。免疫组化染色显示肿瘤细胞呈P63 阳性,TTF-1 阴性,符合肺鳞癌细胞分子病理学特点。上述结果均提示本实验成功建立了肺鳞癌类器官的体外培养。
肺癌的发生发展和耐药性常常由基因扩增、缺失和突变驱动。2012年Cancer 发表的一项针对肺鳞癌的TCGA 项目研究结果显示,平均每个肺鳞癌患者体内可以检测到360个外显子突变,165个基因重组,323个基因扩增数目变更,其中最常见的基因突 变 包 括TP53,CDKN2A,PTEN,PIK3CA,KEAP1,MLL2,HLA-A,NFE2L2 等[10]。Ming-Sound Tsao 实验组报道,他们建立的NSCLC 类器官很好地保留了对应原肿瘤组织的基因突变及基因拷贝数变化,测序结果显示类器官内含有原来NSCLC 患者常见的基因突变,包括TP53,DDR2,KRAS,KEAP1,CUL3,NOTCH 等[9]。由于条件限制,本实验未对类器官及其相应的原肿瘤组织进行测序。后续实验可考虑提取类器官及对应原肿瘤组织的DNA,构建DNA 文库,进行二代测序,并提取拷贝数变异(CNVs)及单核苷酸变异(SNVs)数据,利用生物信息学软件判断类器官与原肿瘤遗传信息层面的一致性,以此评估类器官基因水平的拟合度和稳定性。
总体而言,本研究提供了一种从肺鳞癌患者肿瘤组织提取细胞进行体外培养肺鳞癌类器官的实验方法,所建立的NSCLC 类器官将为肺癌基础研究提供新的理想的体外模型,并可应用于肺癌新靶向药物的高通量筛选。

